10.12: Soluciones a problemas seleccionados
- Page ID
- 79280
Ejercicio 10.1.1:

Ejercicio 10.1.2:

Ejercicio 10.2.2:

Ejercicio 10.2.3:

Ejercicio 10.3.1:

Ejercicio 10.3.2:

Ejercicio 10.3.3:

Ejercicio 10.3.4:

Ejercicio 10.3.6
La reacción de Alder retro-diels se ve favorecida entrópicamente, ya que dos moléculas están hechas de una molécula. En consecuencia, la energía se divide en estados adicionales porque los grados de libertad van en aumento. La entropía interna aumenta durante esta reacción. Matemáticamente, el término entropía es negativo en la expresión de energía libre, por lo que a medida que aumenta la entropía, la energía libre se vuelve más baja. Debido a que ese término es en realidad un producto de entropía y temperatura, un aumento de la temperatura tiene el efecto de amplificar la influencia de la entropía sobre la energía libre de la reacción. De ahí que esta reacción se vea favorecida por factores de entropía interna, que llegan a dominar a temperatura elevada.
Ejercicio 10.3.7:

Ejercicio 10.3.8:

Ejercicio 10.4.1:
El anhídrido maleico está polarizado, con densidad electrónica atraída hacia el grupo funcional anhídrido en un lado del anillo. Como resultado, el otro lado del anillo queda más positivo, y atraerá la densidad de electrones polarizables del dieno.

Ejercicio 10.4.2:
Los ácidos de Lewis frecuentemente activan compuestos carbonílicos hacia la interacción con nucleófilos. Lo hacen uniéndose a los pares solitarios en el oxígeno carbonilo, alejando la densidad electrónica del oxígeno y, inductivamente, lejos de la porción vecina de la molécula.

Ejercicio 10.4.3:

Ejercicio 10.4.4:

Ejercicio 10.4.5:

Ejercicio 10.4.6:

Ejercicio 10.4.7:

Ejercicio 10.4.8:

Ejercicio 10.4.9:

Ejercicio 10.4.10:

Ejercicio 10.4.11:

Ejercicio 10.4.12:

Ejercicio 10.4.13:
Los dibujos indican que los dos grupos donadores de electrones están operando con propósitos cruzados. Uno dirige la densidad de electrones hacia un extremo del dieno, mientras que el otro dirige la desnidad electrónica hacia el otro extremo.

Ejercicio 10.5.1:

Ejercicio 10.8.3:
a) Oso 4, H 2 O
b) MCPBA
c) 1. O 3; 2. Me 2 S o Zn
d) 1. O 3; 2. Me 2 S o Zn
e) Oso 4, H 2 O
f) MCPBA
Ejercicio 10.8.6:
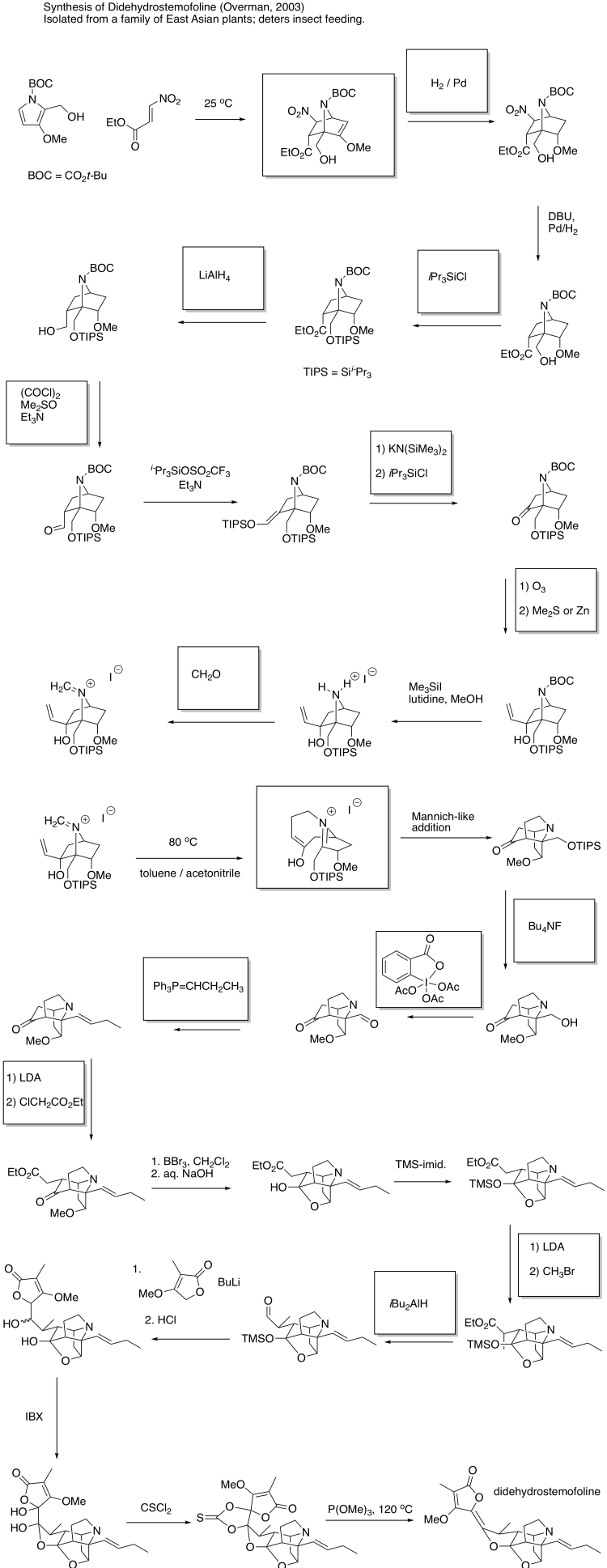
Ejercicio 10.9.2:

Ejercicio 10.9.3:

Ejercicio 10.9.4:

Ejercicio 10.10.1:

Ejercicio 10.10.2:
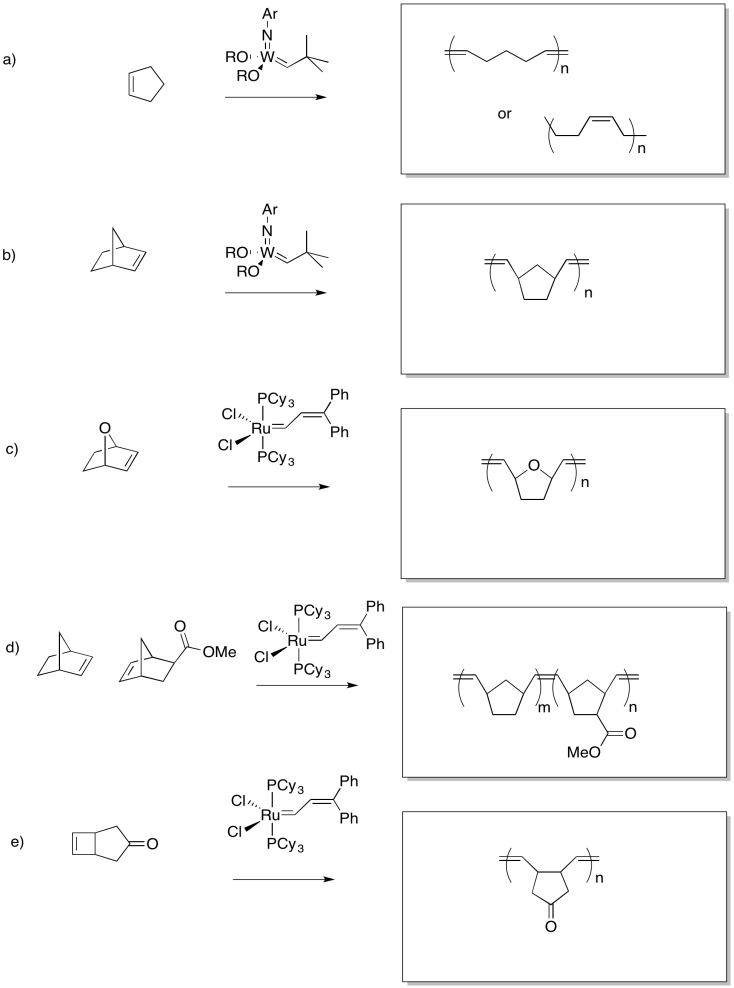
Ejercicio 10.10.3:

Ejercicio 10.10.4:


