13.5: Titulación ácido/Base
- Page ID
- 70646
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Asegúrese de comprender a fondo los siguientes conceptos esenciales:
- Dibuje una gráfica que represente la valoración de un ácido monoprótico fuerte por una base fuerte, o de una base fuerte valorada por un ácido fuerte. Identificar el punto de equivalencia y explicar su significación.
- En la parcela referida anteriormente, dibuje una parcela similar que correspondería al mismo sistema a una concentración mayor o menor.
- Dibuje una gráfica que represente la valoración de un ácido monoprótico débil por una base fuerte, o de una base débil valorada por un ácido fuerte. Identificar el punto de equivalencia y los puntos de media equivalencia.
- Explique qué es un indicador ácido-base y cómo funciona.
- Cuando las soluciones de algunos ácidos polipróticos se valoran con base fuerte, no se pueden observar todos los puntos de equivalencia. Explique las razones más comunes para ello.
- Calcular la molaridad de un AH de ácido monoprótico cuyo punto final de valoración ocurre después de que se hayan agregado V ml de base fuerte de una concentración dada.
El objetivo de una valoración ácido-base es determinar\(C_a\), la concentración nominal de ácido en la solución. En su forma más simple, la titulación se lleva a cabo midiendo el volumen de la solución de base fuerte requerido para completar la reacción
\[\ce{H_nA + n OH- → n A- + n H_2O} \label{0-1}\]
en el que\(n\) se encuentra el número de hidrógenos reemplazables en el ácido. El punto en el que esta reacción acaba de completarse se conoce como el punto de equivalencia. Esto es para distinguirse del punto final, que es el valor que observamos experimentalmente. Un átomo de hidrógeno reemplazable (a veces llamado hidrógeno “ácido”) es aquel que se puede donar a una base fuerte —es decir, a un ion OH —. Así, en el ácido acético HCOO H, solo el hidrógeno en el grupo carboxilo se considera “reemplazable”.
Lo que realmente medimos, por supuesto, es el volumen de titulante entregado por la bureta. Aprender a controlar adecuadamente la llave de paso en la parte inferior de la bureta suele requerir alguna instrucción y práctica, al igual que la lectura del volumen. Para un trabajo altamente preciso, la concentración del propio valorante debe determinarse en un experimento separado conocido como “estandarización”.
Comprensión de las curvas de valoración
Una gráfica que muestra el pH de la solución en función de la cantidad de base añadida se conoce como curva de titulación. Estas gráficas se pueden construir trazando el pH en función del volumen de base añadida, o la fracción equivalente\(ƒ\) que es simplemente el número de moles de base añadidos por mol de ácido presente en la solución. En la mayoría de las curvas de valoración ilustradas en esta sección, se grafica el pH en función de\(ƒ\). Vale la pena tomarse un tiempo para familiarizarse a fondo con la forma general de una curva de titulación como la que se muestra a continuación, en la que se titula un AH ácido débil con una base fuerte, típicamente hidróxido de sodio.

El punto de equivalencia ocurre al pH en el que la fracción equivalente ¡de la base añadida es la unidad. En este punto, la reacción
\[HA + OH^– → AB^– + H_2O \label{1-1}\]
es estequiométricamente completo; una solución que inicialmente contiene n moles de un ácido monoprótico HA ahora será idéntica a una que contenga el mismo número de moles de la base conjugada A —. En el punto de media equivalencia ¡= 0.5, las concentraciones de las especies conjugadas son idénticas: [HA] = [A —]. Esto, por supuesto, corresponde a una solución tampón (de ahí la parte relativamente plana de la curva) cuyo pH es el mismo que pK a.
A medida que la base se agrega más allá de ¡¡= 1, el pH comienza a nivelarse, sugiriendo que otro sistema tamponado ha entrado en juego. En este caso involucra el solvente (agua) y el ion hidróxido: {H 2 O} ≈ {OH-}.
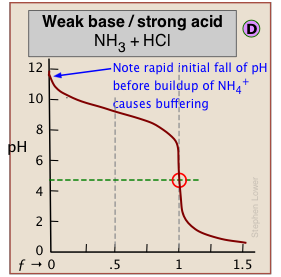
Un efecto similar se observa en el lado de pH bajo de la curva cuando se valora un ácido fuerte, como en la gráfica para la titulación de HCl a continuación. En este caso, el buffering se debe a {H 3 O +) ≈ {H2O}.
¿Cómo puede ser esto? Seguramente, la concentración de OH —, incluso cuando el pH se acerca a 14, no puede ser nada como la de [H 2 O] ¡que será de aproximadamente 55.5 M en la mayoría de las soluciones! Este punto fino (junto con la mención de H 2 O/OH — buffering) rara vez se menciona en cursos elementales porque la teoría detrás de él involucra algunos elementos bastante esotéricos de la termodinámica de solución. No obstante, en caso de que tenga curiosidad, tenga en cuenta que los corchetes en {H 2 O} ≈ {OH —} denotan actividades, no concentraciones. Y por convención la actividad de un líquido puro (H 2 O en este caso) es unidad. A un pH de alrededor de 12, PoH = 2, [OH —] = .01. A esta concentración de iones bastante alta, {OH —} será algo menor que esta, pero las dos actividades serán lo suficientemente similares como para producir el efecto tampón que observamos.
El pH de la solución en su punto de equivalencia será de 7 si estamos valorando un ácido fuerte con base fuerte, como en HCl + NaOH → H 2 O + NaCl. No obstante, si el ácido es débil, como en la gráfica anterior, la solución será alcalina. Este pH se puede calcular a partir de C b y K b de una manera exactamente análoga a la utilizada para calcular el pH de una solución de un ácido débil en agua.

Es importante entender que la fracción equivalente ¡de base que se debe agregar para alcanzar el punto de equivalencia es independiente de la fuerza del ácido y de su concentración en la solución. Toda la utilidad de la titulación como medio de análisis cuantitativo se basa en esta independencia; en todos los casos estamos midiendo solo el número total de moles de hidrógenos “ácidos” en la muestra sometida a titulación.
Las fuerzas ácidas y básicas determinan la forma de la curva
Aunque la fuerza de un ácido no tiene efecto sobre la ubicación del punto de equivalencia, sí afecta la forma de la curva de titulación y puede estimarse en una gráfica de la curva.


Cuanto más débil sea el ácido que se está titulando, mayor será el pH inicial (a ƒ=0), y menor será la altura vertical de la parcela cerca del punto de equivalencia. Como veremos más adelante, esto puede dificultar la localización del punto de equivalencia si el ácido es extremadamente débil.
Estimación de la fuerza ácida
Como se muestra en la gráfica anterior, el pK a de un ácido débil puede estimarse anotando el pH que corresponde al punto de media titulación ¡= 0.5. Recordando que el pH está controlado por la relación de concentraciones de especies conjugadas
anterior, el pK a de un ácido débil puede estimarse anotando el pH que corresponde al punto de media titulación ¡= 0.5. Recordando que el pH está controlado por la relación de concentraciones de especies conjugadas
\[pH = pK_a + \log \dfrac{[A^]}{[HA]} \label{1-2}\]
será evidente que esta ecuación reduce a pH = pK a cuando la titulación es medio completa (es decir, cuando [HA] = [A —]), el pH de la solución será idéntico al pK a del ácido. Esta ecuación no funciona para los ácidos fuertes debido al fuerte tamponamiento que se produce al pH muy bajo al que ¡= 0.5.

Como se indica aquí, el buffering no tiene nada que ver con el ácido HCl en sí (que no existe como tal en el agua), sino con sus productos de disociación H 3 O + y OH —, “el ácido y base más fuertes que pueden existir en el agua”.
Curvas de valoración monopróticas
Los dos principios siguientes rigen la forma detallada de una curva de valoración:
- Cuanto más fuerte sea el ácido o la base, mayor será la pendiente de la curva cerca del punto de equivalencia;
- Cuanto más débil sea el ácido o la base, mayor será la desviación del pH de la neutralidad en el punto de equivalencia.
Es importante entender las razones de estas dos relaciones. El segundo es el más sencillo de explicar. La titulación de un HA ácido con una base como NaOH da como resultado una solución de NaA; es decir, una solución de la base conjugada A —. Al ser una base, reaccionará con el agua para producir un exceso de iones hidróxido, dejando una solución ligeramente alcalina. La valoración de una base débil con un ácido tendrá el efecto contrario.
La extensión del salto en el pH en el punto de equivalencia está determinada por una combinación de factores. En el caso de un ácido débil, por ejemplo, es probable que el pH inicial sea mayor, por lo que la curva de titulación comienza más alta. Además, cuanto más débil sea el ácido, más fuerte será su base conjugada, por lo que cuanto mayor será el pH en el punto de equivalencia. Estos dos factores elevan la parte inferior de la curva de titulación. La extensión superior de la curva está, por supuesto, limitada por la concentración y la fuerza del valorante.

Estos principios son claramente evidentes en las parcelas anteriores para las titulaciones de ácidos y bases que tienen diversas resistencias. Observe las curvas azules que representan la titulación del agua pura (un ácido muy débil) con ácido o base fuerte.
Galería de curvas de valoración monopróticas

Cuando tanto el valorante como la muestra son “fuertes”, obtenemos parcelas verticales largas a ¡= 1. ¡Agregar incluso media gota de titulante puede llevarnos a través del punto de equivalencia!

Cuando uno de los reactivos es débil, el pH cambia rápidamente al principio hasta que se establece el tamponamiento.
← En (C), el inicio de H 2 O/OH- buffering cerca de ƒ=1 hace que el punto de equivalencia sea más difícil de localizar.
Las titulaciones “débil/débiles” tienden a ser problemáticas a medida que las regiones amortiguadas se acercan a ƒ=1. El punto de equivalencia pH de 7 en estos ejemplos refleja la casi igualdad de pK a y pK b de los reactivos.

Tratar con ácidos muy débiles
Puede ser difícil detectar de manera confiable el punto de equivalencia en la titulación del ácido bórico (pK a = 9.3) o de otros ácidos igualmente débiles a partir de la forma de la curva de valoración*. *Un interesante experimento de laboratorio estudiantil que emplea un reactivo auxiliar (manitol) para hacer que el ácido bórico sea más fuerte y así más fácilmente valorable fue descrito en J. Chem Ed. 2012, 89, 767-770.

El problema aquí es que las soluciones acuosas están tamponadas contra el cambio de pH a rangos de pH muy bajos y muy altos. Un ejemplo extremo ocurre en la titulación de agua pura con un ácido o base fuerte. En estos extremos de pH las concentraciones de H 3 O + y de OH —son lo suficientemente grandes como para que exista un sistema tampón competidor (ya sea H 3 O + /H 2 O o H 2 O/OH —, dependiendo de si la solución es altamente ácida o altamente alcalino) entra en juego.
Por qué solemos usar un valorante “fuerte”
Las gráficas anteriores muestran claramente que los puntos de equivalencia más fácilmente detectables ocurren cuando un ácido con se titula con una base fuerte como el hidróxido de sodio (o una base se titula con un ácido fuerte).
En la práctica, muchas de las titulaciones que se llevan a cabo en la investigación, la industria y la práctica clínica involucran mezclas de más de un ácido. Los ejemplos incluyen aguas naturales, fluidos fisiológicos, jugos de frutas, elaboración de vino, elaboración de cerveza y efluentes industriales. Para valorar este tipo de muestras, el uso de cualquier otra cosa que no sea un valorante fuerte presenta la posibilidad de que el valorante pueda ser más débil que uno o más de los componentes “más fuertes” de la muestra, en cuyo caso sería incapaz de valorar estos componentes hasta su finalización.
En términos de energías libres de protones, la fuente de protones (el valorante ácido) sería incapaz de entregar una cantidad equivalente de protones al componente (más fuerte) de la mezcla.
Ácidos polipróticos
Habrá tantos puntos de equivalencia como hidrógenos reemplazables en un ácido. Así, en el sistema de carbonatos extremadamente importante, los puntos de equivalencia se observan tanto en ƒ=1 como en ƒ=2:


En general, existen dos requisitos para que se produzca un salto claramente discernible en el pH en una titulación poliprótica:
- Los sucesivos K a deben diferir en varios órdenes de magnitud;
- El pH del punto de equivalencia no debe ser muy alto ni muy bajo.
Separación de constantes de equilibrio sucesivas
El efecto del primer punto se observa comparando las curvas de titulación de dos ácidos dipróticos, sulfuroso y succínico. La aparición de un solo punto de equivalencia en este último es consecuencia de la cercanía de la primera y segunda constantes de disociación ácida. Las pK a's de ácido sulfuroso (abajo, izquierda) están lo suficientemente separadas como para que su curva de titulación pueda considerarse como la superposición de las de dos ácidos monopróticos independientes que tienen las K a correspondientes, lo que refleja el hecho de que los dos Los grupos ácidos —OH están conectados al mismo átomo central, de manera que la carga negativa local que permanece cuando se forma HSO 3 — actúa para suprimir la segunda etapa de disociación.
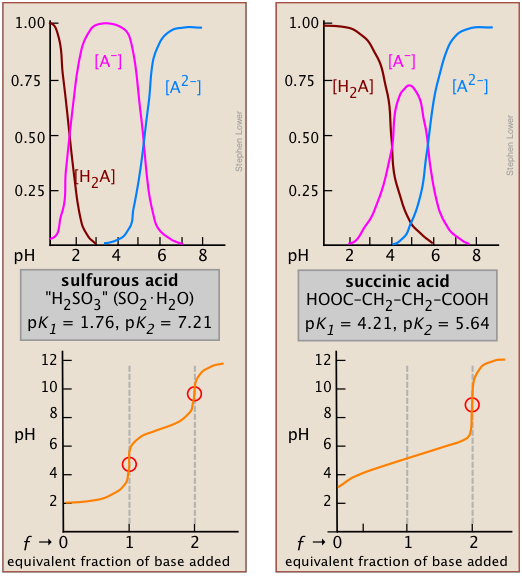
*Se puede demostrar que en el límite de n grande, la relación de K 1 /K 2 para un ácido dicarboxílico simétrico HOOC- (CH 2) n - COOH converge a un valor de 4.
En el ácido succínico, los dos grupos —COOH están físicamente más separados y por lo tanto tienden a disociarse de manera independiente*. La inspección de las curvas de distribución de especies para ácido succínico (arriba, derecha) revela que la fracción del anfolito HA nunca puede superar el 75 por ciento. Es decir, no hay pH al que se pueda decir que la reacción H 2 A → HA — + H + es “completa” mientras que al mismo tiempo el segundo paso HA — → A 2— + H + ha ocurrido en una medida insignificante. De esta manera, el aumento en el pH que normalmente se esperaría a medida que se produce HA se impedirá por el consumo de OH —en la segunda etapa que estará muy avanzada en ese punto; sólo cuando se completen todas las etapas y ya no se esté consumiendo el ión hidróxido se elevará el pH.
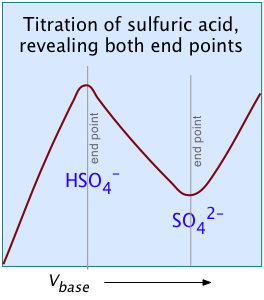
Otros dos ejemplos de ácidos polipróticos cuyas curvas de titulación no revelan todos los puntos de equivalencia son los ácidos sulfúrico y fosfórico. Debido al efecto nivelador, el K a1 aparente de H 2 SO 4 es tan cercano a K a2 = 0.01 que el efecto es el mismo que en el ácido succínico, por lo que solo se detecta el segundo punto de equivalencia.

En el ácido fosfórico, el tercer punto de equivalencia (para HPO 4 2—) está oscurecido por H 2 O-OH — tampón como se explicó anteriormente.
Detección del punto de equivalencia
Ya sea que el punto de equivalencia se revele o no por una “ruptura” distinta en la curva de titulación, corresponderá a una concentración única de iones de hidrógeno que se puede calcular de antemano. Existen muchas formas de determinar el punto de equivalencia de una titulación ácido-base.
Indicadores

¡No sobrepases el punto equiv!
El método tradicional de detección del punto de equivalencia ha sido emplear un colorante indicador, que es un segundo sistema ácido-base en el que las formas protonadas y desprotonadas difieren en color, y cuyo pK a es cercano al pH esperado en el punto de equivalencia. Si el ácido que se está valorando no es fuerte, es importante mantener la concentración del indicador lo más baja posible para evitar que su propio consumo de OH —distorsione la curva de titulación—.
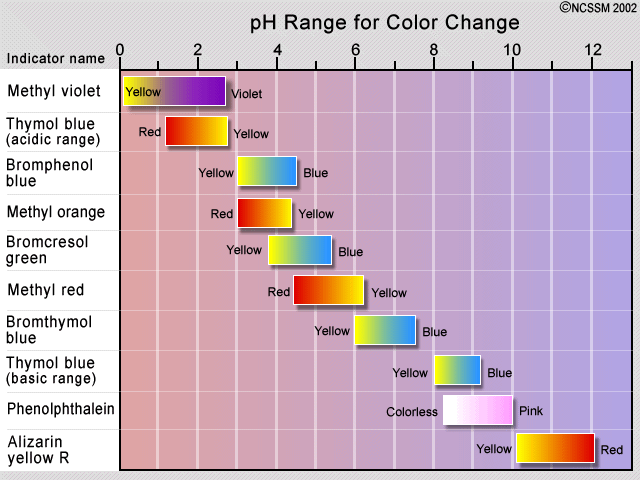
El cambio de color observado de un indicador no se produce bruscamente, sino que ocurre en un rango de aproximadamente 1.5 a 2 unidades de pH. Por lo tanto, los indicadores solo son útiles en la titulación de ácidos y bases que son lo suficientemente fuertes como para mostrar una ruptura definitiva en la curva de titulación. Algunas plantas contienen agentes colorantes que pueden actuar como indicadores de pH naturales. Estos incluyen col (se muestra), remolacha y flores de hortensias.

Para una titulación ácido fuerte - base fuerte, se puede usar casi cualquier indicador, aunque la fenolftaleína es la más comúnmente empleada. Para valoraciones que involucren ácidos o bases débiles, como en la valoración ácida de la solución de carbonato de sodio que se muestra aquí, el indicador debe tener un pK cercano al de la sustancia que se está valorando.
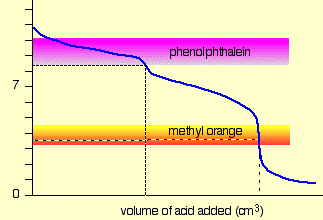
Al valorar un ácido o base poliprótico, se requieren múltiples indicadores si se quiere ver más de un punto de equivalencia. Los pK a s de fenolftaleína y naranja de metilo son 9.3 y 3.7, respectivamente.
Potenciometría: Usar un medidor de pH
El medidor de pH detecta el voltaje producido cuando los iones H + en la solución desplazan iones Na + de una fina membrana de vidrio que se sumerge en la solución.

Una forma más moderna de encontrar un punto de equivalencia es seguir la titulación por medio de un medidor de pH. Debido a que implica medir la diferencia de potencial eléctrico entre dos electrodos, este método se conoce como potenciometría. Hasta alrededor de 1980, los medidores de pH eran demasiado caros para su uso regular en los laboratorios estudiantiles, pero esto ha cambiado; la potenciometría es ahora la herramienta estándar para determinar los puntos de equivalencia.
Métodos de trazado mejorados
Trazar el pH después de que se haya agregado cada incremento de volumen del valorante puede producir una curva de titulación tan detallada como se desee, pero hay mejores formas de localizar el punto de equivalencia. El más común de estos es tomar la primera o segunda derivada de la parcela: d (pH) /d V o d 2 (pH) /d V 2 (por supuesto, para incrementos finitos de pH y volumen, estos términos se expresarían como Δ (pH) /Δ V y Δ 2 (pH) /Δ V 2.)
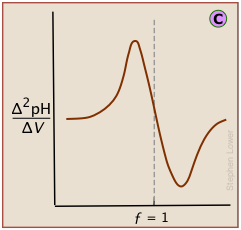
Una curva de segunda derivada localiza el punto de inflexión al encontrar donde la velocidad a la que cambia el pH es cero.

La gráfica diferencial, que muestra la tasa de cambio del pH frente al volumen del valorante, localiza el punto de inflexión que es también el punto de equivalencia

En una gráfica estándar de pH-VS-volumen de valorante agregado, el punto de inflexión se ubica visualmente a mitad de camino a lo largo de la parte más empinada de la curva.
Es poco probable que las parcelas idealizadas que se muestran anteriormente se vean en la práctica. Cuando la titulación se realiza manualmente, el valorante se agrega en incrementos, por lo que incluso la curva de titulación simple![]() debe construirse a partir de puntos sujetos a incertidumbres en la medición de volumen y pH (especialmente si esta última se estima visualmente por cambio de color de un indicador).
debe construirse a partir de puntos sujetos a incertidumbres en la medición de volumen y pH (especialmente si esta última se estima visualmente por cambio de color de un indicador).
Si estos datos se convierten entonces a forma diferencial, estas incertidumbres agregan cierta cantidad de “ruido” a los datos.
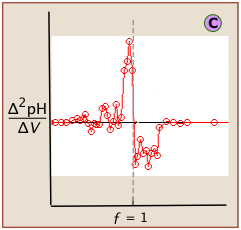
Una gráfica de segunda derivada utiliza lecturas de pH en ambos lados del punto de equivalencia, lo que facilita su localización en presencia de ruido.

La localización del punto de equivalencia depende en gran medida de la lectura correcta de solo una o dos lecturas de pH cerca de la parte superior de la parcela.

Una curva simple, trazada a partir de un pequeño número de lecturas de pH, no siempre localizará inequívocamente el punto de equivalencia.
El “ruido” en las gráficas diferenciales generalmente se puede minimizar manteniendo las concentraciones de valorante y analito por encima de 10 —3 M.
Algunas otras formas de seguir una titulación
El monitoreo del pH por medio de un indicador o por potenciometría como se describió anteriormente son las formas estándar de detectar el punto de equivalencia de una titulación. Sin embargo, ya hemos visto que en ciertos casos que involucran ácidos o bases polipróticos, algunos de los puntos de equivalencia están oscurecidos por su proximidad a otros, o por el amortiguamiento que ocurre cerca de los extremos del rango de pH. Problemas similares pueden surgir cuando la solución a valorar contiene varios ácidos diferentes, como suele ocurrir cuando se deben monitorear fluidos conectados con procesos industriales.
¡Toma la temperatura!
Las reacciones de neutralización ácido-base HA + B → A — + BH + son siempre exotérmicas; cuando los protones caen de su nivel en el ácido al de la base, la mayor parte de la caída de energía libre se libera como calor. Si el ácido y la base son ambos fuertes (es decir, totalmente disociados), la entalpía de neutralización para la reacción
\[\ce{H3O+ + OH- → 2 H2O}\]
es -68 kJ mol —1.
Consulte esta página de Wikipedia para obtener más información sobre titulaciones termométricas, incluyendo muchos ejemplos. Observe también el video sobre este tema en la sección “Videos” cerca del final de esta página.
- Las valoraciones termométricas no se limitan a las determinaciones ácido-base; también se pueden usar para seguir reacciones de precipitación, formación de complejos y oxidación-reducción.
- Se pueden utilizar con ácidos o bases polipróticos, y con mezclas que contengan más de un ácido o base.
- Son capaces de seguir titulaciones ácido-base que deben realizarse en disolventes no acuosos, donde otros métodos de titulación no son posibles.
Una curva de titulación termométrica típica consiste en dos ramas, comenzando con un fuerte aumento de la temperatura a medida que el valorante que se agrega reacciona con el analito, liberando calor. Una vez que se alcanza el punto de equivalencia, la subida disminuye rápidamente a medida que se detiene la producción de calor. Entonces, a medida que la mezcla comienza a enfriarse, la parcela asume una pendiente negativa.

Si bien se puede estimar una indicación aproximada del punto de equivalencia extrapolando las partes lineales de la curva (líneas discontinuas azules), generalmente se prefieren los métodos diferenciales descritos anteriormente.
Siga la conductancia electrolítica
Los ácidos y bases son electrolitos, lo que significa que sus soluciones conducen la corriente eléctrica. La conductividad de tales soluciones depende de las concentraciones de los iones y, en menor medida, de la naturaleza de los iones particulares. Cualquier reacción química en la que haya un cambio en la cantidad total de iones en la solución generalmente puede ser seguida por el monitoreo de la conductancia. Las titulaciones ácido-base entran dentro de esta categoría. Consideremos, por ejemplo, la titulación de ácido clorhídrico con hidróxido de sodio. Esto puede ser descrito por la ecuación
\[\ce{H^{+} + Cl^{–} + Na^{+} + OH^{–} → H2O + Na^{+} + Cl^{–}} \label{2-1}\]
lo que demuestra que dos de las cuatro especies de iones que se combinan desaparecen en el punto de equivalencia. Durante el transcurso de la titulación, la conductancia de la solución disminuye a medida que se consumen iones H + y Cl —. En el punto de equivalencia la conductancia pasa por un mínimo, y luego se eleva a medida que la adición continua de valorante agrega más iones Na + y OH — a la solución.

Cada tipo de ion hace su propia contribución a la conductividad de la solución. Si pudiéramos observar el aporte de cada ion por separado, ver que las pendientes para H + y OH — son mucho mayores. Esto refleja las conductividades mucho mayores de estos iones debido a su movimiento excepcionalmente rápido a través de la solución al saltar a través de las moléculas de agua.

Sin embargo, debido a que las conductancias de los iones individuales no se pueden observar directamente, las mediciones de conductancia siempre registran las conductancias totales de todos los iones en la solución. El cambio en la conductancia que realmente se observa durante la titulación de HCl por hidróxido de sodio es la suma de las conductancias iónicas mostradas anteriormente.
Para la mayoría de las titulaciones ácido-base ordinarias, la conductimetría rara vez ofrece alguna ventaja especial sobre el análisis volumétrico regular usando indicadores o potenciometría. Esto es especialmente cierto si el ácido que se está valorando es débil; si el pK a está muy por debajo de 2, la línea salina ascendente (Na + al valorar con NaOH) abrumará la caída en la contribución que la pequeña cantidad de H+ hace a la conductancia, evitando así cualquier mínimo en la curva de conductancia total de ser visto.
Sin embargo, en algunos casos especiales como los que se ilustran a continuación, la conductimetría es el único método capaz de dar resultados útiles.

Estos ejemplos ilustran dos capacidades únicas de titulaciones conductimétricas: (izquierda) Titulación de una mezcla de dos ácidos y (derecha) Titulación de un ácido poliprótico fuerte →
Debido a que H 2 SO 2 puro es una molécula neutra, no contribuye a la conductancia, que se eleva a un máximo en el punto de equivalencia.
Automatizar el proceso
En cuatro años de sesiones de laboratorio universitario, muchas especialidades de Química probablemente llevarán a cabo menos de una docena de titulaciones. Sin embargo, en el mundo real, el tiempo es dinero, y ya pasaron los días en que los técnicos se empleaban a tiempo completo solo para valorar múltiples muestras en empresas como cervecerías, procesamiento de alimentos (como la mezcla de jugo de naranja enlatado), laboratorios clínicos e investigación bioquímica.
Cálculos de valoración
Se realiza una valoración añadiendo un volumen\ Vo suficiente de la solución valorante a un volumen conocido\ Vt de la solución que se está valorando. Esta adición continúa hasta que se alcanza el punto final. El punto final es nuestra aproximación experimental del punto de equivalencia en el que la reacción ácido-base es estequiométricamente completa (¡¡= 1). La cantidad que realmente medimos en el punto final es el volumen V_ep de valorante entregado a la solución sometida a titulación.
La solución que se está valorando a menudo se denomina analito (la sustancia que se está “analizando”) o, menos comúnmente, como el título. Emplearemos este último término en lo que sigue.
En una titulación simple de un ácido monoprótico HA por una base B, el punto de equivalencia corresponde a la finalización de la reacción
\[\ce{HA + B → A^{–} + BH^{+} }\label{3-1}\]
cuando se hayan combinado cantidades equimolares de HA y B, es decir,
M HA = M B (donde M representa el número de moles).
Recordemos que el número de moles viene dado por el producto del volumen y concentración:
L × mol L —1 = mol,
mL x mMol ml —1 = mmol.
Debido a que estamos midiendo el volumen de titulante más que el número de moles, necesitamos usar su concentración para vincular las dos cantidades. Entonces, si estamos valorando la base B con HA ácido, se alcanza el punto final cuando se ha agregado un volumen V de HA. El número de moles de HA que hemos agregado en el punto final viene dado por el producto de su volumen y concentración
\[M_{HA} = V_{HA} \times C_{HA} \label{3-2}\]
Y debido a que la reacción\ ref {3-1} ya está completa, M HA = M B; así, en el punto final de cualquier titulación monoprótica,
\[V_{HA} C_{HA} = V_B C_B \label{3-3}\]
¡La ecuación\ ref {3-3} es importante! En cualquier titulación, se conocen tanto el volumen como la concentración del valorante, por lo que la concentración desconocida se calcula fácilmente.
En titulaciones realizadas en laboratorio, el valorante es entregado por una bureta que suele ser calibrada en mililitros, por lo que es más conveniente expresar M HA en milimoles y C HA en milimoles/ml (mMol ml —1); tenga en cuenta que el último es numéricamente lo mismo que los moles/L.
Se valoran 50.0 mL de ácido clorhídrico 0.100 M con hidróxido de sodio 0.200 M. ¿Qué volumen de solución de NaOH se habrá agregado en el punto de equivalencia?
Solución
Primero, encuentra el número de moles de HCl en el título:
\[\begin{align*} M_{\ce{HCl}} &= C_{\ce{HCl}} \times V_{\ce{HCl}} \\[4pt] &= (0.100\, mMol\, mL^{–1}) \times (50.0\, mL) \\[4pt] &= 5.0 \,mMol\,\ce{HCl} \end{align*}\]
Este mismo número de moles de NaOH debe ser entregado por la bureta para alcanzar el punto de equivalencia (es decir, NaOH M = 5.0 mMol.)
El volumen de solución de NaOH M NaOH requerido es
V NaOH = (NaOH M/NaOH C) = (5.0 mmol)/(0.200 mmol/mL) = 25 mL


