3.9.3: Alimentos- Metabolismo Grasa vs Azúcar
- Page ID
- 76029
Una de las características más útiles de las ecuaciones termoquímicas es que se pueden combinar para determinar los valores de Δ H m para otras reacciones químicas que nunca se han observado. Podríamos querer ver qué sería Δ H m si pudiéramos llevar a cabo una reacción que nunca se ha hecho, o podría ser interesante por razones teóricas.
Por ejemplo, hemos señalado que el cuerpo tendría que almacenar hasta 67.5 lb de complejos de azúcar para el equivalente energético de 10 lb de grasa. [1]
En el Ejemplo 1 a continuación, calculamos la energía para la reacción hipotética en la que una grasa se convierte en azúcar:
C 18 H 36 O 2 (s) + 8 O 2 (g) → 3 C 6 H 12 O 6 (s)
Δ H m para esta reacción es la energía extra que nuestro cuerpo puede obtener de una grasa.
Un Caso Simple
Pero primero, un ejemplo más simple puede ayudar a dejar claro el método. En lugar de la oxidación de una molécula de grasa complicada, consideraremos la oxidación más simple posible, una secuencia en la que el carbono mismo se oxida. La etapa 1 es la oxidación de 1 mol de C (s) y 0.5 mol O 2 (g) para formar 1 mol de CO (g):
C (s) + ½O 2 (g) → CO (g) Δ H m = —110.5 kJ = Δ H 1 (Obsérvese que dado que la ecuación se refiere a moles, no a moléculas, los coeficientes fraccionarios son permisibles.)
En la etapa 2, algunos de los moles de CO reaccionan con 0,5 moles adicionales de O2 produciendo 1 mol de CO 2:
CO (g) + ½O 2 (g) → CO 2 (g) Δ H m = —283.0 kJ = Δ H 2 El resultado neto de este proceso en dos etapas es la producción de 1 mol CO 2 del original 1 mol C y 1 mol O 2 (0.5 mol en cada paso). Todo el CO producido en el paso 1 se agota en el paso 2.
En el papel este resultado neto se puede obtener sumando las dos ecuaciones químicas como si fueran ecuaciones algebraicas. El CO producido es cancelado por el CO consumido ya que es tanto un reactivo como un producto de la reacción global
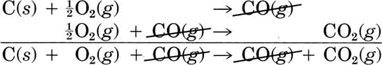 Experimentalmente se encuentra que el cambio de entalpía para la reacción neta es la suma de los cambios de entalpía para los pasos 1 y 2: Δ H net = —110.5 kJ + (—283.0 kJ) = —393.5 kJ = Δ H 1 + Δ H 2 Es decir, la ecuación termoquímica C (s) + O 2 (g) → CO 2 (g) Δ H m = —393.5 kJ es la correcta para la reacción general.
Experimentalmente se encuentra que el cambio de entalpía para la reacción neta es la suma de los cambios de entalpía para los pasos 1 y 2: Δ H net = —110.5 kJ + (—283.0 kJ) = —393.5 kJ = Δ H 1 + Δ H 2 Es decir, la ecuación termoquímica C (s) + O 2 (g) → CO 2 (g) Δ H m = —393.5 kJ es la correcta para la reacción general.
Ley de Hess'
En el caso general siempre es cierto que siempre que se puedan agregar dos o más ecuaciones químicas algebraicamente para dar una reacción neta, también se pueden agregar sus cambios de entalpía para dar el cambio de entalpía de la reacción neta.
A este principio se le conoce como ley de Hess'. Si no fuera cierto, sería posible idear una serie de reacciones en las que se crearía energía pero que terminarían con exactamente las mismas sustancias con las que empezamos. Esto contradiría la ley de conservación de la energía. La ley de Hess' nos permite obtener valores Δ H m para reacciones que no pueden llevarse a cabo experimentalmente, como muestra el siguiente ejemplo.
Ejemplo 1: Metabolismo de Grasa vs Azúcar
EJEMPLO 1
Si bien el metabolismo de las grasas es un proceso complicado (llamado “oxidación beta”) que produce el ATP que libera energía al músculo, podríamos imaginar una reacción que nos ayude a entender por qué las grasas almacenan tanta energía en comparación con el azúcar. Podríamos imaginar la combustión de ácido estérico al azúcar, glucosa, según la ecuación
(1) C 18 H 36 O 2 (s) + 8 O 2 (g) → 3 C 6 H 12 O 6 (s) Δ H m1
Esto representaría la energía “extra” que aportan las grasas, sobre la energía que proporciona el metabolismo de un azúcar como la glucosa.
Calcular Δ H m1 para esta reacción a partir de las siguientes ecuaciones termoquímicas, (que son calores de combustión que se determinan fácilmente experimentalmente):
(2) C 18 H 36 O 2 (s) + 26 O 2 (g) → 18 CO 2 (g) + 18 H 2 O (l) (25°C, 1 atm de presión)
Δ H m2 = —11 407 kJ [2]
(3) C 6 H 12 O 6 (s) + 6 O 2 (g) → 6 CO 2 (g) + 6 H 2 O (l) (25°C, 1 atm de presión)
Δ H m3 = —2 800 kJ [3]
Solución
Vemos que la reacción (3) tiene glucosa (C 6 H 12 O 62) a la izquierda, pero la reacción objetivo (1) la tiene a la derecha. Tendremos que invertir la ecuación (3), y luego combinarla con la ecuación (2) para obtener la ecuación objetivo (1). Si invertimos (3), cambiamos el signo en Δ H m3:
(3a) 6 CO 2 (g) + 6 H 2 O (l) → C 6 H 12 O 6 (s) + 6 O 2 (g) (-) Δ H m3 = +2 800 kJ
Pero también podríamos notar que la ecuación objetivo no contiene CO 2 (g) o H 2 O (l), así que necesitaremos multiplicar la ecuación (3) por 3, de modo que habrá una cantidad igual de CO 2 (g) o H 2 O (l) a la izquierda y derecho, y van a cancelar. Multiplicando la ecuación (3a) por 3:
(3b) 18 CO 2 (g) + 18 H 2 O (l) → 3 C 6 H 12 O 6 (s) + 18 O 2 (g) (-3) Δ H m2 = +8 400 kJ
Cuando combinamos esta ecuación, y su asociado Δ H m con la Ecuación (2), obtenemos la reacción objetivo, (1):
\(\text{C}_{18}\text{H}_{36}\text{O}_{2}\text{(s)} + \text{26 O}_{\text{2}}\text{(g)}\to \)\(\text{18 CO}_{\text{2}}\text{(g)}~+~\text{18 H}_{2}\text{O}~~~~~~~~~~~~~~~~\Delta H_{\text{m}}=\text{11 407 kJ }\)
\ (
\ subrayado {\ texto {18 CO} _ {\ texto {2}}\ texto {(g) + 18 H} _ {\ texto {2}}\ texto {O} (l)}\ subrayado {\ a\ texto {3 C} _ {\ texto {6}}\ texto {H} _ _ {\ texto {12}}\ texto {O} _ {6}\ texto {(s) +}\ texto {18 O} _ {\ texto {2}}\ texto {(g)}} ~~~~~~~~\ Delta H_ {\ texto {m}} =-3\ texto {(} -\ texto {2 800 kJ)}\)
\ (
\ texto {C} _ {18}\ texto {H} _ {36}\ texto {O} _ {2}\ texto {(s)} +\ texto {8 O} _ {\ texto {2}}\ texto {(g)}\ a\ texto {3 C} _ {\ texto {6}}\ texto {H} _ {\ texto {12}}\ texto {O} _ {6}\ texto {(g)}\)\(\Delta H_{\text{m}}=\text{(}\text{-11 407}+\text{8 400 kJ}\text{)}~=~\text{-3007 kJ}\)
Δ H m1 = Δ H m2 + (-3) Δ H m3 = —11 407 + 8400 kJ
Δ H m1 = —3 007 kJ
Entonces, un mol (284.48 g) de ácido esteárico libera 3 007 kJ cuando se oxida a 3 mol de glucosa. Esto es 10.57 kJ/g, o 2.5 Cal/g que obtenemos de la grasa pero no del azúcar.
Adicionalmente, por cada gramo de ácido esteárico, obtenemos la energía de 1.900 g de glucosa (ver la tabla resumida de estequiometría a continuación), que proporciona 4 Cal por gramo. Esto es 1.90 g x 4 Cal/g = 7.59 Cal, por lo que la energía total de 1 g de grasa es 2.5 + 7.6 = 10.1 Cal en este caso (similar a la estimación de 9 Cal/g para grasas típicas).
| C 18 H 36 O 2 | + 8 O 2 | → 3 C 6 H 12 O 6 | |
|---|---|---|---|
| m (g) | 1.00 | 0.900 | 1.90 |
| M (g/mol) | 284.4 | 32.0 | 180 |
| n (mol) | 0.00352 | 0.281 | 0.0106 |
Referencias
- Energía de Grasas y Azúcares
- home.fuse.net/clymer/rq/hoctable.html
- home.fuse.net/clymer/rq/hoctable.html


