4.15: Medición de Pesos Atómicos
- Page ID
- 75380
Quizás te hayas preguntado por qué hemos sido tan cuidadosos al definir los pesos atómicos y los pesos isotópicos como proporciones de masas. La razón será más clara una vez que se haya descrito la técnica experimental más importante y precisa mediante la cual se miden los pesos isotópicos. Esta técnica, llamada espectrometría de masas, se ha desarrollado a partir de los experimentos con tubos de rayos catódicos mencionados anteriormente en este capítulo. Depende de que una partícula cargada eléctricamente que pasa por un campo magnético de intensidad constante se mueva en una trayectoria circular. El radio r de tal trayectoria es directamente proporcional a la masa m y la velocidad u de la partícula, e inversamente proporcional a la carga Q. Así, cuanto mayor es la masa o velocidad de la partícula, mayor es el radio de su trayectoria. Cuanto mayor sea la carga, menor será el radio. En un espectrómetro de masas, como se ve a continuación, los átomos o moléculas en la fase gaseosa son bombardeados por un haz de electrones. Ocasionalmente uno de estos electrones golpeará otro electrón en un átomo en particular, y ambos electrones tendrán suficiente energía para escapar de la atracción del núcleo positivo. Esto deja atrás un ion positivo ya que el átomo tiene ahora un protón más que electrones. Por ejemplo,
\[\ce{^{12}_6C} +\ce{e^-} \text{ (high speed electron)} \rightarrow \ce{^{12}_6C^+} + \ce{2 e^-} \nonumber \]
Una vez que los iones positivos se producen en un espectrómetro de masas, son acelerados por la atracción de un electrodo negativo y pasan a través de una hendidura. Esto produce un haz estrecho de iones que viajan paralelos entre sí. Luego, el haz pasa a través de campos eléctricos y magnéticos. Los campos desvía todos los iones excepto los que viajan a cierta velocidad.
El haz de iones se pasa entonces entre los polos de un gran electroimán. Dado que la velocidad y la carga son las mismas para todos los iones, los radios de sus trayectorias dependen únicamente de sus masas. Para diferentes iones de masas m 1 y m 2
\[\frac{r_{\text{2}}}{r_{\text{1}}}=\frac{m_{\text{2}}}{m_{\text{1}}} \nonumber \]
y la relación de masas se puede obtener midiendo la relación de radios, Las trayectorias de los iones se determinan ya sea por una placa fotográfica (que se oscurece donde los iones la golpean, como en la Figura\(\PageIndex{1}\)) o una placa metálica conectada a un galvanómetro (un dispositivo que detecta la corriente eléctrica debida al haz de iones cargados).
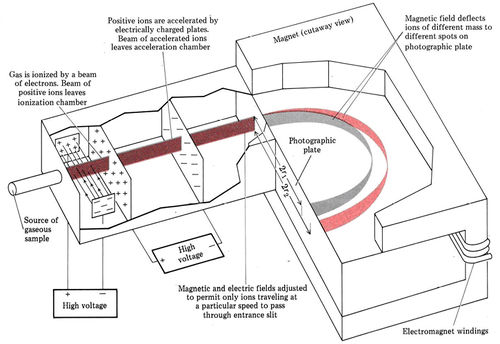
Cuando se vaporiza una muestra de carbono en un espectrómetro de masas, se observan dos líneas en la placa fotográfica. La línea más oscura es de 27.454 cm, y la otra a 29.749 cm de la hendidura de entrada. Determinar las masas atómicas relativas (pesos isotópicos) de los dos isótopos de carbono.
Solución
Dado que la distancia desde la hendidura de entrada hasta la línea en la placa fotográfica es el doble del radio de la trayectoria circular de los iones, tenemos
\[\frac{m_{\text{2}}}{m_{\text{1}}}=\frac{r_{\text{2}}}{r_{\text{1}}}=\frac{2r_{\text{2}}}{2r_{\text{1}}}=\frac{\text{29}\text{.749 cm}}{\text{27}\text{.454 cm}}=\text{1}\text{.083 59} \nonumber \]
Así m 2 = 1.083 m 1. Si asumimos que la marca más oscura en la placa fotográfica se produce porque hay un mayor número de
12 + iones que de los menos comunes13 +, entonces m 1 puede equipararse con la masa relativa de 12 6 C y se le puede asignar un valor de 12.000 000 exactamente. El peso isotópico de 12 6 C es entonces
\[ m_2 = (1.083 59)(12.000 000) = 13.0031 \nonumber \]
Observe que en espectrometría de masas todo lo que se requiere es que la carga y velocidad de los dos iones cuyas masas relativas se van a determinar sean las mismas. Si la masa de un ión individual se mediera con precisión, su velocidad real al entrar en el campo magnético y la magnitud exacta de su carga eléctrica tendría que conocerse con mucha precisión. Por lo tanto, es más fácil medir la relación de dos masas que determinar una sola masa absoluta, por lo que los pesos atómicos se reportan como números puros.


