5.1.1: Biología- Aplicaciones de la Estructura Electrónica
- Page ID
- 75399
La estructura electrónica de los átomos en biología
volver a La estructura electrónica de los átomos
Desde que Rutherford había descubierto que el núcleo ocupa solo el 10 -12% (una millonésima de millonésima parte de un porcentaje) del volumen de un átomo, quedó claro que el núcleo era esencialmente un punto minúsculo, y que la forma y tamaño de los átomos se debe enteramente a una “nube de electrones” muy escasa de algún tipo. Esta realización fue crítica para la biología, porque la forma y el tamaño de las moléculas son críticos para comprender su función biológica, y la “nube de electrones” de los átomos constituyentes determina su forma y tamaño.
Esto a veces es muy sutil. Por ejemplo, hay dos formas diferentes de la molécula de carvona, C 10 H 14 O (como las manos derecha e izquierda):
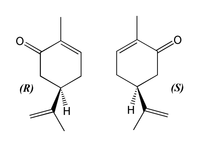
Las dos formas de carvona [1]
La carvona de la izquierda (R- (-) -Carvone) huele a menta verde y se usa para aromaterapia, medicina alternativa y ambientadores. El carvone de la derecha, (S- (+) -carvone) huele a comino. La diferencia de olfato es un indicio de la diferencia en la actividad biológica que proviene de diferencias muy pequeñas en la forma, un principio que se encuentra una y otra vez en la industria farmacéutica.
Pero también sería imposible entender la fotosíntesis y la visión, y de hecho, el color de las hojas y las flores sin entender la estructura electrónica de los átomos, porque no habría luz (ni color o reacciones fotoquímicas) si no fuera por los electrones y sus capacidad de absorber o liberar energía.
Naturalmente, todos los químicos, biólogos y físicos se interesaron por la estructura electrónica de los átomos, los químicos porque querían explicar la valencia, las propiedades químicas y la unión, los físicos porque querían explicar el color y los espectros de los átomos (la luz emitida cuando los átomos gaseosos fueron elevados a una temperatura alta o bombardeados por electrones) y biólogos por las razones anteriores. Los principales contribuyentes a la comprensión fundamental de la estructura electrónica, que se desarrolló principalmente durante los 15 años entre 1910 y 1925, fueron el químico estadounidense Gilbert Newton Lewis (1875 a 1946), y el físico danés Niels Bohr (1885 a 1962).
Las ideas sobre las estructuras electrónicas de los átomos progresaron durante la primera mitad del siglo XX. La repetición periódica de las propiedades químicas descubiertas por Mendeleev llevó a G. N. Lewis a la conclusión de que los átomos deben tener una estructura de concha. Esto fue confirmado por la mecánica de olas, que desarrolló patrones de onda muy hermosos que reemplazaron las conchas circulares o elípticas de modelos anteriores.
La energía de cada electrón en un átomo depende de cuán fuertemente el electrón es atraído por la carga positiva en el núcleo y de cuánto es repelido por otros electrones. Si bien a cada electrón no se le puede asignar una trayectoria u órbita precisa en un átomo, su patrón de onda nos permite determinar la probabilidad de que esté dentro de una determinada ubicación. A partir de esto se puede obtener la energía de cada electrón y el orden de llenado de orbitales. Así podemos determinar la configuración electrónica para un átomo de cualquier elemento. Dichas configuraciones de electrones se correlacionan con la tabla periódica.
Debido a que los electrones en los orbitales internos filtran los electrones externos de la carga nuclear, las cáscaras cuarta y superior comienzan a llenarse antes de que se ocupen d (y a veces f) las subcáscaras de las conchas anteriores. Esta superposición en energías de conchas explica por qué las ideas de Lewis son menos útiles para elementos en la cuarta y subsiguientes filas de la tabla periódica, como el cobalto en la vitamina B12 o el hierro en la hemoglobina. También explica la variación constante en las propiedades de los metales de transición, del titanio al zinc, a lo largo de la mitad de la tabla, y las características casi idénticas de los elementos de transición internos en oposición a las grandes diferencias de un grupo de elementos representativos al siguiente.
Aunque alguna complicación añadida surge del cuadro onda-mecánico, sí confirma el postulado básico de Lewis de que los electrones de valencia determinan las propiedades químicas e influyen en la unión de un átomo a otro. En otras páginas verás cómo el reordenamiento de los electrones de valencia puede mantener unidos los átomos, y cómo diferentes tipos de enlaces dan como resultado diferentes propiedades macroscópicas.


