7.7: Descripciones orbitales de enlaces múltiples
- Page ID
- 75033
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La asociación de cuatro orbitales híbridos sp 3 con un octeto se puede aplicar tanto a enlaces múltiples como a enlaces simples. Un ejemplo sencillo es el eteno (etileno), C 2 H 4. La estructura de Lewis para esta molécula es


Dado que los orbitales que se superponen no apuntan directamente entre sí, cada uno de estos enlaces se conoce como un enlace doblado o (más frívolamente) como un enlace banano.
En los modelos de moléculas de bola y varilla, un doble enlace suele estar representado por dos resortes o por palos curvos (mostrados en la Figura\(\PageIndex{2}\)) que unen los dos átomos entre sí. Al hacer tal modelo, es necesario doblar los resortes una cantidad justa para que encajen en los agujeros apropiados en las bolas. La capacidad de doblarse o estirarse es característica de todos los enlaces químicos, no solo de aquellos entre átomos doblemente unidos. Así cada átomo puede vibrar alrededor de su posición más estable. Quizás los modelos de bola y resorte serían más apropiados que los modelos de bola y varilla en todos los casos.
La imagen de enlaces doblados facilita la explicación de varias características de los dobles enlaces. Como se señala en Enlace Químico - Pares de Electrones y Octetos, la distancia entre dos núcleos atómicos conectados por un doble enlace es más corta que si estuvieran conectados por un enlace sencillo. En el caso de los enlaces carbono-carbono, por ejemplo, la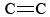 distancia es de 133pm, mientras que la distancia C—C es de 156pm. Esto tiene sentido cuando nos damos cuenta de que cada enlace doblado se extiende a lo largo de un camino curvo. La distancia entre los extremos de tal camino (los núcleos C) es necesariamente más corta que el camino mismo.
distancia es de 133pm, mientras que la distancia C—C es de 156pm. Esto tiene sentido cuando nos damos cuenta de que cada enlace doblado se extiende a lo largo de un camino curvo. La distancia entre los extremos de tal camino (los núcleos C) es necesariamente más corta que el camino mismo.

Otra característica de los dobles enlaces es que dificultan torcer un extremo de una molécula con relación al otro. Este fenómeno suele llamarse barrera a la rotación. Tal barrera explica el hecho de que es posible preparar tres compuestos diferentes con la fórmula C 2 H 2 F 2. Sus estructuras se muestran en la Figura 2. La estructura (a) es única porque ambos átomos F están unidos al mismo átomo de C, pero (b) y (c) difieren solo por un giro de 180° del grupo de la derecha. Si no hubiera barrera para la rotación alrededor del doble enlace, las estructuras (b) y (c) podrían interconvertirse muy rápidamente cada vez que chocan con otras moléculas. Entonces sería imposible preparar una muestra que contenga solo moléculas tipo (b) o solo moléculas de tipo (c).
grupo de la derecha. Si no hubiera barrera para la rotación alrededor del doble enlace, las estructuras (b) y (c) podrían interconvertirse muy rápidamente cada vez que chocan con otras moléculas. Entonces sería imposible preparar una muestra que contenga solo moléculas tipo (b) o solo moléculas de tipo (c).
Dado que tienen la misma fórmula molecular, (a), (b) y (c) son isómeros. La estructura (b) en la que los dos átomos F están en lados opuestos del doble enlace se denomina isómero trans, mientras que la estructura (c) en la que dos átomos similares están en el mismo lado se denomina isómero cis. Es fácil explicar por qué existe una barrera a la rotación que impide la interconversión de estos isómeros cis y trans en términos de nuestro modelo de enlaces doblados. La rotación de una parte de la molécula alrededor de la línea a través de los átomos de C hará que una de las nubes de electrones de enlace doblado se tuerza alrededor de la otra. A menos que la mitad del doble enlace se rompa, es imposible torcer la molécula a través de un ángulo muy grande.
El jmol anterior le permite ver todos los orbitales moleculares para el eteno. Mediante el uso de la barra de desplazamiento, puede elegir cualquiera de los orbitales moleculares asociados a la molécula y verlos. Los orbitales moleculares se discuten más a fondo en la sección sobre Electrones deslocalizados. Al elegir orbital “N6", puede ver un orbital de enlace sigma para eteno. Al elegir el orbital “N8" se mostrará un orbital pi para la molécula.


