11.21: Parejas Redox
- Page ID
- 75008
Cuando un agente reductor dona uno o más electrones, su número de oxidación aumenta, y la especie resultante es capaz de reacceptar los electrones. Es decir, la especie oxidada es un agente oxidante. Por ejemplo, cuando el metal de cobre se disuelve, el ion cobre (II) formado puede servir como agente oxidante:

De igual manera, cuando se reduce un agente oxidante como el ion plata, el metal plateado puede donar un electrón, sirviendo como agente reductor:
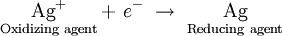
Esto es análogo a lo que observamos en el caso de ácidos y bases conjugados. Por cada agente oxidante, corresponde algún agente reductor, y por cada agente reductor, corresponde un agente oxidante.
\(\PageIndex{1}\)CUADRO: Parejas Redox seleccionadas dispuestas en orden de disminución de la fuerza del agente oxidante.

Un agente oxidante y reductor que aparece en lados opuestos de una media ecuación constituye un par redox. Las parejas redox son análogas a las parejas ácido-base conjugadas y se comportan de la misma manera. Cuanto más fuerte es un agente oxidante, más débil es el agente reductor correspondiente y cuanto más fuerte es un agente reductor, más débil es el agente oxidante correspondiente. Así, el agente oxidante fuerte F 2 produce el agente reductor débil F —. Por el contrario, el agente reductor fuerte Li se corresponde con el agente oxidante débil Li +.
Este tipo de relación se demuestra en la Tabla\(\PageIndex{1}\), donde se han dispuesto parejas redox seleccionadas en orden de aumentar la resistencia del agente reductor. Al igual que en el caso de los ácidos y bases, esta tabla de medias ecuaciones se puede utilizar para predecir de qué manera procederá una reacción redox. Las reacciones con mayor tendencia a ocurrir son entre agentes oxidantes fuertes de la parte superior izquierda y agentes reductores fuertes de la parte inferior derecha. Si se dibuja una línea de agente oxidante a agente reductor para tal reacción, tendrá una pendiente cuesta abajo. Las reacciones con poca tendencia a ocurrir involucran los agentes oxidantes débiles en la parte inferior izquierda y los reductores débiles en la parte superior derecha. En tales casos, una línea desde oxidante hasta agente reductor tiene una pendiente cuesta arriba. Cuando la pendiente de la línea no está lejos de la horizontal, los agentes oxidantes y reductores son similares en fuerza y su reacción irá solo en parte hasta su finalización.
Predecir si el ion hierro (III), Fe 3+, oxidará el metal cobre. Si
entonces, escribir una ecuación equilibrada para la reacción.
Solución
Una línea desde el agente oxidante Fe 3+ hasta el agente reductor Cu es cuesta abajo, por lo que se producirá la reacción. La ecuación equilibrada es la suma de las dos medias ecuaciones ajustadas para igualar el número de electrones transferidos.
\(\ce{2Fe^{3+} + 2e^{–} -> 2Fe^{2+}}\)
\(\underline{\text{Cu} \rightarrow \text{Cu}^{2+} + \cancel{2e^–}}\)
\(\ce{2Fe^{3+} + Cu -> 2Fe^{2+} + Cu^{2+}}\)
Obsérvese que la media ecuación para Cu se invierte respecto a la de la Tabla 1 porque el reactivo Cu es un agente reductor. Todas las medias ecuaciones en la Tabla\(\PageIndex{1}\) tienen el agente oxidante a la izquierda.
Utilice el Cuadro 11.15 para encontrar un reactivo que oxida H 2 O (distinto de F 2 o Cl 2, que se mencionaron anteriormente).
Solución: Debemos encontrar un agente oxidante desde el cual una línea al agente reductor H 2 O tenga una pendiente cuesta abajo. Las únicas posibilidades son MnO 4 —o CrO 7 2—. Este último reacciona extremadamente lentamente, pero las soluciones acuosas de permanganato se descomponen a lo largo de un periodo de semanas. La concentración de MnO 4 — disminuye debido a la reacción
\(\ce{4MnO4^{–} + 12H3O^+ -> 4Mn^{2+} + 5O2 + 18H2O}\)

