20.2: Los elementos de la vida
- Page ID
- 75161
Apenas pasa un año sin la aparición en los medios de comunicación del viejo cliché de que el cuerpo humano promedio vale alrededor de $3.57 (quizás un poco más, permitiendo la inflación). Dichas cifras se basan en la composición elemental del cuerpo humano reportada en la tabla.
|
Element
|
% en peso
|
Átomo%
|
Periodo
|
|---|---|---|---|
|
H
|
10.2
|
63.5
|
I
|
|
O
|
66.0
|
25.6
|
II
|
|
C
|
17.5
|
9.1
|
II
|
|
N
|
2.4
|
1.06
|
II
|
|
Subtotal
|
96.1
|
99.3
|
|
|
Ca
|
1.6
|
0.25
|
IV
|
|
P
|
0.9
|
0.18
|
III
|
|
Na
|
0.3
|
0.07
|
III
|
|
K
|
0.4
|
0.06
|
IV
|
|
Cl
|
0.3
|
0.05
|
III
|
|
S
|
0.2
|
0.04
|
III
|
|
Mg
|
0.05
|
0.01
|
III
|
|
Subtotal
|
99.85
|
99.92
|
|
|
Fe
|
0.005
|
0.0006
|
IV
|
|
Zn
|
0.002
|
0.0002
|
IV
|
|
Cu
|
0.0004
|
0.000 06
|
IV
|
|
Mn
|
0.000 05
|
0.000 006
|
IV
|
Considerando solo el valor de mercado de los elementos, se obtiene un precio ridículamente bajo. Lo que se ha ignorado, por supuesto, es cómo se juntan los átomos de esos elementos. Tampoco valen mucho las materias primas para un reloj fino, lo que pagamos es principalmente la habilidad e inteligencia con la que se combinan.
Antes de considerar cómo se han combinado los elementos de los que todos estamos hechos, sin embargo, vale la pena pensar un poco en por qué están involucrados esos elementos particulares de la tabla. Esto es especialmente importante porque los mismos elementos en proporciones muy similares se encuentran en casi todos los sistemas vivos. Como se muestra en la tabla periódica biológica (Figura\(\PageIndex{1}\)), muchos otros elementos simplemente no están involucrados en la química de la vida, al menos no en la medida en que la necesidad de su presencia pueda demostrarse experimentalmente.
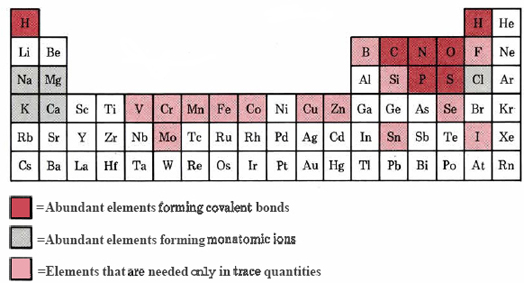
Más del 99 por ciento de los átomos en el cuerpo humano, o cualquier otro organismo para el caso, son H, O, N y C. Esto no parece ser mera casualidad. Los indicios son que la vida tal como la conocemos no podría basarse en otros cuatro elementos. Estos elementos tienen los átomos más ligeros y más pequeños que pueden formar uno, dos, tres y cuatro enlaces covalentes, respectivamente. Debido a sus pequeños radios estos átomos pueden acercarse muy de cerca y unirse muy fuertemente entre sí. El más importante de estos cuatro elementos es sin duda el carbono. Los átomos de carbono tienen una capacidad especial para unirse entre sí para formar cadenas y anillos largos. Esta capacidad permite al carbono formar un número muy grande de compuestos estables cuyas estructuras moleculares son diferentes pero, sin embargo, estrechamente relacionadas.
Ningún otro elemento tiene esta capacidad. Quizás el contendiente más cercano es el silicio. Aunque una serie de compuestos que contienen enlaces Si-Si tales como
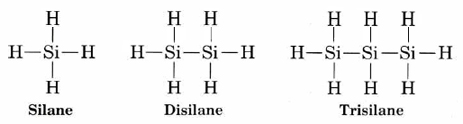
son conocidos, ninguno de estos compuestos es muy estable. Todos se convierten fácilmente en compuestos que contienen enlaces Si-O. La entalpía de enlace del enlace (368 kJ mol —1) es mucho mayor que la del enlace Si—Si (176 kJ mol —1) y también mayor que la del enlace Si—H (318 kJ mol —1). La producción de enlaces Si—O es así exotérmica y termodinámicamente favorable. Otro factor es la velocidad rápida a la que pueden ocurrir estas reacciones químicas. El silicio es capaz de expandir su capa de valencia mediante el uso de d orbitales para permitir más de cuatro enlaces. Esto le permite formar un complejo activado en el que tanto el enlace que se está haciendo como el enlace que se rompe se caracterizan, pero que requiere muy poca energía de activación. Las reacciones equivalentes que involucran carbono requieren energías de activación mucho más altas y generalmente proceden tan lentamente que son imperceptibles a temperatura ambiente, incluso cuando se permite termodinámicamente.
El carbono no es el único elemento con propiedades únicas en las moléculas biológicas. El hidrógeno también es especial y juega dos papeles importantes. Recordará que los alcanos son químicamente no reactivos. Podemos atribuir esto a la entalpía de enlace C—H grande de 413 kJ mol —1. Solo el flúor forma un enlace más fuerte que este con el carbono. Por lo tanto, es bastante difícil reemplazar un átomo de hidrógeno unido a un átomo de carbono con una alternativa más estable. Cuando un compuesto orgánico reacciona químicamente, casi siempre es un grupo funcional que sufre un cambio. La presencia de enlaces C-H hace que una gran proporción de la cadena carbonada no reactiva y restringe la reacción casi por completo a aquellos sitios que incluyen un átomo que no sea carbono o hidrógeno.
En las moléculas biológicas estos otros átomos son casi invariablemente oxígeno y nitrógeno, y esto tampoco es un accidente. El oxígeno y el nitrógeno son los dos elementos más electronegativos que tienen una valencia mayor a 1. Son capaces de formar enlaces tanto al carbono por un lado como al hidrógeno por el otro. En grupos como
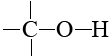 y
y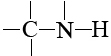
los átomos de hidrógeno cumplen su segundo papel importante en las moléculas biológicas, formando enlaces de hidrógeno entre diferentes moléculas o entre diferentes partes de la misma molécula.
Esta capacidad de diferentes grupos funcionales en una cadena de carbono para unir hidrógeno entre sí es un aspecto particularmente importante de las moléculas biológicas. Recordarás de la figura 2 de la sección sobre equilibrio molecular que una molécula que contiene una cadena de átomos de carbono es capaz de un número muy grande de conformaciones debido a la libre rotación alrededor de los enlaces simples. Dado que muchas moléculas biológicas contienen cadenas muy largas, son capaces de adoptar un número casi infinito de formas. En la práctica solo unas pocas de estas formas son útiles, y las moléculas pueden ser “congeladas” en una conformación tan útil a través de enlaces de hidrógeno entre varios segmentos de la cadena. Un muy buen ejemplo de esto es la enzima tripsina. Si la cadena de aminoácidos en esta molécula no se mantenía en la conformación particular mostrada en la figura por medio de enlaces de hidrógeno entre partes adyacentes de la cadena, los diversos segmentos que componen el sitio activo ya no se agruparían y la molécula sería incapaz de funcionar como catalizador.


