1.2: Isótopos
- Page ID
- 77388
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Aunque todos los átomos de un elemento tienen el mismo número de protones, los átomos pueden diferir en el número de neutrones que tienen (Cuadro 1-2). Estos diferentes átomos del mismo elemento se llaman isótopos. Cuatro isótopos de helio (He) se muestran en la Figura 1-1. Todos los átomos de cloro (Cl) tienen 17 protones, pero hay isótopos de cloro que tienen de 15 a 23 neutrones. Solo existen dos isótopos de cloro en cantidades significativas en la naturaleza, aquellos con 18 neutrones (75.53% de todos los átomos de cloro encontrados en la naturaleza) y aquellos con 20 neutrones (24.47%). Para escribir el símbolo de un isótopo, coloque el número atómico como subíndice y el número de masa (protones más neutrones) como superíndice a la izquierda del símbolo atómico. Los símbolos para los dos isótopos naturales de cloro serían entonces Cl y
Cl y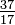 Cl. Estrictamente hablando, el subíndice es innecesario, ya que todos los átomos de cloro tienen 17 protones. De ahí que los símbolos isotópicos generalmente se escriben sin el subíndice: 35 Cl y 37 Cl. Al discutir estos isótopos, utilizamos los términos cloro-35 y cloro-37. Para que un núcleo sea estable, el número de neutrones debe (para los primeros elementos) igual o ligeramente superior al número de protones. Cuantos más protones, mayor es la relación de neutrones a protones para asegurar la estabilidad. Los núcleos que tienen demasiados de cualquier tipo de partícula fundamental son inestables, y se descomponen radioactivamente de formas que se discuten en el Capítulo 23.
Cl. Estrictamente hablando, el subíndice es innecesario, ya que todos los átomos de cloro tienen 17 protones. De ahí que los símbolos isotópicos generalmente se escriben sin el subíndice: 35 Cl y 37 Cl. Al discutir estos isótopos, utilizamos los términos cloro-35 y cloro-37. Para que un núcleo sea estable, el número de neutrones debe (para los primeros elementos) igual o ligeramente superior al número de protones. Cuantos más protones, mayor es la relación de neutrones a protones para asegurar la estabilidad. Los núcleos que tienen demasiados de cualquier tipo de partícula fundamental son inestables, y se descomponen radioactivamente de formas que se discuten en el Capítulo 23.

Ejemplo 1.2.1
¿Cuántos protones, neutrones y electrones hay en un átomo del isótopo más estable del uranio, el uranio-238? Escribe el símbolo para este isótopo. Consulte la Figura. 1-1.
Solución
El número atómico de uranio (ver la contraportada interior) es 92, y el número de masa del isótopo se da como 238. De ahí que tenga 92 protones, 92 electrones, y 238 - 92 = 146 neutrones. Su símbolo es U (o 238 U).
U (o 238 U).
A la masa total de un átomo se le llama su peso atómico, y esto es casi pero no exactamente la suma de las masas de sus protones, neutrones y electrones constituyentes. * Cuando protones, neutrones y electrones se combinan para formar un átomo, parte de su masa se convierte en energía y se desprende. (Esta es la fuente de energía en las reacciones de fusión nuclear). Debido a que el átomo no se puede descomponer en sus partículas fundamentales a menos que la energía para la masa faltante se suministre desde fuera de él, esta energía se llama la energía de unión del núcleo.
Nota: Peso atómico vs. masa atómica
Los términos peso atómico y peso molecular son utilizados universalmente por los científicos que trabajan, y serán utilizados en este libro, aunque técnicamente se trata de masas en lugar de pesos.
| Electrones | Protones | Neutrones |
Atómica Número |
Peso atómico (amu) |
Carga total (unidades de electrones) |
|
|---|---|---|---|---|---|---|
| Átomo de hidrógeno, 1 H o H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Átomo de deuterio, 2 H o D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Átomo de tritio, 3 H o T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Ión hidrógeno, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Átomo de helio, 4 He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Núcleo de helio o partícula alfa, He 2+ o α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Átomo de litio, 7 Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Átomo de carbono, 12 Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Átomo de oxígeno, 16 O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Átomo de cloro, 35 Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Átomo de cloro, 37 Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Mezcla natural de cloro | 17 | 17 | 18 o 20 | 17 | 35.453 | 0 |
| Átomo de uranio, 234 U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Átomo de uranio, 235 U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Átomo de uranio, 238 U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Mezcla natural de uranio | 92 | 92 | variado | 92 | 238.03 | 0 |
Ejemplo 1.2.2
Calcular la masa que se pierde cuando se forma un átomo de carbono-12 a partir de protones, electrones y neutrones.
Solución
Dado que el número atómico de cada átomo de carbono es 6, el carbono-12 tiene 6 protones y por lo tanto 6 electrones. Para encontrar el número de neutrones, restamos el número de protones del número de masa: 12 - 6 = 6 neutrones. Podemos utilizar los datos de la Tabla 1-1 para calcular la masa total de estas partículas:
-
-
-
Protones: 6 X 1.00728 amu = 6.04368 amu Neutrones: 6 X 1.00867 amu = 6.05202 amu Electrones: 6 X 0.00055 amu = 0.00330 amu Masa total de partículas: 12.09900 amu
-
-
Pero por la definición de la escala de unidades de masa atómica, la masa de un átomo de carbono-12 es exactamente de 12 amu. De ahí que 0.0990 amu de masa haya desaparecido en el proceso de construcción del átomo a partir de sus partículas.
Ejemplo 1.2.3
Calcular el peso atómico esperado del isótopo de cloro que tiene 20 neutrones. Compárelo con el peso atómico real de este isótopo como se indica en el Cuadro 1-2.
Solución
El isótopo de cloro tiene 17 protones y 20 neutrones:
-
-
-
Protones: 17 X 1.00728 amu = 17.1238 amu Neutrones: 20 X 1.00867 amu = 20.1734 amu Electrones: 17 X 0.00055 amu = 0.0094 amu Masa total de partículas: 37.3066 amu Peso atómico real observado: 36.966 amu Pérdida de masa: 0.341 amu
-
-
Cada isótopo de un elemento se caracteriza por un número atómico (número total de protones), un número másico (número total de protones y neutrones) y un peso atómico (masa de átomo en unidades de masa atómica). Dado que las pérdidas de masa tras la formación de un átomo son pequeñas, el número de masa suele ser el mismo que el peso atómico redondeado al número entero más cercano. (Por ejemplo, el peso atómico del cloro-37 es 36.966, que se redondea a 37.) Si hay varios isótopos de un elemento en la naturaleza, entonces por supuesto el peso atómico observado experimentalmente (el peso atómico natural) será el promedio ponderado de los pesos de los isótopos. El promedio se pesa de acuerdo con el porcentaje de abundancia de los isótopos. El cloro se presenta en la naturaleza como 75.53% cloro-35 (34.97 amu) y 24.47% cloro-37 (36.97 amu), por lo que el promedio ponderado de los pesos de los isótopos es
\[(0.7553 \times 34.97 \;amu) + (0.2447 \times 36.97\; amu) = 35.46\; amu\]
Los pesos atómicos dados dentro de la contraportada de este libro son todos promedios ponderados de los isótopos que ocurren en la naturaleza., y estas son las cifras que usaremos a partir de ahora, a menos que estemos discutiendo específicamente un isótopo. Todos los isótopos de un elemento se comportan de la misma manera químicamente en su mayor parte. Su comportamiento diferirá con respecto a propiedades sensibles a la masa como las tasas de difusión, que veremos más adelante en este libro.
Ejemplo 1.2.4
El magnesio (Mg) tiene tres isótopos naturales significativos: 78.70% de todos los átomos de magnesio tienen un peso atómico de 23.985 amu, 10.13% tienen un peso atómico de 24.986 amu y 11.17% tienen un peso atómico de 25.983 amu. ¿Cuántos protones y neutrones hay presentes en cada uno de estos tres isótopos? ¿Cómo escribimos los símbolos para cada isótopo? Por último, ¿cuál es el promedio ponderado de los pesos atómicos?
Solución
Hay 12 protones en todos los isótopos de magnesio. El isótopo cuyo peso atómico es de 23.985 amu tiene un número de masa de 24 (protones y neutrones), por lo que 24 - 12 protones da 12 neutrones. El símbolo de este isótopo es 24Mg. De manera similar, el isótopo cuyo peso atómico es de 24.986 amu tiene un número de masa de 25, 13 neutrones y 25Mg como símbolo. El tercer isótopo (25.983 amu) tiene un número de masa de 26, 14 neutrones y 26 Mg como símbolo. Calculamos el peso atómico promedio de la siguiente manera:
-
- (0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Ejemplo 1.2.5
El boro tiene dos isótopos naturales, Lo B y 11 B. Sabemos que 80.22% de sus átomos son 11 B, peso atómico 11.009 amu. A partir del peso atómico natural dado en la contraportada interior, calcular el peso atómico del isótopo LoB.
Solución
Si 80.22% de todos los átomos de boro son 11 B, entonces 100.00 - 80.22, o 19.78%, son el isótopo desconocido. Podemos usar W para representar el peso atómico desconocido en nuestro cálculo:
-
- (0.8022 X 11.009) + (0.1978 X W) = 10.81 amu (peso atómico natural)
- W =
 = 10.01 amu
= 10.01 amu
Colaboradores y Atribuciones
R. E. Dickerson, H. B. Gray, and G. P. Haight, Jr. Content was used from "Chemical Principles", an introductory college-level text for General Chemistry with permission of the Caltech library and Harry B. Gray, on behalf of the authors.

