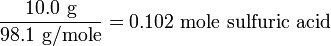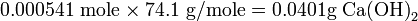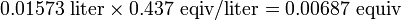2.1: Introducción
- Page ID
- 77287
-
Cuando puedes medir de lo que estás
hablando, y expresarlo en números,
sabes algo al respecto; pero cuando no
puedes medirlo, cuando no puedes
expresarlo en números tu el conocimiento es de
un tipo exiguo e insatisfactorio; puede
ser el comienzo del conocimiento, pero apenas
has avanzado, en tus pensamientos,
a la etapa de la ciencia”.Guillermo Thomson, Señor Kelvin (1891)
Introducción
El concepto de átomos se remonta a los filósofos griegos. Demócrito (470-360? b.c.) propuso que toda la materia se compone de átomos separados e indestructibles, que los diferentes tipos de átomos tienen diferentes estructuras y comportamientos, y que las propiedades observadas de las sustancias surgen por la forma en que sus átomos individuales se disponen y se combinan entre sí. Sus teorías son esencialmente una versión primitiva del material del Capítulo 1. ¿Por qué, entonces, los antiguos griegos no utilizaron las teorías de Demócrito y continuaron desarrollando la energía atómica? ¿Por qué pasaron 2000 años antes de que la ciencia módem comenzara a desarrollarse?
La respuesta, en gran parte, es que los griegos no pensaban cuantitativamente en los átomos, y no eran experimentalistas. Su ciencia era una explicación filosófica del universo, más que una herramienta pragmática con la que manipular el mundo que los rodea. El trabajo humano barato les impidió tener que preocuparse por desarrollar una tecnología científica.
El científico griego Garza de Alejandría inventó varios mecanismos impulsados por vapor que podrían haber conducido directamente a la máquina de vapor, pero los utilizó sólo como juguetes y novedades.
La teoría atómica de Demócrito fue estéril porque no condujo a predicciones cuantitativas que pudieran ser probadas. No logró desarrollarse más allá de conceptos abstractos porque no contaba con la retroalimentación de experimentos exitosos y fallidos en el mundo real para desafiarlo y mejorarlo.
Una teoría científica, para ser útil, debe ser cuantitativa. Debe predecir: “Si hago esto, entonces eso va a pasar, y en una medida que pueda calcular de antemano”. Tal predicción es comprobable. Se puede ver como correcto, aumentando nuestra confianza en la teoría detrás de ella; o lo que frecuentemente es más importante, se puede ver que es incorrecta, lo que nos hace revisar y mejorar la teoría.
Las teorías científicas crecen por la continua destrucción y reconstrucción. Una teoría que predice nada que pueda probarse no transmite ninguna información, y carece de valor.
La importancia de la medición precisa de la masa en las reacciones químicas escapó a los filósofos griegos. También escapó a los alquimistas, metalúrgicos y iatroquímicos europeos medievales (químicos medicinales). El gran químico francés Antoine Lavoisier (1743-1794) fue el primero en darse cuenta de que la masa era la cantidad fundamental conservada durante las reacciones químicas.
La masa total de todos los productos formados debe ser precisamente la misma que la masa total de los materiales de partida. Con este principio Lavoisier demolió la teoría del calor del flogiston largamente aceptada (ver Capítulo 6) al demostrar que cuando una sustancia se quema, se combina con otro elemento, el oxígeno, en lugar de descomponerse y desprender una misteriosa sustancia universal llamada flogiston. El principio de la conservación de la masa es la piedra angular de toda química. Más que solo se conserva la masa total; el mismo número de cada tipo de átomo debe estar presente tanto antes como después de una reacción química, sin importar cuán intrincadamente estos átomos puedan combinarse y reorganizarse en moléculas.
La energía también debe conservarse en las reacciones químicas. Para el químico, esto significa que el calor que se absorbe o desprende en una reacción química particular (el calor de reacción) debe ser el mismo sin importar cómo se lleve a cabo esa reacción, en un paso o en varios. Por ejemplo, el calor que se desprende cuando se queman gas hidrógeno y grafito (una forma de carbono) debe ser el mismo que el que se desprende cuando se utiliza hidrógeno y carbono para hacer gasolina sintética, y esta gasolina se usa luego como combustible para un motor de automóvil.
Si el calor desprendido en las dos variaciones de la reacción no fuera el mismo, entonces la reacción más eficiente podría ejecutarse en la dirección hacia adelante y la menos eficiente podría ejecutarse a la inversa. El resultado sería un horno cíclico sin combustible que vertiría cantidades infinitas de calor sin costo para el operador. Los esquemas de movimiento perpetuo de todo tipo desaparecen tan pronto como uno se vuelve cuantitativo sobre el calor, la energía y el trabajo. Esta es la base de la termodinámica, que se trata en detalle en los Capítulos 15-17.
En este capítulo veremos las consecuencias, para la química, de dos principios:
- Los átomos no se crean ni se destruyen durante las reacciones químicas (conservación de la masa).
- Los calores de reacción son aditivos. Si se pueden agregar dos reacciones para dar una tercera, entonces el calor de la tercera reacción es igual a la suma de los calores de las dos primeras reacciones (conservación de energía).
Ambos principios pueden parecer obvios al principio, pero también son herramientas bastante poderosas para explicar el comportamiento químico.
Pesos atómicos, pesos moleculares y moles
 Figura 2-1. Dos moléculas de gas hidrógeno se combinan con una molécula de oxígeno para producir dos moléculas de agua. El principio de Avogadro nos dice que volúmenes iguales de diferentes gases contienen igual número de moléculas, a una temperatura y presión especificadas. De ahí que dos volúmenes de gas H 2 se combinarán con un volumen de 0 2, para producir dos volúmenes de vapor de agua, y dos moles de H 2 se combinarán con un mol de 0 2 para producir dos moles de vapor de agua. De Dickerson y Geis, Química, Materia y Universo
Figura 2-1. Dos moléculas de gas hidrógeno se combinan con una molécula de oxígeno para producir dos moléculas de agua. El principio de Avogadro nos dice que volúmenes iguales de diferentes gases contienen igual número de moléculas, a una temperatura y presión especificadas. De ahí que dos volúmenes de gas H 2 se combinarán con un volumen de 0 2, para producir dos volúmenes de vapor de agua, y dos moles de H 2 se combinarán con un mol de 0 2 para producir dos moles de vapor de agua. De Dickerson y Geis, Química, Materia y UniversoTan pronto como los químicos se dieron cuenta de que la masa —no el volumen, la densidad o alguna otra propiedad medible— era la propiedad fundamental que se conservaba durante las reacciones químicas, comenzaron a intentar establecer una escala correcta de masas atómicas (pesos atómicos) para todos los elementos. Cómo lo hicieron se describe en el Capítulo 6; el resultado de sus años de trabajo es la tabla de pesos atómicos naturales en la contraportada interior de este libro. Como vimos en el Capítulo 1, los pesos moleculares de los compuestos moleculares y los pesos de fórmula de los compuestos no moleculares (como las sales) se encuentran añadiendo los pesos atómicos de todos los átomos constituyentes.
Central para todos los cálculos químicos es el concepto del topo. Como se define en el Capítulo 1, un mol de cualquier sustancia es la cantidad que contiene tantas partículas de la sustancia como átomos haya en exactamente 12 g de carbono-12. Así, un mol de una sustancia es una cantidad en gramos que es numéricamente igual a su peso molecular expresado en unidades de masa atómica. El número de partículas en un mol se llama número de Avogadro, y los experimentos de Millikan y Faraday descritos al final del Capítulo 1 son un medio para establecer su valor:
N = 6.022 X 10 23 partículas mol -1
Los moles son una forma de manipular átomos o moléculas en haces de 6.022 X 10 23. Los pesos moleculares de H 2, 0 2 y H 2 0 se elaboraron en el Capítulo 1. Si sabemos que dos moléculas de gas hidrógeno, H 2, reaccionan con una molécula de gas oxígeno, 0 2, para producir dos moléculas de agua, H 2 0, entonces podemos predecir que 2 moles de H 2, o 4.032 g, reaccionarán con 1 mol de 0 2, o 31.999 g, para producir 2 moles de agua, o 36.031 g (Figura 2-1). La adición de cheque, 4.032 + 31.999 = 36.031, verifica la conservación de la masa durante la reacción. El químico mide las sustancias en gramos, pesándolas.
Sin embargo, es más significativo convertir estas cantidades de gramos a moles, porque entonces se trabaja con proporciones moleculares relativas, escaladas por un factor uniforme de N.
Análisis Químicos. Porcentaje de composición y fórmulas empíricas
El análisis químico implica descomponer una sustancia en sus elementos y luego medir la cantidad relativa de cada elemento presente, ya sea en gramos por cada 100 g de compuesto original, o como porcentaje en peso. Una forma de hacerlo, si el compuesto es un hidrocarburo (compuesto únicamente por carbono e hidrógeno), es quemar una cantidad conocida de la sustancia en oxígeno, y medir las cantidades de C0 2 (dióxido de carbono) y H 2 0 que resultan.
Ejemplo 1
Cuando se queman 25.00 g de un hidrocarburo desconocido, se producen 68.58 g de CO 2 y 56.15 g de H 2 0.
¿Cuántos gramos de carbono e hidrógeno contenía la muestra original?
Solución
El peso atómico del carbono es 12.011 g mol -1, y el peso molecular del CO 2 es 44.010 g mol -1.
Primero encontramos el porcentaje de carbono en dióxido de carbono:
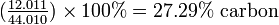
Si 27.29% del CO 2 es carbono, entonces la cantidad de carbono en 68.58 g de CO 2 será

Un cálculo similar para hidrógeno en agua da:


Como cheque: 18.72 g + 6.283 g = 25.00 g.
Ejemplo 2
Cuántos gramos de carbono e hidrógeno por 100.0 g de muestra hay
en el hidrocarburo del Ejemplo 1?
Solución


 Figura 2-2. Siete moléculas diferentes con la fórmula empírica CH. Un simple análisis elemental no pudo distinguir entre ellos. Un peso molecular aproximado podría distinguir entre C 2 H 2, C 4 H 4 y C 6 H 6, pero aún se requeriría más información para identificar la molécula particular de C 6 H 6 presente.
Figura 2-2. Siete moléculas diferentes con la fórmula empírica CH. Un simple análisis elemental no pudo distinguir entre ellos. Un peso molecular aproximado podría distinguir entre C 2 H 2, C 4 H 4 y C 6 H 6, pero aún se requeriría más información para identificar la molécula particular de C 6 H 6 presente.Ejemplo 3
¿Cuál es la composición porcentual en peso del hidrocarburo en el Ejemplo 1? Solución


Ejemplo 4
Calcular el número relativo de átomos de carbono e hidrógeno en el hidrocarburo del Ejemplo 3. Solución
Es más fácil trabajar con 100.0 g de la sustancia, por lo que las cifras porcentuales de la composición elemental se convierten en gramos de los elementos respectivos. Primero dividimos cada cantidad de carbono e hidrógeno por sus pesos atómicos:


Estos son los números relativos de moles de carbono e hidrógeno, y es aquí donde el concepto de moles se vuelve útil. Estos números también deben ser los números relativos oí átomos de carbono e hidrógeno. Por cada 6.234 átomos de carbono en el hidrocarburo desconocido, hay 24.92 átomos de hidrógeno. Si buscamos un factor común para estos dos números, vemos que están en una proporción de 1:4. Dividiendo ambos números por el número inferior, 6.234, encontramos que por cada átomo de carbono hay
Ejemplo 5
Un líquido común es 11.19% de hidrógeno y 88.81% de oxígeno en peso. ¿Cuáles son los números relativos de átomos de hidrógeno y oxígeno? Solución
De nuevo trabajando con 100.0 g de la sustancia, calculamos el número de moles de cada elemento:
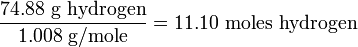

Dividiendo ambos números por los más pequeños, para buscar un factor común, encontramos que hay dos átomos de hidrógeno por cada átomo de oxígeno .
Un análisis elemental, por sí mismo, no es suficiente para decidir la fórmula molecular correcta de un compuesto. La fórmula para el metano es CH 4, que se ajustaría a los resultados del cálculo en el Ejemplo 4. Pero los resultados analíticos también serían compatibles con las moléculas C 2 H 8, C 3 H 12, o C 4 H 16, si pudieran existir. La sustancia en el Ejemplo 5 podría ser agua, H 2 0, pero también podría ser H 4 0 2 o algún múltiplo superior. Si reconoce, correctamente, que solo CH 4 y H 2 0 son químicamente sensibles, entonces está aportando nueva información química que no está presente solo en los datos analíticos. La mayoría de los químicos asumirían que la molécula del Ejemplo 6 era benceno, C 6 H 6. Pero también podría ser acetileno, C 2 H 2 (excepto por el hecho de que el acetileno es un gas a temperatura ambiente, y se dijo que el hidrocarburo desconocido era un disolvente común de laboratorio, lo que excluiría el acetileno) o cualquiera de las otras cinco moléculas de hidrocarburo menos comunes que se muestran en la Figura 2-2 .Ejemplo 6
Un solvente común de laboratorio, un hidrocarburo, está compuesto por 92.26% de carbono y 7.74% de hidrógeno. ¿Cuáles son los números relativos de átomos de carbono e hidrógeno en la sustancia? Solución
La respuesta es que se encuentra un carbono por cada hidrógeno.
Una fórmula química que da el número relativo de cada tipo de átomo, como enteros sin factor común, se denomina fórmula empírica de la sustancia. Es la fórmula empírica que resulta de un análisis elemental de una sustancia, no de la fórmula molecular, que podría ser la misma que la fórmula empírica o podría ser algún múltiplo integral de la misma. La fórmula empírica es la misma que la fórmula molecular para metano, CH 4, y para agua, H 2 O; las fórmulas empíricas de acetileno y benceno son ambas CH, pero las fórmulas moleculares son C 2 H 2 y C 6 H 6, respectivamente. Con frecuencia sucede que alguna medición física simple puede dar una aproximación aproximada del peso molecular de una sustancia. Las densidades de gas (Capítulo 3), la depresión del punto de congelación y las mediciones de presión osmótica (Capítulo 18) son útiles en este sentido. Si tal peso molecular aproximado está disponible, entonces se puede usar junto con la fórmula empírica para decidir la verdadera fórmula molecular.
Ejemplo 7
La glucosa es 40.00% de carbono en peso, 6.71% de hidrógeno y 53.29% de oxígeno. ¿Cuál es su fórmula empírica y cuál es su fórmula molecular? Solución
Trabajando con 100.0 g de glucosa, primero encontramos el número de moles de cada elemento:



Esta es obviamente una relación molar de un carbono a dos hidrógenos por un oxígeno, por lo que la fórmula empírica es CH 2 O. Con la información proporcionada no tenemos forma de saber si ésta, o algún múltiplo de ésta, es la verdadera fórmula molecular.Ejemplo 8
De otros experimentos sabemos que la glucosa tiene un peso molecular de aproximadamente 175 g mol -1. Utilice esta información y los resultados del Ejemplo 7 para encontrar la fórmula molecular y el peso molecular exacto de la glucosa. Solución
El peso correspondiente a la fórmula empírica es

El peso molecular aproximado es aproximadamente seis veces este valor, por lo que el peso molecular preciso es

y la fórmula molecular es C 6 H 12 0 6.Ecuaciones Químicas. Ecuaciones de Equilibrio y Conservación de Masa
Cuando el gas propano, C 3 H 8, se quema en oxígeno, los productos son dióxido de carbono y agua. Esto se puede escribir como una ecuación química:
C3H8 + O2 → CO2 + H2O (2-1)
Si la química no fuera una ciencia cuantitativa, entonces sería adecuada esta descripción de la reacción, identificando tanto los reactivos como los productos. Pero esperamos más de una ecuación química. ¿Cuántas moléculas de oxígeno se requieren por molécula de propano y cuántas moléculas de dióxido de carbono y agua resultan? La ecuación 2-1 es una ecuación desequilibrada. Cuando agregamos coeficientes numéricos (colocados a la izquierda de la fórmula) que indican cuántos de cada tipo de molécula están involucrados, entonces habrá el mismo número de cada tipo de átomo en los lados izquierdo y derecho de la ecuación, ya que los átomos no son creados ni destruidos en una reacción química. El resultado será una ecuación equilibrada.
Para equilibrar la ecuación 2-1, observamos primero que los 3 átomos de carbono de la izquierda conducirán a 3 moléculas de CO 2 como productos, cada una requiriendo 2 átomos de oxígeno, o 6 oxígenos en total. De igual manera, los 8 átomos de hidrógeno en el propano producirán 4 moléculas de agua, requiriendo 4 átomos de oxígeno más. Este total de 10 oxígenos a la derecha debe provenir de 5 moléculas de 0 2. Los coeficientes correctos para las cuatro sustancias en la ecuación 2-1 son, por lo tanto, 1,5,3 y 4:
C3H8 + 5 O2 → 3 CO2 + 4 H2O (2-2)
Cada lado de esta ecuación equilibrada contiene 3 átomos de carbono, 8 átomos de hidrógeno y 10 átomos de oxígeno.
Ejemplo 9
El trinitrotolueno (TNT), C 7 H 5 N 3 O 6, se combina violentamente con oxígeno para producir CO 2, agua y N 2. Escribe una ecuación química balanceada para la explosión. Solución
La ecuación desequilibrada es
- C 7 H 5 N 3 0 6 + O 2 → C0 2 + H 2 O + N 2
Dado que hay números impares de átomos de hidrógeno y nitrógeno a la izquierda, y números pares a la derecha, será más fácil equilibrar la ecuación sobre la base de dos moléculas de TNT:
- 2 C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2
Los 14 carbonos, 10 hidrógenos y 6 nitrógenos resultarán entonces en 14 moléculas de dióxido de carbono, 5 de agua y 3 de nitrógeno:
- 2 C 7 H 5 N 3 0 6 + O 2 → 14 CO 2 + 5 H 2 O + 3 N 2
Ahora todos los átomos están equilibrados en los lados izquierdo y derecho de la ecuación excepto el oxígeno. De los 33 oxígenos a la derecha, 12 son proporcionados a la izquierda por las 2 moléculas iniciales de TNT, y 21 deben ser suministrados por
 0 2. La ecuación final y equilibrada es
0 2. La ecuación final y equilibrada es- 2 C 7 H 5 N 3 0 6 + 10
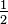 O 2 → 14 CO 2 + 5 H 2 O + 3 N 2
O 2 → 14 CO 2 + 5 H 2 O + 3 N 2
El Ejemplo 9 condujo a una ecuación con un coeficiente fraccionario para oxígeno. Esto se puede eliminar multiplicando todos los coeficientes en ambos lados por 2:
4 C7H5N3O6 + 21 O2 -> 28 CO2 + 10 H2O + 6 N2 (2-3)
pero esto no es necesario, ya que no hay razón para que todos los coeficientes deban ser enteros. Incluso sería correcto basar la ecuación en una sola molécula de TNT:
C7H5N3O6 + 21/4 O2 → 7 CO2 + 5/2 H2O + 3/2 N2 (2-4)
Una ecuación química equilibrada como la ecuación 2-3 tiene varios niveles de significado. Lo más simple es que describe los materiales de partida y los productos. También nos dice que el número de cada tipo de átomo que entra en la reacción es el mismo que el número que sale. Cada tipo de átomo se conserva individualmente durante la reacción. La ecuación 2-3 también es una afirmación de que por cada 4 moléculas de TNT, se requieren 21 moléculas de oxígeno, y los productos son 28 moléculas de CO 2, 10 moléculas de agua y 6 moléculas de N 2. Escalando la reacción en un factor de 6.022 X 10 23 para pasar de moléculas a moles, 4 moles de TNT reaccionan con 21 moles de O 2 para producir 28 moles de CO 2, 10 moles de H 2 O y 6 moles de N 2. Los pesos moleculares individuales son
C 7 H 5 N 3 O 6 227.13 g mol -1 O 2 31.999 g mol -1 CO 2 44.010 g mol -1 H 2 O 18.015 g mol -1 N 2 28.013 g mol -1 De ahí que la ecuación 2-3 también nos diga que 4 X 227.13 g = 908.52 g de TNT requiere 21 X 31.999 g = 671.98 g de oxígeno para completar la reacción. También nos dice que los productos serán
28 X 44.010 g = 1232.3 g de CO 2 10 X 18.015 g = 180.15 g de H 2 O 6 x 28.013 g = 168.08 g de N 2
Podemos verificar que la masa está efectivamente conservada:
Reactantes: 908.52 g + 671.98 g = 1580.5 g Productos: 1232.3 g + 180.15 g + 16.08 g = 1580.5 g
Lo que una ecuación química equilibrada no nos dice es el mecanismo molecular o curso de los eventos por los que se produce la reacción. La ecuación 2-3 no debe interpretarse en el sentido de que sugiere que 4 moléculas de TNT deben colisionar simultáneamente con 21 moléculas de oxígeno. Incluso las colisiones de tres cuerpos son mucho más raras que las colisiones de dos cuerpos que pueden descartarse de consideración en la mayoría de las reacciones químicas. Se podría llevar a cabo una serie elaborada de pasos individuales, siempre y cuando la reacción neta global se describiera correctamente mediante la ecuación 2-3 o la ecuación 2-4.
Los reactivos y productos no necesitan ser moléculas:
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (2-5)
La ecuación 2-5 describe la reacción de CaCO 3, carbonato de calcio (piedra caliza) y HCl, ácido clorhídrico, para producir una solución acuosa de cloruro de calcio, CaCl 2 y dióxido de carbono. La ecuación está equilibrada, porque el número de cada tipo de átomo es el mismo en ambos lados. El significado molar es claro: 1 mol o 100.09 g de carbonato de calcio requiere 2 moles o 72.92 g de ácido clorhídrico para completar la reacción, y los productos serán 1 mol cada uno de cloruro de calcio (110.99 g mol -1), dióxido de carbono (44.01 g mol -1) y agua (18.02 g mol -1) ). Se puede verificar a partir de estas cifras que la masa se conserva durante la reacción. La interpretación molecular es menos sencilla, ya que el carbonato de calcio es una sal y no un compuesto molecular, la Ecuación 2-5 no debe tomarse en el sentido de que una molécula de carbonato de calcio reacciona con dos moléculas de HCl. Aunque el HCl existe como moléculas discretas en la fase gaseosa, en solución las moléculas se disocian en iones H+ y Cl-. Una mejor aproximación de lo que realmente sucede a nivel molecular es
CaCO3(s) + 2 H+(aq) → Ca2+(aq) + CO2(g) + H2O(l) (2-6)
Las letras entre paréntesis describen el estado físico de cada especie (s, sólido; aq, un ion hidratado en solución acuosa; g, gas; l, líquido). Esta ecuación dice que el carbonato de calcio sólido reacciona con dos protones hidratados (iones hidrógeno) en solución acuosa para producir iones de calcio hidratados, dióxido de carbono gaseoso y agua líquida. Los iones cloruro permanecen como iones cloruro hidratados en solución antes y después de la reacción; de ahí que se omiten de la ecuación. La ecuación 2-5, al igual que otras ecuaciones químicas balanceadas, es más útil para describir las cantidades de materiales involucrados, más que el mecanismo molecular de reacción. La ecuación 2-6, aunque una mejor descripción de lo que sucede a nivel de átomos e iones, es menos útil para realizar un seguimiento de las cantidades de materia involucradas.
Ejemplo 10
El sodio metálico reacciona con el agua para producir gas hidrógeno y solución de hidróxido de sodio (una mezcla de iones Na + y OH -). Escriba (a) una ecuación equilibrada para la reacción general y (b) una ecuación que describa con mayor precisión las especies atómicas o iónicas reales presentes. Solución
La ecuación equilibrada es
- Na + H 2 O → 1/2 H 2 + NaOH
o
- 2 Na + 2 H 2 O → H 2 + 2 NaOH
Una mejor descripción de lo que realmente está presente sería
- 2 Na (s) + 2 H 2 O (l) → H 2 (g) + 2 Na + (aq) + 2 OH - (aq)
Cálculos de rendimientos de reacción
Las ecuaciones químicas balanceadas se utilizan principalmente para calcular el rendimiento esperado (cantidad de producto) de una reacción, y para determinar si alguno de los reactivos permanecerá sin usar cuando los otros reactivos se agoten.
Como comprobación aritmética, tenga en cuenta que 100.0 g de carbono y 8.4 g de hidrógeno se combinan para producir 108.4 g de benceno. Nuevamente, la masa se conserva durante una reacción química.Ejemplo 11
Cuántos gramos de hidrógeno se necesitan para combinar con 100.0 g de carbono
para hacer benceno, C 6 H 6? ¿Cuántos moles y cuántos gramos de benceno se producirán?
Solución
La ecuación equilibrada para la reacción es
- 6 C + 3 H 2 → C 2 H 6
El número de moles de carbono presentes es

La ecuación equilibrada nos dice que se necesitan la mitad de moles de H 2 que moles de C, por lo que necesitamos 4.163 moles de H 2

El peso molecular de el benceno es
(6 X 12.011 g) + (6 X 1.008 g) = 78.11 g mol -1
Una sexta parte de los moles de benceno se producen como moles de carbono usados, o 8.326/6 = 1.388 moles de benceno. De ahí que la cantidad de benceno producida sea

Ejemplo 12
Cuántos gramos de sulfuro de plata (Ag 2 S) se pueden formar por la reacción
- 2Ag + S → Ag 2 S
si empezamos con 10.00 g de plata (Ag) y 1.00 g de azufre (S)? ¿Qué material de partida, en su caso, sobrará y cuánto?
Solución
-
Reacción: 2 Ag + S → Ag 2 S Misas: 215.7 g + 32.06 g = 247.8 g
La cantidad de azufre requerida para reaccionar con 10.00 g de plata es

Pero solo tenemos 1.00 g de azufre, por lo que no toda la plata puede reaccionar. Dando la vuelta al problema, la cantidad de plata necesaria para reaccionar con 1.00 g de azufre es

Por lo tanto, quedará sobrante. La cantidad de sulfuro de plata producida será
quedará sobrante. La cantidad de sulfuro de plata producida será
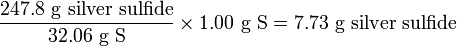
Observe que el Ejemplo 12 se trabajó de una manera diferente: Primero se escribieron las masas totales de todos los reactivos y productos bajo la ecuación química equilibrada, y luego se elaboraron las proporciones de estas masas para encontrar las respuestas deseadas. El problema también se puede resolver usando lunares, y la elección es de conveniencia.
Solución alternativa
Primero encontramos el número de moles de plata y azufre:


Dado que se requieren 2 moles de plata por cada mol de azufre, y hay más del doble de moles de plata que moles de azufre, parte de la plata debe dejarse atrás cuando se ha utilizado todo el azufre. Los 0.0312 moles de azufre se combinarán con 0.0624 moles de plata, adn forman 0.0312 mol de Ag 2 S. Quedan atrás 0.0927 - 0.0624 = 0.0303 mol de plata. Traduciendo estas cantidades de nuevo a gramos, tenemos


Llegamos a las mismas respuestas en la primera solución al ejemplo. El método de los moles es más seguro, pero más lento. El método de ratio es más rápido, pero puedes descarriarte más fácilmente si no estás absolutamente seguro de lo que estás haciendo. Usa el método de mole hasta que seas competente en los cálculos químicos.Soluciones como Reactivos Químicos
Las soluciones líquidas son medios convenientes para reacciones químicas. La mezcla rápida del líquido significa que los reactivos potenciales se acercan entre sí con frecuencia, por lo que las colisiones y las reacciones químicas pueden ocurrir mucho más rápido que lo harían en un sólido cristalino. Además, un número dado de moléculas en un líquido está confinado a un espacio más pequeño que el mismo número de moléculas en un gas, por lo que las moléculas reaccionantes en un líquido tienen más posibilidades de entrar en contacto. El agua es un solvente especialmente bueno para las reacciones químicas porque sus moléculas son polares. Las moléculas H 2 O, y los iones H + y OH - en los que el agua se disocia en pequeña medida, pueden ayudar a polarizar los enlaces en otras moléculas, debilitar los enlaces y fomentar el ataque químico. No es casualidad que la vida evolucionara en los océanos más que en la atmósfera superior o en tierra firme. Si la vida se hubiera visto obligada a evolucionar utilizando reacciones cristalinas de estado sólido, los 4.5 mil millones de años de historia de la Tierra hasta la fecha apenas podrían haber sido tiempo suficiente para que comenzara el proceso.
Unidades de Concentración: Molaridad y Molalidad
En soluciones que involucran un líquido y un gas o sólido, el componente líquido se llama disolvente, y el otro componente se llama soluto. Si la solución está compuesta por dos líquidos, la distinción es menos clara, pero la sustancia presente en la mayor cantidad suele considerarse como el disolvente. La forma más común de expresar la concentración en solución es la molaridad, o el número de moles de soluto por litro de solución. [1] El símbolo M se lee como “moles por litro de solución”, como en NaCl 1.5 M. El símbolo c se utiliza para denotar concentración en moles por litro, como lo es el símbolo químico entre paréntesis [H], aunque tales corchetes a veces se utilizan para representar la concentración en cualquier unidad. De ahí que la expresión c NaC1 se leería como “la concentración de cloruro de sodio en moles por litro de solución”. Esta no es la solución que resultaría de agregar 1 mol de NaCl a un litro de agua, ya que el volumen total después de la mezcla sería un poco más de 1 litro. Los iones sodio y cloruro ocupan espacio, incluso cuando se disuelven en agua. El procedimiento adecuado para hacer una solución 1.0 M sería disolver la sal en menos de un litro de agua, y luego agregar lentamente más agua, con mezcla, hasta que el volumen total alcanzara 1.00 litro.
Para muchas sales, podemos utilizar la aproximación de que los volúmenes son aditivos, o que el volumen de una solución será igual al volumen original del disolvente más el de los cristales que se disolvieron.
Ejemplo 13
Si 264 g de sulfato amónico, (NH 4) 2 SO 4, se disuelven en 1.000 litros de agua, ¿cuál será el volumen final aproximado y la molaridad aproximada de la solución, asumiendo aditividad de volúmenes? La densidad de cristalino (NH 4) 2 SO 4 es de 1.76 g ml -1. Solución
El volumen de sulfato de amonio sólido agregado es
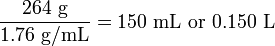
El volumen de solución final entonces será de 1.000 + 0.150 = 1.150 litros. El número de moles de soluto es
La molaridad del sulfato de amonio entonces es
La aproximación de la aditividad de los volúmenes se debe utilizar con cuidado. En este ejemplo, la verdadera molaridad de tal solución es de 1.80 M, por lo que la aproximación es de sólo 3.3% en error. Pero para los líquidos cuyas moléculas interactúan fuertemente, como el alcohol etílico y el agua, el volumen total puede encogerse después de mezclarse debido a las atracciones moleculares. La aditividad de los volúmenes debe usarse solo como una guía aproximada de la molaridad.
Una expresión alternativa de concentración, la molalidad, se basa en la cantidad de disolvente utilizado más que en la solución que resulta. La molalidad de un soluto es el número de moles de soluto en 1 kg de disolvente (no de solución). La densidad del agua es de 1.00 g mL -1, por lo que 1 kg de agua ocupa un volumen de 1 litro. De ahí que la solución de sulfato amónico del Ejemplo 13 sea una solución de 2.00 molal, ya que se conformó a partir de 2.00 moles de soluto en un kilogramo (1 litro) de agua. Para disolventes distintos al agua, debemos utilizar la densidad del líquido para convertir de kilogramos a litros.
Ejemplo 14
Supongamos que 5.00 g de ácido acético, C 2 H 4 O 2, se disuelven en 1 litro de etanol.
Calcular la molalidad de la solución resultante. La densidad del etanol es de 0.789 g mL -1. ¿Se puede calcular la molaridad a partir de la información proporcionada?
Solución
El peso molecular del ácido acético es de 60.05 g mol -1, por lo que el número de moles es

El número de kilogramos de disolvente utilizado es

Observe que 1 g mL -1 es lo mismo que 1 kg litro -1 , ya que hay 1000 g en un kilogramo y 1000 mL en un litro. La molalidad entonces es

La solución es por lo tanto 0.106 molal. No se puede calcular la molaridad de la solución porque no conocemos ni el volumen del ácido acético ni si los volúmenes son aditivos cuando el ácido acético se disuelve en etanol.El símbolo m se utiliza para la concentración expresada como molalidad. Escribiríamos los resultados del Ejemplo 14 como
- m ácido acético = 0.106 mol kg -1
Problemas de dilución
Si diluimos una solución (agregamos más disolvente), el número de moles de soluto no cambia. Si c es la molaridad (no molalidad) de la solución y V es el volumen en litros, entonces el número de moles de soluto es
- c (moles litro -1) X V (litros) = cV (moles)
Si usamos el subíndice 1 para representar una solución antes de que se diluya con más disolvente, y el subíndice 2 para la solución diluida, entonces
- Moles de soluto = c l V l = c 2 V 2
Ejemplo 15
¿A qué volumen se deben diluir 5.00 mL de HCl 6.00 M para que la concentración sea 0.100 M? Solución
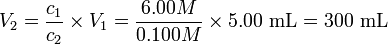
Esto no significa que se deban agregar 300 mL de agua, sino que el volumen total de solución se debe llevar hasta 300 mLEjemplo 16
Si se diluyen 175 ML de una solución de 2.00 M a 1.00 litro, ¿cuál será la molaridad? Solución

Neutralización ácido-base
Probablemente la definición más familiar de ácidos y bases es la del físico y químico sueco Svante Arrhenius (1859-1927): Un ácido es una sustancia que aumenta la concentración de iones hidrógeno, [H +], cuando se agrega al agua, y una base es una sustancia que aumenta el ion hidróxido concentración, [OH -], cuando se agrega al agua. Algunos de los ácidos y bases más comunes se enumeran en las Tablas 2-1 y 2-2. Los primeros 11 ácidos de la Tabla 2-1, de HF a HNO 3, se disocian en solución acuosa para liberar un protón o ion hidrógeno:
-
HNO 3 → H + (aq) + NO 3 - (aq) ácido
nítrico
ión nitrato
Cuadro 2-1. Ácidos Comunes
HF Hidrofluórico HCl Clorhídrico HClO Hipocloroso HClO 2 Cloroso HClO 3 Clórico HClO 4 Perclórico HBr Bromhídrico HBRo Bromic HOLA Hidroyodhídrico HNO 2 Nitroso HNO 3 Nítrico H 2 CO 3 Carbónico H 2 SO 3 sulfuroso H 2 SO 4 Sulfúrico H 3 PO 2 Hipofosforoso H 3 PO 3 Fósforo H 3 PO 4 Fosfórico H 3 BO 3 Boric HCOOH Fórmico CH 3 COOH Acético Cuadro 2-2. Bases Comunes
LiOh Hidróxido de litio NaOH Hidróxido de sodio Mg (OH) 2 Hidróxido de magnesio Ca (OH) 2 Hidróxido de calcio Ba (OH) 2 Hidróxido de bario NH 3 Amoníaco La abreviatura (aq) es un recordatorio de que los iones están hidratados, pero realmente no es necesario ya que cada ion en solución acuosa está hidratado, y lo omitiremos en el resto de esta discusión. Recuerda que las moléculas de agua siempre están presentes, rodeando cada ion y ayudando a estabilizarlo en solución. Los ácidos carbónico, sulfuroso y sulfúrico liberan dos protones en dos etapas, y los tres ácidos que contienen fósforo producen tres protones:
-
H 2 CO 3 → H + HCO 3 - → 2 H + CO 3 2- ácido carbónico H 2 SO 4 → H + + HSO 4 - → 2 H + SO 4 2- ácido sulfúrico H 3 PO 4 → H + H 2 PO 4 - → 2 H + HPO 4 2- → 3 H + PO 4 3- ácido fosfórico
El ácido carbónico es clasificado como un ácido débil porque su pérdida de protones es sólo parcial; las especies presentes en solución acuosa son una mezcla de iones carbonato y bicarbonato y una pequeña cantidad de ácido carbónico no disociado. En contraste, el ácido sulfúrico es un ácido fuerte porque la pérdida del primero de los dos H+ se completa en solución acuosa. (Los equilibrios ácido-disociación se consideran en detalle en el Capítulo 5.) Los ácidos nítrico y clorhídrico son ácidos fuertes comunes, y el ácido fosfórico es débil. Los ácidos orgánicos tales como fórmico y acético liberan un protón de sus grupos carboxilo —COOH:
-
CH 3 COOH → CH 3 COO - + H + ácido acético ion acetato
Es común usar la abreviatura HOAc para ácido acético y OAC - para el ion acetato.
Bases de hidróxido tales como hidróxido de sodio e hidróxido de magnesio se disuelven en agua para liberar iones hidróxido:
-
NaOH → Na + + OH - Mg (OH) 2 → Mg 2+ + 2 OH -
Los iones hidróxido ya están presentes en NaOH sólido, así como los iones cloruro están presentes en NaCl. El amoníaco, NH 3, también es una base, pero no tiene iones hidróxido propios. En cambio, los produce reaccionando con moléculas de agua:
-
NH 3 + H 2 O → NH 4 + + OH - amoníaco
ión amonio
ión hidróxido
El amoníaco a veces se escribe como hidróxido de amonio, NH 4 OH, para que se asemeje a las bases de hidróxido metálico (como hidróxido de sodio, NaOH). Pero esto es incorrecto; no existe tal sustancia como el hidróxido amónico; sólo hay amoníaco.
Los ácidos y bases son útiles porque los iones H + y OH - que producen pueden atacar moléculas en solución y provocar cambios químicos que serían difíciles o lentos en su ausencia. Cuando los ácidos y las bases reaccionan entre sí, los iones H + y OH - se combinan para formar moléculas de agua. Esto se llama neutralización:
- H + + OH - → H 2 O
La forma más fácil de determinar qué cantidad de un ácido o base está presente es averiguar qué cantidad de una base o ácido de concentración conocida se requiere para neutralizarlo completamente. Este es el proceso de titulación ácido-base. Un equivalente (equiv) de un ácido es la cantidad de ácido que liberará 1 mol de protones o H + en la neutralización de una base, y 1 equiv de una base es la cantidad que producirá 1 mol de iones OH -. La neutralización completa ocurre cuando el mismo número de equivalentes de ácido y base reaccionan entre sí. Para los ácidos que liberan un protón por molécula, como HCl y HNO 3, el equivalente es el mismo que el mol, y 1 peso equivalente es el mismo que el peso molecular. Pero como H 2 SO 4 es capaz de liberar dos iones H +, 1 mol de H 2 SO 4 corresponde a 2 equiv, y el peso equivalente de ácido sulfúrico en las neutralizaciones ácido-base es la mitad del peso molecular. El peso equivalente de ácido fosfórico, H 3 PO 4, o la cantidad que producirá 1 mol de iones H +, es un tercio del peso molecular. De manera similar, el mol y el equivalente son idénticos para NaOH, KOH y NH 3, pero el peso equivalente de Ca (OH) 2 es la mitad de su peso molecular. Podemos apreciar la utilidad del concepto de equivalentes al observar la neutralización del ácido fosfórico por hidróxido de magnesio:
-
2 H 3 PO 4 + 3 Mg (OH) 2 → Mg 3 (PO 4) 2 + 6 H 2 O Peso molecular: 98.0 g 58.3 g 262.9 g 18.0 g Peso equivalente: 32.7 g 29.2 g
Un mol o 98.0 g de ácido fosfórico no neutralizarán 1 mol o 58.3 g de hidróxido de magnesio, sino que 1 equiv o 32.7 g de ácido fosfórico neutralizarán 1 equiv o 29.2 g de hidróxido de magnesio. Esta es la misma respuesta que se obtendría usando la ecuación balanceada mostrada. Dado que 2 moles de ácido reaccionan con 3 moles de base como se muestra, 2 X 98.0 = 196 g de ácido fosfórico neutralizarán 3 X 58.3 = 175 g de hidróxido de magnesio. Estos números son solo los números obtenidos mediante el uso de equivalentes, pero escalados por un factor de 6.
Ejemplo 17
Use equivalentes para encontrar el número de gramos de ácido nítrico, HNO 3, necesarios para neutralizar 100.0 g de hidróxido de bario, Ba (OH) 2. Solución
El peso molecular de HNO 3 es 63.01 g mol -1; de Ba (OH) 2, 171.34 g mol -1. Los pesos equivalentes correspondientes son 63.01/1 = 63.01 g equiv -1 para HNO 3, y 171.34/2 = 85.67 g equiv -1 para Ba (OH) 2. El número de equivalentes de hidróxido de bario es
Se necesita el mismo número de equivalentes de ácido nítrico:
Solución alternativa
Este ejemplo también podría resolverse usando la ecuación química balanceada:
- 2 HNO 3 + Ba (OH) 2 → Ba (NO 3) 2 + 2 H 2 O
El número de moles de hidróxido de bario al inicio es
La ecuación equilibrada nos dice que se requieren el doble de moles de ácido nítrico: 1.167 moles de HNO 3. En gramos, esto es
El uso de equivalentes elimina la necesidad de elaborar una ecuación equilibrada para la reacción.
La normalidad de una solución, representada por N, es el número de equivalentes de soluto por litro de solución. Una solución 1.00 M de ácido fosfórico es 3.00 N, y una solución 0.010 M de Ca (OH) 2 es 0.020 N.
Ejemplo 18
Si se disuelven 4.00 g de hidróxido de sodio en agua y el volumen es
traído hasta 500 mL, encuentra la molaridad y la normalidad de la solución.
Solución
Dado que el peso molecular del NaOH es 40.0 g mol -1,
Debido a que 1 mol de NaOH libera 1 mol de iones OH -, la molaridad y normalidad son las mismas. La solución es de 0.200 N.
Ejemplo 19
Si 10.0 g de ácido sulfúrico (H 2 SO 4) se mezclan lentamente con suficiente agua para hacer un volumen final de 750 mL, ¿cuál es la molaridad y normalidad de la solución resultante? Solución
Dado que el peso molecular del NaOH es 40.0 g mol -1,
Dado que cada mol de ácido sulfúrico aporta 2 equiv, la solución es
Titulación ácido-base
 Figura 2-3. Una valoración ácido-base. La solución en el matraz contiene un número desconocido de equivalentes de base (o ácido). La bureta se calibra para mostrar el volumen al 0.001 cm 3 más cercano. Se rellena con una solución de ácido fuerte (o base) de concentración conocida. Se agregan pequeños incrementos desde la bureta hasta que, en el punto final, una gota o menos cambia el color del indicador de forma permanente. (Una indicación de que se está acercando al punto de equivalencia es la aparición —y desaparición al agitar— del color que el indicador asume más allá de la neutralización.) En el punto de equivalencia, se registra la cantidad total de ácido (o base) a partir de las lecturas de la bureta. El número de equivalentes de ácido y base debe ser igual en el punto de equivalencia.
Figura 2-3. Una valoración ácido-base. La solución en el matraz contiene un número desconocido de equivalentes de base (o ácido). La bureta se calibra para mostrar el volumen al 0.001 cm 3 más cercano. Se rellena con una solución de ácido fuerte (o base) de concentración conocida. Se agregan pequeños incrementos desde la bureta hasta que, en el punto final, una gota o menos cambia el color del indicador de forma permanente. (Una indicación de que se está acercando al punto de equivalencia es la aparición —y desaparición al agitar— del color que el indicador asume más allá de la neutralización.) En el punto de equivalencia, se registra la cantidad total de ácido (o base) a partir de las lecturas de la bureta. El número de equivalentes de ácido y base debe ser igual en el punto de equivalencia.Los químicos suelen utilizar valoraciones para comparar concentraciones relativas de equivalentes químicos en soluciones ácido-base (Figura 2-3). Cuando se ha agregado suficiente solución ácida de una bureta (mostrada en la figura) para neutralizar la base en la muestra que se analiza, el número de equivalentes de ácido y base involucrados debe ser el mismo. Al punto de neutralización se le llama punto de equivalencia. Para determinar el punto de equivalencia se puede utilizar un indicador ácido-base como tornasol o fenolftaleína. A partir del volumen de solución ácida utilizada y su normalidad, podemos calcular el número de equivalentes de base en la muestra desconocida. Si N A y N B son las normalidades de las soluciones ácidas y básicas, y V A y V B son los volúmenes de cada una a la neutralidad, entonces
Number of equivalents = NAVA = NBVB (2-7)
Ejemplo 20
Si 25.00 ml de ácido fosfórico (H 3 PO 4) son suficientes para neutralizar 30.25 mL de una solución de hidróxido de sodio, cuál es la relación de las normalidades de
las dos soluciones? ¿Cuál es la relación de molaridades?
Solución
Dado que cada mol de ácido sulfúrico aporta 2 equiv, la solución es
Dado que la normalidad del ácido es tres veces su molaridad, y la normalidad de la base es la misma que su molaridad, la relación de molaridad es
Ejemplo 21
En una titulación, 25.00 mL de una solución de hidróxido de calcio, Ca (OH) 2, requieren 10.81 mL de HCl 0.100 N para su neutralización. Calcular (a) la normalidad de la solución de Ca (OH) 2, (b) la molaridad, y (c) el número de gramos de Ca (OH) 2 presentes en la muestra. Solución
La normalidad de la solución de Ca (OH) 2 es
Dado que 1 mol de hidróxido de calcio produce 2 equiv OH -, la molaridad es la mitad de la normalidad, o 0.0216 M Ca (OH) 2.
El número de moles de Ca (OH) 2 esDado que el peso molecular de Ca (OH) 2 es 74.1 g mol -1, la masa presente es
Ejemplo 22
Un químico orgánico sintetiza un nuevo ácido. Ella disuelve 0.500 g en un volumen conveniente de agua y encuentra que requiere 15.73 mL de NaOH 0.437 N para neutralización. ¿Cuál es el peso equivalente del nuevo compuesto como ácido? Si se sabe que el ácido contiene tres grupos -COOH ionizantes, ¿cuál es el peso molecular? Solución
El número de equivalentes de la base son
El peso equivalente se encuentra a partir de
Si el peso equivalente del ácido es 72.8 g, y cada mol produce 3 equiv, entonces el peso molecular es
Calores de Reacción
Hasta el momento este capítulo se ha dedicado a las consecuencias de la conservación de la masa, y poco se ha dicho sobre la energía. Pero el principio de que los calores de reacción son aditivos, que la energía se conserva en un proceso ya sea que el proceso se lleve a cabo en un paso o en varios, es importante. El calor y el trabajo son formas de energía, y se miden en las mismas unidades. Si trabajas en un objeto o colección de objetos, puedes aumentar la energía o hacer que el sistema se caliente, dependiendo de cómo se haga el trabajo. Levantar un objeto pesado es una conversión del trabajo a energía potencial, y la fricción es una conversión del trabajo en calor. Por el contrario, la energía se puede reconvertir para funcionar cuando un objeto pesado cae, y el calor se convierte en trabajo en un motor de automóvil. De estos tres —calor, trabajo y energía— el químico suele estar más preocupado por el calor: el calor que puede absorberse o desprenderse cuando se produce una reacción química.
Según las leyes del movimiento de Newton, la fuerza sobre un objeto es producto de su masa y aceleración:
-
Fuerza = masa × aceleración F = m × a
La fuerza que debe aplicarse a una masa de 1.00 kg para darle una aceleración de 1 metro por segundo por segundo (1 m s -2) se define como una fuerza de 1 newton (N). De ahí que 1 N = 1 kg m s -2. (Las unidades SI se basan en la longitud en metros y la masa en kilogramos).
Ejemplo 23
Cuando un lanzador bate una pelota de béisbol de 5.00 onzas (oz) alrededor de un arco de 5.00 m de circunferencia para acelerarla de cero a 90 millas hr -1, ¿qué aceleración promedio le da a la pelota durante el lanzamiento, y qué fuerza promedio ejerce sobre ella durante su windup? Solución
Asumir una aceleración uniforme en la pelota desde el momento en que comienza la cuerda hasta que la pelota abandona la mano del lanzador. Para una aceleración uniforme desde el reposo, v = at y s = a 2, donde v es velocidad, a es aceleración, t es tiempo y s es distancia. Al eliminar el tiempo de las dos expresiones se obtiene a = v 2 /2 s. Si v = 40.2 m s -1 (90 mph) y s = 5.00 m, entonces
Dado que la masa (m) es de 0.142 kg (5.00 oz), la fuerza promedio aplicada a la pelota durante el swing es
El trabajo realizado cuando se ejerce 1 N de fuerza sobre un objeto por una distancia de 1 m se define como 1 julio (J). De ahí que 1 J = 1 N m = 1 kg m 2 s -2. Para un objeto arrojado, toda la obra se convierte en energía cinética (energía del movimiento); en otras circunstancias, parte o toda la obra puede terminar como calor.
Ejemplo 24
¿Cuánto trabajo se realiza en el beisbol en el terreno de juego descrito en el Ejemplo 23? ¿Cuánta energía cinética tiene la pelota ya que deja la mano del lanzador? Solución
El trabajo realizado en el beisbol es
La bola termina con una energía cinética de 115 J.
Como comprobación de estos resultados, podemos calcular la energía cinética directamente:
donde E es energía. La ventaja del joule como unidad de calor es que hace evidente de inmediato la conexión entre el calor, el trabajo y la energía. Una unidad de energía más antigua que surgió de las mediciones de calor es la caloría. Una caloría (cal) se define como la cantidad de calor requerida para elevar la temperatura de 1 g de agua pura en 1°C (de 14.5°C a 15.5°C, para ser exactos). Esta definición no tenía una conexión obvia con el trabajo, y de hecho la caloría se definió en el siglo XIX, antes de que alguien se diera cuenta de que el calor y el trabajo eran formas alternativas de lo mismo: la energía. Usaremos solo julios en este libro, pero debes estar al tanto de las calorías ya que la mayor parte de la literatura preexistente usa esa unidad. La caloría es aproximadamente cuatro veces más grande que un julio: 1 cal = 4.184 J. Los calores de reacción de las cantidades molares de sustancias se encuentran típicamente en el rango de kilojulios (kJ) o kilocalorías (kcal), donde 1 kJ = 1000 J y 1 kcal = 1000 cal.
Como ilustración de los calores de reacción y el principio de aditividad del calor, veamos la descomposición del peróxido de hidrógeno, H 2 O 2. Cuando una solución acuosa de peróxido de hidrógeno reacciona para formar gas oxígeno y agua líquida, se desprende calor. La cantidad de calor variará algo con la temperatura a la que se produce la reacción, pero a 25°C, el estándar comúnmente aceptado “temperatura ambiente” para medir y tabular calores de reacción, cada mol de H 2 O 2 que se descompone produce 94.7 kJ de calor. (Si esta energía pudiera ser utilizada con una eficiencia perfecta, bastaría con acelerar 823 pelotas de pelota como se describe en el Ejemplo 24.)
 Representación esquemática de un calorímetro de bomba utilizado para la medición de calores de combustión. La muestra pesada se coloca en un crisol, el cual a su vez se coloca en la bomba. La muestra se quema completamente en oxígeno bajo presión. La muestra es encendida por un coll de ignición de alambre de hierro que brilla cuando se calienta. El calorímetro está lleno de fluido, generalmente agua, y aislado por medio de una camisa. La temperatura del agua se mide con el termómetro. A partir del cambio de temperatura, se puede calcular el calor de reacción.
Representación esquemática de un calorímetro de bomba utilizado para la medición de calores de combustión. La muestra pesada se coloca en un crisol, el cual a su vez se coloca en la bomba. La muestra se quema completamente en oxígeno bajo presión. La muestra es encendida por un coll de ignición de alambre de hierro que brilla cuando se calienta. El calorímetro está lleno de fluido, generalmente agua, y aislado por medio de una camisa. La temperatura del agua se mide con el termómetro. A partir del cambio de temperatura, se puede calcular el calor de reacción.El calor involucrado en una reacción química llevada a cabo a presión constante (o al menos con la presión final devuelta al valor inicial) se conoce como el cambio en la entalpía del sistema de reacción, Δ H (leído como “delta H”). Como veremos en el Capítulo 15, el cambio de energía, Δ E, corresponde al calor de la reacción si la reacción se lleva a cabo a volumen constante, como en el calorímetro de bomba mostrado en la Figura 2-4. La entalpía puede considerarse como una energía “corregida”, siendo la corrección por cualquier trabajo que los químicos puedan hacer al empujar contra la atmósfera si se expanden. La diferencia entre Δ E y Δ H es pequeña pero significativa, pero no es importante para nosotros ahora. Si se desprende calor durante la reacción, entonces la entalpía del sistema de reacción del químico disminuye; Δ H, el cambio en la entalpía, es negativo. Tal reacción se llama exotérmica. En una reacción endotérmica se absorbe el calor y se eleva la entalpía de la mezcla de reacción. Para la reacción del peróxido de hidrógeno, podemos escribir
H2O2(aq) → H2O(l) + 1/2 O2 ΔH = -94.7 kJ (2-8)
Este calor se libera cuando 1 mol de peróxido de hidrógeno se descompone a 1 mol de agua y 1/2 mol de gas oxígeno, o por 1 mol de la reacción como se acaba de escribir. Si todos los coeficientes de la reacción se duplican, entonces el calor de reacción debe duplicarse también, ya que entonces se refiere al doble de reacción:
2 H2O2(aq) → 2 H2O(l) + O2 ΔH = -189.4 kJ (2-9)
“Un mol de la reacción tal como está escrito” significa ahora 2 moles de peróxido de hidrógeno descomponiéndose a 2 moles de agua y 1 mol de oxígeno, debido a que los coeficientes en la ecuación se han duplicado todos. El calor de una reacción también depende del estado físico de los reactivos y productos. Si el peróxido de hidrógeno se descomponía para dar oxígeno gaseoso y vapor de agua en lugar de líquido, parte de los 94.7 kJ se desviaría a la evaporación de H 2 O:
H2O(l) → H2O(g) ΔH= +44.0 kJ (2-10)
y menos calor sería desprendido por la descomposición del peróxido:
H2O2(aq) → H2O(g) + 1/2 O2(g) ΔH= -50.7 kJ (2-11)
Aquí se oculta una suposición importante: que los calores de reacción son aditivos (Figura 2-5). La ecuación 2-9 más la ecuación 2-10 da la ecuación 2-11, y así hemos asumido que el calor de la tercera reacción será la suma de las dos primeras:
- Δ H = -94.7 + 44,0 kJ = -50.7 kJ
 El cambio en la entalpía para la reacción
El cambio en la entalpía para la reacción
H 2 O 2 (ac) → H 2 O (g) + 1/2 O 2 (g) se puede obtener sin medir realmente el cambio de entalpía para la reacción añadiendo Δ H para las dos reacciones
H 2 O 2 (aq) → H 2 O (l) + 1/2 O 2 (g) Δ H = -94.7 kJ/mol
H 2 O (l) → H 2 O (g) Δ H = +44.0 kJ/molLa aditividad de los calores de reacción se desprende directamente de la primera ley de la termodinámica (Capítulo 15): El cambio de energía o entalpía entre dos
estados depende únicamente de la naturaleza de esos estados, y no de cómo se lleve a cabo el cambio. Una colección de químicos en un estado dado tiene cierta energía y cierta entalpía, ninguna de las cuales depende en modo alguno de cómo los químicos fueron llevados a ese estado. (Es decir, la historia pasada de los químicos puede afectar su energía actual y entalpía, pero no necesitamos saber esa historia para medir los valores de E y H.) De ahí que la diferencia entre entalpías de reactivos y productos, o el calor de reacción, sólo puede depender de la naturaleza de los estados inicial y final, y no de la forma particular en que se lleve a cabo la reacción. A esto se le llama a veces la ley de la suma de calor de Hess, que es un nombre bastante digno para una consecuencia natural de la primera ley de la termodinámica.
La aditividad de los calores de reacción hace innecesaria una gran cantidad de experimentación en termoquímica (la química del calor y la energía). No es necesario medir y tabular el cambio de entalpía de cada reacción química concebible. Por ejemplo, si conocemos el calor de vaporización del agua líquida (ecuación 2-10) y el calor de descomposición del peróxido de hidrógeno en agua líquida (ecuación 2-9), entonces nunca necesitamos medir el calor de descomposición del peróxido de hidrógeno a vapor de agua; la respuesta se puede calcular con anticipación. Si una cierta reacción es inconveniente de llevar a cabo, puede haber un conjunto de reacciones más fáciles cuya suma es la reacción en cuestión. Después de haber realizado los experimentos individuales, podemos agregar los cambios de entalpía de la misma manera que las ecuaciones químicas, para encontrar el calor de la reacción difícil de medir.
Supongamos que alguien propuso un esquema para hacer diamantes oxidando metano:
- CH 4 (g) + O 2 (g) → C (di) + 2 H 2 O (l)
[La notación (s) no es suficiente para el carbono, ya que el diamante (di) debe diferenciarse del grafito (gr).] Le gustaría saber si la reacción liberará calor que debe ser permitido en el diseño del recipiente de reacción. Esta particular síntesis nunca se ha llevado a cabo (y probablemente nunca lo será), sin embargo, puedes darle a tu amigo equivocado su respuesta a partir de un conocimiento de los calores de reacciones más fáciles. El calor de combustión de una sustancia que contiene C, N, O y H es el calor, por mol de sustancia, de la reacción con suficiente oxígeno para producir CO 2, N 2, y H 2 O líquido. Los calores de combustión son fáciles de medir, y estuvieron entre los primeros calores de reacción en ser medidos y tabulados sistemáticamente. Se pueden encontrar extensas tablas de calores de combustión en libros como el CRC Handbook of Chemistry and Physics o Lange Handbook of Chemistry. Los calores de combustión de metano y diamante son
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = -890 kJ/mol (2-12) C(di) + O2(g) → CO2(g) ΔH = -395 kJ/mol (2-13)La reacción de síntesis de diamante deseada se produce restando la segunda reacción de la primera, o añadiendo la primera reacción al reverso de la segunda, y el calor de reacción se encuentra de la misma manera:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = -890 kJ/mol (2-12) CO2(g) → C(di) + O2(g) ΔH = +395 kJ/mol (2-14)Observe que cuando una reacción se da la vuelta y se ejecuta en reversa, el calor de reacción cambia de signo, ya que un proceso que desprende 395 kJ en una dirección debe absorber 395 kJ en sentido inverso.
Calores de Formación
Debido a la aditividad de los calores de reacción, no todos los calores tienen que ser tabulados —sólo aquellos para el conjunto mínimo de reacciones del que se pueden obtener todos los demás. El conjunto que ha sido acordado por científicos e ingenieros está conformado por los calores de formación de compuestos a partir de sus elementos puros en estados estándar. Para sólidos y líquidos este estado estándar es la forma más común del elemento a 25 °C o 298 K y 1 atmósfera (atm) [2] presión externa; los gases se definen de manera similar pero a 1 atm de presión parcial. [3] El estado estándar para las mediciones termodinámicas que involucran carbono es el grafito (gr), no el diamante (di). Los calores de formación para todos los compuestos involucrados en la síntesis del diamante son
C(gr) + 2 H2(g) → CH4(g) ΔH = -74.8 kJ/mol (2-16) C(gr) → C(di) ΔH = +1.9 kJ/mol (2-17) H2(g) + 1/2 O2(g) → H2O(l) ΔH = -285.8 kJ/mol (2-18)En el Apéndice 3 se da una tabla de calores estándar de formación de compuestos a partir de sus elementos puros. En esa tabla, el subíndice 298 se refiere a la temperatura (298 K), y el superíndice cero significa que los reactivos y productos están todos en sus estados estándar. Para ilustrar cómo se encuentran los calores de las reacciones generales a partir de los calores de formación, volvamos a mirar la síntesis del diamante, ecuación 2-15. Esa reacción se puede obtener sumando la ecuación 2-17 a dos veces la ecuación 2-18 y el reverso de la ecuación 2-16:
C(gr) → C(di) ΔH = +1.9 kJ (2-17) 2 H2(g) + O2(g) → 2 H2O(l) ΔH = -571.6 kJ 2x(2-18) CH4(g) → C(gr) + 2 H2(g) ΔH = +74.8 kJ -(2-16)El calor de reacción se encuentra exactamente de la misma manera:
- Δ H = (+1.9) + 2 (-285.8) - (-74.8) = -494.9 kJ
Como puede ver, las consecuencias de no hacer un seguimiento de signos y coeficientes pueden ser desastrosas. El método más seguro es escribir cada ecuación, con su calor de reacción, de tal manera que la suma de las ecuaciones individuales sea la reacción deseada. Si todos los coeficientes de una ecuación se multiplican por un número arbitrario n, entonces el calor de formación también debe multiplicarse por n, y si una ecuación de formación se da la vuelta y se ejecuta a la inversa, entonces se debe cambiar el signo Δ H. Si las ecuaciones individuales se suman para dar la reacción deseada, entonces los calores individuales se suman para dar el calor de reacción general correspondiente.
Un atajo conveniente es pensar en el calor de formación de un compuesto como si se tratara, en cierto sentido, de la entalpía del propio compuesto. (Advertencia: Esto es posible sólo porque los calores de formación de los elementos son cero por definición.) Entonces el calor de una reacción se convierte en la suma de calores de formación de todos los productos, menos los calores de formación de todos los reactivos, multiplicándose cada uno por el coeficiente de esa sustancia en la ecuación equilibrada.
Ejemplo 25
¿Cuál es el calor estándar de la reacción por la cual el óxido férrico es reducido por carbono a hierro y monóxido de carbono en un alto horno? Solución
La reacción es la siguiente, con el calor estándar de formación por mol escrito debajo de cada compuesto:
Fe 2 O 3 (s) + 3 C (gr) → 2 Fe (s) + 3 CO (g) Δ H (kJ/mol) -822.1 0.0 0.0 -110.5 El calor estándar de formación de los elementos a partir de ellos mismos, por supuesto, es cero, por definición. Por la reacción tal como está escrita,
- Δ H = 2 (0.0) + 3 (-110.5) - (-822.1) - 3 (0.0) = +490.6 kJ
Estos resultados son consistentes con el hecho de que se debe suministrar mucho calor para reducir el mineral de hierro a hierro. Obsérvese, sin embargo, que 490.6 kJ es el calor neto que se absorbería si la reacción se ejecutara a 298 K, no a los 1800 K de un alto horno. Sin embargo, esta cifra calculada también es el calor absorbido si el óxido férrico y el carbono se calientan de 298 K a 1800 K, se dejan reaccionar, y los productos se enfrían nuevamente a temperatura ambiente. El cambio de entalpía o el calor de una reacción depende únicamente de los estados inicial y final de los participantes, y no de si la temperatura se mantuvo constante o pasó a niveles de alto horno en el medio. Todo lo que importa es que la temperatura vuelva a bajar a 298 K al final.
Como otro ejemplo del principio, el calor neto que se desprende cuando el agua está hecha de hidrógeno y oxígeno será el mismo si una mezcla de H2 y 02 a 298 K explota violentamente y el agua resultante se enfría de nuevo a 298 K, o si la misma mezcla reacciona lentamente en presencia de platino finamente dividido como un catalizador, sin aumentar nunca su temperatura. Entonces, al referirse a calores de reacción, cuando decimos que los valores son correctos para el proceso realizado “a 1 atm de presión y 298 K”, requerimos únicamente que los reactivos comiencen en estas condiciones, y que los productos terminen ahí. Es por ello que las tablas de calores de formación bajo condiciones estándar (Apéndice 3) son útiles.
Principios de Conservación
Referencias y Notas
- La unidad de longitud SI es el metro (m), dividido en 10 decímetros (dm) o 100 centímetros (cm). La unidad de volumen es el metro cúbico (m 3). Para trabajos de laboratorio el metro cúbico es demasiado grande para ser conveniente, por lo que se acostumbra utilizar el litro, que en el SI se define como 1 dm 3, y el mililitro (mL), que equivale a 1 cm 3 (o a veces cc). Por lógica estricta el litro es una unidad extraña en SI, pero es demasiado conveniente, y su uso demasiado arraigado, para ser eliminado. Los científicos en el pasado tendían a utilizar mililitros para volúmenes de líquidos y centímetros cúbicos para volúmenes de sólidos. De ahí que el volumen de una solución de cloruro de sodio se mediría en mililitros, pero la densidad de la sal de roca (cristales de cloruro de sodio) se reportaría en gramos por centímetro cúbico, o g cm -3. Usaremos sólo milimetros en este capítulo, pero a partir de entonces nos sentiremos libres de usar centímetros cúbicos donde esa unidad parezca más natural. Recuerda que 1 m 3 = 1000 litros, 1 litro = 1000 mL, y 1 mL = 1 cm 3. Para mayor información sobre SI, consulte el Apéndice 1.
- La conversión a la escala de temperatura absoluta o Kelvin se considera en el Capítulo 3, al igual que la atmósfera como unidad de presión. (Por convención SI, no se utiliza ningún signo de grado para la escala Kelvin.)
- La presión parcial de un gas en una mezcla es la presión que mostraría el gas si se eliminaran todos los demás gases y fuera el único gas presente.