5.1: Hidrógeno, Oxígeno y Agua
- Page ID
- 77123
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Las palabras “ácido” y “base” son términos
funcionales, y no etiquetas.
Describen lo que hace una sustancia,
más que lo que es.
R. von Handler (n. 1931)
Introducción Editar
Casi todas las reacciones que preocupan a un químico tienen lugar en solución y no en fases gaseosas o sólidas. La mayoría de estas reacciones ocurren en solución acuosa, donde el agua es el disolvente. Hay buenas razones para esta preferencia por los medios líquidos. Las moléculas deben entrar en contacto para reaccionar, y las tasas de migración de átomos o moléculas dentro de los cristales suelen ser demasiado lentas para ser útiles. Por el contrario, las moléculas de gases son móviles, pero los volúmenes de gas son inconvenientemente grandes, y muchas sustancias no pueden introducirse en la fase gaseosa sin descomponerse. Las soluciones de moléculas reaccionantes en líquidos ofrecen una combinación óptima de compacidad, facilidad de manejo y rapidez de mezcla de diferentes sustancias.
Como vimos en el Capítulo 1, el agua tiene virtudes especiales como solvente. Es polar, en el sentido ilustrado en la Figura 5-1. El átomo de oxígeno atrae los electrones de los enlaces 0 - H hacia sí mismo, adquiriendo una ligera carga negativa y dejando pequeñas cargas positivas en los dos átomos de hidrógeno. Por lo tanto, el agua puede interactuar con otras moléculas polares. Además, las moléculas de agua se disocian en pequeña medida en iones H + y OH -, una propiedad que es importante en las reacciones ácido-base. Este capítulo se refiere a las reacciones y equilibrios en solución acuosa, especialmente aquellos que involucran ácidos y bases.
Equilibrios en Soluciones Acuosas Editar

Si los reactivos y productos en una reacción química están en solución, la forma de la expresión constante de equilibrio es la misma que para las reacciones gaseosas, pero las unidades lógicas de concentración son moles por litro de solución (unidades de molaridad).
aA + bBcC + dD (4-7) Keq =
(4-8)
Algunas reacciones en solución acuosa involucran agua como participante. Un ejemplo bien estudiado es la hidrólisis (“división por agua”) de la molécula de acetato de etilo para producir ácido acético y alcohol etílico (etanol):

Debido a que todas las otras moléculas participantes en sí son polares, se disuelven bien en agua, lo que por lo tanto es un buen agente dispersante. Además, el agua juega un papel directo como molécula reactante.
La expresión constante de equilibrio para esta reacción, en principio, es
K'eq =(5-2)
Sin embargo, dado que el agua está presente en tal exceso en su papel de disolvente, la concentración de agua prácticamente no cambia durante la reacción. En soluciones diluidas esta es aproximadamente la concentración de agua en su estado puro.
H2O =55.6 moles liter-1 (5-3)
Esta concentración constante de agua puede llevarse al lado izquierdo de la ecuación 5-2 e incorporarse a la constante de equilibrio, como vimos para las fases condensadas en el Capítulo 4, por lo que la expresión de la constante de equilibrio se convierte
Keq = K'eq[H2O] =(5-4)
Otras reacciones en solución acuosa involucran iones; un ejemplo es la precipitación de iones de plata con iones cloruro, en forma de cloruro de plata insoluble:
-
- Ag + Cl -
 AgCl (s)
AgCl (s)
- Ag + Cl -
En este proceso el agua no es un reactivo directo o producto, sino que sí interactúa con los iones para mantenerlos en solución. Cualquier ion en solución acuosa es hidratado, o rodeado por moléculas polares de agua como en la Figura 5-1d. Si el ion central es positivo (un catión), entonces los átomos de oxígeno cargados negativamente de las moléculas de agua apuntan hacia él; si el ion central es negativo (un anión), los átomos de hidrógeno cargados positivamente de las moléculas de agua son los más cercanos.
Cada ion hidratado es así estabilizado por un ambiente inmediato de cargas opuestas en signo a su propia carga. Cuando un cristal de sal se disuelve en agua, se rompen las atracciones entre los iones de carga opuesta en el cristal. En compensación, se establecen atracciones similares entre los iones y las moléculas de agua hidratantes. La solubilidad de los cristales de sal es el resultado de un equilibrio o competencia entre las fuerzas cristalinas y las fuerzas de hidratación. Es por ello que las sales no se disuelven en disolventes no polares como el benceno, que no puede ofrecer atractivos hidratantes.
Ionización de Agua y Escala de pH Editar
El agua misma ioniza en pequeña medida:
H2O(l)H+ + OH- (5-5)
Cada ion está rodeado de moléculas polares de agua (como Na + y OH - están en la Figura 5-1d). El estado hidratado del protón, H+, a veces se representa como H 3 O +, es decir, H + • H 2 0. Pero esta es una notación innecesaria e incluso engañosa. Una representación más precisa de un protón hidratado sería H 9 O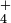 , o H + • (H 2 0) 4, para representar el cúmulo:
, o H + • (H 2 0) 4, para representar el cúmulo:
Supondremos que H + y OH -, como todos los demás iones, están hidratados en solución acuosa, y por lo tanto los representaremos simplemente como H + y OH -.
| K w = [H +] [OH -] | ||||
| T (°C): | 0 | 25 | 40 | 60 |
| K w | 0.115 10 -14 10 -14 |
1.008 10 -14 10 -14 |
2.95 10 -14 10 -14 |
9.5 10 -14 10 -14 |
La expresión constante de equilibrio para la disociación del agua es
K'eq(5-6)
La forma constante [H 2 O] se puede combinar con K' eq como antes, produciendo
Kw = 55.6K'eq = [H+][OH-] (5-7)
Esta nueva constante de equilibrio, K w, se denomina constante ión-producto para el agua. Como la mayoría de las constantes de equilibrio, K w varía con la temperatura. Algunos valores experimentales de la constante ión-producto se dan en la Tabla 5-1.
| A partir de los datos del Cuadro 5-1 y el principio de Le Chatelier, predecir si la disociación del agua libera o absorbe calor. |
|
Solución Dado que una temperatura más alta favorece la disociación, la disociación es un proceso endotérmico o de absorción de calor. Del Apéndice 3, ΔH (diss de H 2 0) = +55.90 k J mol -1. Esta es la energía requerida para romper un enlace O-H, dejando así ambos electrones con el átomo de oxígeno. |
Se acostumbra tomar K w, /sub> = 1.00 10, sup>-14 como lo suficientemente preciso para los cálculos de equilibrio de temperatura ambiente. (También es habitual en los cálculos de equilibrio ácido-base escribir K w como si se tratara de un número exacto, 10, sup>-14 en lugar de 1.00
10, sup>-14 como lo suficientemente preciso para los cálculos de equilibrio de temperatura ambiente. (También es habitual en los cálculos de equilibrio ácido-base escribir K w como si se tratara de un número exacto, 10, sup>-14 en lugar de 1.00 10 -14.) Esto significa que en agua pura, donde las concentraciones de hidrógeno e hidróxido son iguales,
10 -14.) Esto significa que en agua pura, donde las concentraciones de hidrógeno e hidróxido son iguales,
[H+] = [OH-] = 10-7 mole liter-1 (5-8)

Dado que las grandes potencias de 10 son torpes de tratar, se ha ideado una notación logarítmica, llamada escala de pH (Figura 5-2). (El símbolo pH significa “poder negativo de la concentración de iones de hidrógeno”.) El pH es el logaritmo negativo de [H+]:
pH = -log10[H+] (5-9)
Si la concentración de iones de hidrógeno es de 10 -7 mol litro -1, entonces
-
- pH = -log 10 (10 -7) = +7
Por una definición análoga,
pOH = -log10[OH-] (5-10)
y el PoH del agua pura también es +7. La constante de equilibrio Kw también se puede expresar en términos logarítmicos:
pKw = -log10Kw = +14 (5-11)
Finalmente, la expresión de equilibrio para la disociación del agua,
[H+][OH-] = Kw = 10-14 (5-12)
se puede escribir
pH + pOH = 14 (5-13)
En una solución ácida, [H +] es mayor a 10 -7, por lo que el pH es menor a 7. El equilibrio ión-producto aún se mantiene, y [OH -] se puede encontrar a partir de la expresión
[OH-] =(5-14)
o
pOH = pKw - pH = 14 - pH (5-15)
Los valores de pH aproximados de algunas soluciones comunes se dan en el Cuadro 5-2.
| Sustancia | pH |
|---|---|
| HCl concentrado comercial (37% en peso) | ~ -1.1 |
| 1 M;; solución de HCl | 0.0 |
| Jugo gástrico | 1.4 |
| Zumo de Limón | 2.1 |
| Zumo de naranja | 2.8 |
| Vino | 3.5 |
| Jugo de Tomate | 4.0 |
| Café Negro | 5.0 |
| Orina | 6.0 |
| Agua de lluvia | 6.5 |
| Leche | 6.9 |
| Wtaer puro a 24°C | 7.0 |
| Sangre | 7.4 |
| Solución de bicarbonato de sodio | 8.5 |
| Solución de bórax | 9.2 |
| Limewater | 10.5 |
| Amoníaco doméstico | 11.9 |
| Solución de NaOH 1 M | 14.0 |
| Solución saturada de NaOH | ~ 15.0 |
| Del Cuadro 5-2, ¿cuál es la concentración de iones hidrógeno del jugo de naranja? ¿Cuál es la concentración de iones hidróxido? |
|
Solución Dado que el pH del jugo de naranja es 2.8, la concentración de iones de hidrógeno es
La concentración de iones hidróxido se puede obtener por cualquiera de dos métodos equivalentes:
o
|
| ¿Cuál es la relación de iones hidrógeno a iones hidróxido en agua pura? ¿En jugo de naranja? |
|
Solución En agua pura la relación es de 10 -7 a 10 -7 o 1 a 1. En el jugo de naranja, del Cuadro 5-2, la relación es 1.6 |
Para mantener el equilibrio, los iones H + añadidos del jugo han empujado la reacción de disociación del agua en la dirección de H 2 0 no disociado, eliminando así los iones OH - de la solución. El jugo de naranja no es un ácido particularmente fuerte, y la enorme fluctuación de las relaciones iónicas incluso en este ejemplo ilustra la utilidad de la notación de potencia de diez y logarítmica (pH, pOH, p K).
Ácidos Fuertes y Débiles Editar


Arrhenius definió un ácido (Capítulo 2) como una sustancia que aumenta la concentración de iones hidrógeno de una solución acuosa, y una base como una sustancia que aumenta la concentración de iones hidróxido. Una definición más general fue propuesta en 1923 por Johannes Bronsted y T. M. Lowry. La definición de Bronsted-Lowry también se puede aplicar a soluciones no acuosas: Un ácido es cualquier sustancia que sea capaz de renunciar a un ión hidrógeno, o protón, y una base es cualquier sustancia que pueda combinarse con y por lo tanto eliminar un ion hidrógeno. Ahora que entendemos que las moléculas de agua existen en equilibrio con sus iones H+ y OH- disociados, podemos ver que las dos definiciones son equivalentes cuando el agua es el disolvente. Los ácidos Arrhenius y Br~Nsted son sustancias liberadoras de iones de hidrógeno. Si una base Br~Nsted se combina con iones de hidrógeno, desplaza el equilibrio de la ecuación 5-5 a favor de la disociación hasta que se restaure el equilibrio. En el proceso se forman más iones hy~ droxide, por lo que en el agua una base Br~Nsted también es una base Arrhenius.
En solución acuosa, los ácidos se clasifican como fuertes o débiles. Los ácidos fuertes están completamente disociados o ionizados, e incluyen ácidos de hidrógeno como el ácido clorhídrico (HCl) y el ácido yodhídrico (HI), y oxiácidos (ácidos que contienen oxígeno) como el ácido nítrico (HN0 3), ácido sulfúrico (H 2 S0 4) y ácido perclórico (HCI0 4) ). Cada uno de estos ácidos pierde un protón en solución, y la constante de disociación ácida, K a, es tan grande (> 10 3) que queda muy poco ácido no disociado por medir. (HS0 pierde un segundo protón y es un ácido débil.)
pierde un segundo protón y es un ácido débil.)
Los ácidos débiles tienen constantes de ionización medibles en solución acuosa, debido a que no se disocian completamente. Ejemplos (a 25°C) son:
| Sulfúrico: | HSO 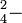 K a K a |
=![\ textstyle\ frac {[H^+] [SO_4^ {2-}]} {[HSO_4^-]}](https://upload.wikimedia.org/math/f/8/d/f8dab122b4aa3e28bc19f47c12daa041.png) |
| (2ª ionización) | = 1.2 10 -2 (5-16) 10 -2 (5-16) |
|
| Fluorhídrico: | HF K a K a |
=![\ textstyle\ frac {[H^+] [F^-]} {[HF]}](https://upload.wikimedia.org/math/f/6/0/f6022a96e7d208db9b11438563e91968.png) |
= 3.5 10 -4 (5-17) 10 -4 (5-17) |
||
| Acético: | CH 3 COOH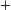 K a K a |
=![\ textstyle\ frac {[H^+] [CH_3COO^-]} {[CH_3COOH]}](https://upload.wikimedia.org/math/c/d/4/cd40665cb04cb67b1b25ff8318b7720f.png) |
= 1.76 10 -5 (5-18) 10 -5 (5-18) |
||
| Hidrociánico: | HCN K a K a |
=![\ textstyle\ frac {[H^+] [CN^-]} {[HCN]}](https://upload.wikimedia.org/math/5/2/5/5257701325d6c4b81a94f58ed63b35e4.png) |
= 4.9 10 -10 (5-19) 10 -10 (5-19) |
La distinción entre ácidos fuertes y débiles es algo artificial. La ionización de HCl no es simplemente una disociación; es, más bien, el resultado de una competencia exitosa de moléculas H 2 0 con iones Cl - para el protón, H +:
HCl + xH2OH+ • (H2O)x + Cl- (5-20)
En la teoría de Bronsted-Lowry, cualquier donante de protones es un ácido, y cualquier aceptor de protones es una base (Figura 5-3). Por lo tanto, HCl es un ácido, y Cl - es su base conjugada. Dado que el HCl pierde un protón fácilmente es un ácido fuerte, y como Cl - tiene tan poca afinidad por el protón es una base débil. En contraste, el HCN es un ácido muy débil, debido a que relativamente pocas moléculas de HCN liberan su protón. Su base conjugada, CN -, es una base fuerte en virtud de su alta afinidad por un protón.
El agua es una base algo más fuerte que el Cl -, y cuando está presente en exceso, como en una solución acuosa de HCl, toma prácticamente todos los protones del HCl, dejándolo completamente ionizado. CN, sup>- es una base mucho más fuerte que H 2 O, por lo que solo una pequeña fracción de los protones del HCN se unen a las moléculas de agua. Es decir, el HCN solo está ligeramente ionizado en solución acuosa, como indica su K a de 4.9 10 -10.
10 -10.
Debido a que el agua está presente en gran exceso, cualquier ácido cuya base conjugada sea más débil que H 2 O (es decir, tenga una menor afinidad por los protones que tenga H 2 O) se ionizará casi completamente en solución acuosa. No podemos distinguir entre el comportamiento del HCl y del HCl0 4 (ácido perclórico) en solución acuosa. Ambos están completamente disociados y por lo tanto son ácidos fuertes. Sin embargo, para un disolvente con menor atracción por protones que el agua, sí encontramos diferencias entre HCl y HCl0 4. Con éter dietílico como disolvente, el ácido perclórico sigue siendo un ácido fuerte, pero el HCl solo está parcialmente ionizado y por lo tanto es un ácido débil. El éter dietílico no solvata un protón tan fuertemente como lo hace el agua (Figura 5-4). (La solvatación es una generalización del concepto de hidratación, que se aplica a disolventes distintos al agua). El punto de equilibrio en la reacción
HCl + xC2H5OC2H5H+ • (C2H5OC2H5)x + Cl- (5-21)
se encuentra muy a la izquierda, por lo que el HCl solo se disocia parcialmente en éter. Sólo en un ácido extremadamente fuerte, como el ácido perclórico, el anión tiene tan poca atracción por el protón que lo liberará a éter como disolvente aceptor. Claramente, mediante el uso de disolventes distintos al agua, podemos ver diferencias en la acidez (o afinidad de protones) que se enmascaran en solución acuosa. Este enmascaramiento de las resistencias ácidas relativas por disolventes como el agua se conoce como el efecto nivelador.

Las constantes de disociación para una serie de ácidos en solución acuosa se listan en la Tabla 5-3, con estimaciones de la Ka para ácidos fuertes que son “nivelados” por el disolvente en solución acuosa. La disociación del disolvente protonado, H 3 O +, en protones hidratados y H 2 0, representa meramente un barajado de protones de un conjunto de moléculas de agua a otro, y debe tener un K eq de 1.00. En amoníaco líquido como disolvente, todos los ácidos cuyas bases conjugadas son más débiles que NH 3 serían nivelados por el disolvente y serían ácidos fuertes totalmente ionizados. Así, el ácido fluorhídrico y el ácido acético son ambos ácidos fuertes en el amoníaco líquido.
El efecto nivelador del disolvente y el origen de los ácidos fuertes y débiles se resumen en la Figura 5-4. La distinción entre ácidos fuertes y débiles depende tanto del disolvente como de las propiedades inherentes de los propios ácidos. Sin embargo, en solución acuosa la distinción es real. Siempre y cuando la discusión se limite a soluciones acuosas (como la nuestra será a partir de ahora), nos resultará útil pensar y tratar las dos clases de ácidos por separado.
Bases Fuertes y Débiles Editar
En la terminología de Arrhenius una base es una sustancia que disminuye la concentración de iones hidrógeno de una solución. El hidróxido de sodio, el hidróxido de potasio y compuestos similares son bases porque se disuelven y se disocian completamente en solución acuosa para producir iones hidróxido:
NaOHNa + + OH- (5-22) KOH
K+ + OH-
Estos iones de hidróxido en exceso alteran entonces el equilibrio de disociación del agua, y se combinan con algunos de los protones que normalmente se encuentran en el agua pura:
H+ + OH-H2 [H+] =
10-7 (5-23)
En la defnición Bronsted-Lowry más generalizada, el ion hidróxido en sí es la base, porque es la sustancia que combina con el protón. Los iones Na + y K + simplemente proporcionan los iones positivos que son necesarios para la neutralidad eléctrica general del compuesto químico.
Los hidróxidos comúnmente encontrados de metales alcalinos (Li, Na, K) se disuelven y se disocian completamente para producir la misma base Bronsted-Lowry, OH -. Todos estos hidróxidos son bases fuertes, análogas a ácidos fuertes como HCl y HNO 3. Otras sustancias como el amoníaco y muchos compuestos orgánicos nitrogenados también pueden combinarse con protones en solución y actuar como bases Bronsted-Lowry. Estos compuestos son generalmente bases más débiles que el ion hidróxido, debido a que tienen menor atracción por los protones. Por ejemplo, cuando el amoníaco compite con OH - por protones en una solución acuosa, solo tiene éxito parcial. Se puede combinar con solo una porción de los iones H +, así tendrá una constante de equilibrio medible.
NH3 + H+NH
(5-24)
No hay razón lógica por la que esta reacción no pueda describirse mediante una constante de disociación acd, como en el Cuadro 5-3. El ion amonio, NH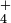 , es el ácido conjugado Bronsted-Lowry de la base NH 3. No hay razón para que, en un par ácido-base, sea el ácido el que debe ser neutro y la base cargada, como en HCl/Cl -y HCN/CN -. El
, es el ácido conjugado Bronsted-Lowry de la base NH 3. No hay razón para que, en un par ácido-base, sea el ácido el que debe ser neutro y la base cargada, como en HCl/Cl -y HCN/CN -. El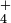 ion NH es un ácido tan respetable como el HCl o el HCN, y aunque más débil que el HCl, en realidad es más fuerte que el HCN. Así, podemos describir la reacción de amoníaco como una disociación ácida:
ion NH es un ácido tan respetable como el HCl o el HCN, y aunque más débil que el HCl, en realidad es más fuerte que el HCN. Así, podemos describir la reacción de amoníaco como una disociación ácida:
NH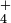
NH3 + H+ Ka= 5.6
10-10 (from Table 5-3) (5-25)
o, si queremos enfocarnos en el comportamiento básico del NH 3,
NH3 + H+NH
Keq =
= 1.8
10+9 (5-26)
Sin embargo, el lenguaje químico ha quedado atrapado por la terminología ácido-base más antigua introducida por Arrhenius, y debes ser consciente de esto. Arrhenius pensó en una base como una sustancia que libera iones OH en solución acuosa. Para hidróxidos de metales alcalinos como NaOH, el proceso fue sencillo:
NaOHNa+ + OH- (5-27)
Pero ¿qué pasa con el NH 3? ¿De dónde provienen los iones hidróxido? Arrhenius asumió que cuando el amoníaco se disolvió en agua la reacción era
NH3 + H2NH4OH
NH
+ OH- (5-28)
Esto puso en línea el NH 3 al postular una base intermedia de hidróxido amónico que se disocia completamente; el hidróxido amónico sería una base débil que se disocia solo parcialmente. Arrhenius definió una constante de disociación de bases, K b, como
BOHB+ + OH<sup- Kb =
(5-29)
donde B generalmente representa un metal. Para el amoníaco, K a y K b estarían relacionados por
Ka =(5-30)
Kb =1.8
10-5 (5-31)
Desafortunadamente para la teoría de Arrhenius, no hay evidencia de que el hidróxido amónico, NH 4 0H, exista como un compuesto real. Es más exacto decir que la molécula de amoníaco polar se hidrata como cualquier otra molécula polar: NH 3 • (H 2 0) x. Amoniaco, NH 3, combina directamente con un protón y con moléculas de agua:
NH3 + H+O + xH2NH
(in acid solutions) (5-32) NH3 + xH2O
NH
+ OH- (in acid solutions)
Sin embargo, la notación de Arrhenius está demasiado incrustada en el tejido de la química para desalojarla, y a menudo usaremos K b para bases débiles en lugar de K a para sus ácidos conjugados. En general, las bases fuertes completamente disociadas que encontraremos serán compuestos de hidróxido, y las bases débiles serán compuestos de amoníaco y nitrógeno orgánico como los enumerados en la Tabla 5-4. K b siempre se puede encontrar a partir de K a y K w y la expresión
KaKb = Kw (5-33)

Soluciones de Ácidos Fuertes y Bases: Neutralización y Titulación Editar
Cuando se agrega una cantidad de ácido fuerte al agua, el efecto es el de agregar la misma cantidad de iones hidrógeno, ya que el ácido está totalmente disociado,
| ¿Cuál es la concentración de iones hidrógeno de una solución de ácido nítrico 0.0l00 M? ¿Cuál es el pH? |
|
Solución
La solución es bastante ácida. |
| ¿Cuál es la concentración de iones hidrógeno y el pH de una solución de hidróxido de sodio 0.0050 M? |
|
Solución La contribución de iones hidróxido de NaOH completamente disociado es
Esta gran cantidad de iones hidróxido reprimirá la disociación normal del agua y potenciará la reacción a la izquierda:
La concentración de iones hidrógeno se encuentra a partir de la expresión de equilibrio de agua:
La solución es bastante básica. |
| Si mezclamos volúmenes iguales de las soluciones de los dos ejemplos anteriores, ¿cuál será el pH de la solución resultante? | ||||||
|
Solución Si se mezclan volúmenes iguales, entonces la concentración de cada soluto se reducirá a la mitad, ya que el volumen final es el doble del volumen de cada solución inicial. La solución final sería 0.0050 M en ácido nítrico y 0.0025 M en hidróxido de sodio. Pero el ácido y la base reaccionarán y se neutralizarán entre sí hasta que uno u otro se agote:
o simplemente
ya que los iones de sodio y nitrato no participan en la reacción de neutralización. En este caso, el hidróxido de sodio se encuentra en menor suministro. Cuando toda la base ha sido neutralizada, todavía tenemos
|
| ¿Cuántos mililitros de HCl 0.10 M debemos agregar a 200 ml de KOH 0.0050 M para bajar el pH a 10.0? |
|
Solución Sin HCl, el pH de la solución de hidróxido de potasio sería de 11.7, como en el Ejemplo 5. Dejar y igualar el número de mililitros de solución de HCl necesarios para producir un pH de 10.0. Dado que 0.0050 mol litro -1 es lo mismo que 0.0050 milimoles ml -1, el número total de milimoles (m moles) de KOH es
El número total de milimoles de HCl que deben agregarse es
Dado que la solución final es básica, n KOH - n HCl. La cantidad neta de iones hidróxido sobrantes después de la neutralización parcial por HCl es
El volumen final es
y por lo tanto el hidróxido final en concentración es
Un pH de 10.0 significa un pOH de 4.0 y [OH -] = 10 -4 mol litro -1, así
y
|
Curvas de valoración y valoración Editar
Si sumamos iguales números de equivalentes de un ácido fuerte y una base fuerte, se neutralizarán entre sí por completo, y el pH será de 7.0. Como vimos en el Capítulo 2, esto hace posible el método de titulación para medir cantidades de ácido o base.
|
Ciento cincuenta mililitros de solución de HCl de concentración desconocida son Titulado con NaOH 0.10 M. Se requieren ochenta mililitros de solución base para neutralizar el ácido. ¿Cuántos moles de HCl estaban presentes originalmente y cuál era la concentración de solución ácida? |
|
Solución El número de milimoles de base utilizados es
Este debe ser el mismo que el número de milimoles de ácido originalmente presentes, si la neutralización fue completa.
|
Una forma común de determinar el punto de equivalencia de titulación (el punto en el que ocurre la neutralización) es con un indicador ácido-base. Los indicadores son ácidos orgánicos débiles o bases que tienen diferentes colores en sus estados ionizado y neutro (o en dos estados ionizados). Si su cambio de color ocurre en la vecindad de pH 7, y si agregamos unas gotas de solución indicadora a la solución que se está valorando, vemos este cambio de color en el punto final de la titulación. Discutiremos algunos indicadores comunes en la sección sobre ácidos débiles. La coincidencia del punto de cambio de color del indicador y el punto final de una titulación no tiene que ser muy exacta, ya que el pH oscila drásticamente a través de varias unidades a medida que la neutralización se completa. Esto puede facilitar la vida del químico analítico, y vale la pena mirar más de cerca el comportamiento del pH durante la titulación. Para ilustrar lo que acabamos de decir, calculemos la curva de titulación para un ácido fuerte típico y una base fuerte.
| Cincuenta mililitros de HN0 3 0.10 M se valoran con KOH 0.10 M, en un arreglo experimental como el mostrado en la Figura 2-3. Calcular el pH de la solución en función del volumen de solución de KOH añadido (v, en mililitros). |
|
Solución Es más fácil tratar este cálculo en tres partes: antes de la neutralización, en la neutralización (punto de equivalencia) y después de la neutralización. Antes del punto de equivalencia, calcular cuánta base se ha agregado, asumir que toda esta base se utilizó para neutralizar parte del ácido, y calcular cuánto ácido quedaría sin neutralizar, en función del volumen de solución base añadida. |


| Original: | n HNO 3 = | 50 ml 0.10 mmol ml -1 = 5.0 milimoles 0.10 mmol ml -1 = 5.0 milimoles |
| Añadido: | n KOH = | v ml 0.10 mmol ml -1 0.10 mmol ml -1 |
| Ácido neto: | n ácido = | 5.0 milimoles - 0.10 v mmol |
| Volumen total: | V = | 50 + v ml |
| Ión de hidrógeno | ||
| concentración: | [H +] neto = | 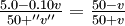 (0.10) mmol ml -1 (0.10) mmol ml -1 |
El cálculo de [H +] para diversos valores de v se muestra en la Tabla 5-5, y estos cálculos se trazan con círculos abiertos a la izquierda de la Figura 5-5. En el punto de equivalencia, las cantidades de ácido y base son iguales y el pH es 7.0. Después del punto de equivalencia, solo necesitamos calcular cuánta base se agregó por encima de la requerida para neutralizar el ácido, y usar esta para encontrar [OH - j, PoH, y pH:
| Original: | n HNO 3 = | 50 mililitros (como antes) |
| Añadido: | n KOH = | v ml 0.10 mmol ml -1 0.10 mmol ml -1 |
| Ácido neto: | n base = | 0.10 v - 5.0 |
| Volumen total: | V = | 50 + v ml |
| Concentración de iones hidrógeno: | ||
| [OH -] |  (0.10) mmol ml -1 (0.10) mmol ml -1 |
Este cálculo para varios valores de v y los valores de pH correspondientes se listan en la Tabla 5-5 y se trazan con círculos sólidos a la derecha de la Figura 5-5. Ahora es obvio por qué la elección de un indicador no es demasiado crítica en tal titulación. Cualquier indicador que cambie de color entre pH 4 y pH 10 servirá.
Titular un ácido débil con una base fuerte, o una base débil con un ácido fuerte, es más complicado porque el componente débil solo está parcialmente disociado. Deben utilizarse equilibrios de disociación del tipo discutido en la siguiente sección. No nos preocuparemos en este capítulo de tales titulaciones, sino que se tratan en el Apéndice 5, con un ejemplo de una curva de titulación correspondiente a la Figura 5-5.
Equilibrios con ácidos débiles y bases Editar
Debido a que los ácidos débiles solo se disocian parcialmente en agua, la contribución de un ácido débil como el ácido acético a la concentración de iones hidrógeno es menor que la concentración total de ácido agregado. La expresión constante de equilibrio para la disociación del ácido debe ser utilizada explícitamente. Estos principios generales se pueden ilustrar con un ejemplo concreto, el de calcular el pH de una solución de ácido acético 0.0l00 M. Como vimos en el Ejemplo 5-4 para el ácido nítrico, un ácido fuerte, una solución de 0.0100 M tiene un pH de 2.00. Debido a que el ácido acético es un ácido débil y solo parcialmente disociado, una solución 0.0 100 M tendrá una concentración de iones hidrógeno menor a 0.0100 M, y un pH mayor a 2.0.
Es común representar el ion acetato, CH 3 COO -, simplemente por Ac -, y la molécula de ácido acético no disociado, CH 3 COOH, por HAc como si se tratara de un simple ácido inorgánico. (También se utilizan las formas OAc - y HOAc, para indicar que el ácido acético es un oxiácido con el protón disociante unido a un átomo de oxígeno). La disociación de hAC es incompleta:
-
- HaC
 H + + Ac -
H + + Ac -
- HaC
y la expresión de equilibrio que describe la disociación es
-
- K a =
![\ textstyle\ frac {[H^+] [Ac^-]} {[HaC]}](https://upload.wikimedia.org/math/3/3/9/339257471a7b20486eaf1510c314d874.png) = 1.76
= 1.76 10 -5 (de la Tabla 5-3)
10 -5 (de la Tabla 5-3)
- K a =
Conocemos la concentración global inicial, c 0, de ácido acético:
-
- c 0 = 0.0100 mol litro -1
y sabemos que en equilibrio parte de este ácido acético permanece sin disociar y parte de él se ha ionizado a iones acetato, Ac -:
-
- c 0 = [HaC] + [Ac -] (ecuación de balance de masa)
A esto se le llama una ecuación de balance de masa, porque establece que el acetato total no se crea ni se destruye durante la disociación. También sabemos que las concentraciones de iones hidrógeno e iones acetato son iguales, ya que la disociación de HAc es la única fuente de H +. (Es legítimo descuidar el H + de la disociación del agua, ya que el ácido acético reprime la disociación del agua incluso por debajo de su pequeña extensión normal). Así
-
- [H +] = [Ac -] (ecuación de equilibrio de carga)
Esto se conoce como una ecuación de balance de carga, porque establece que la carga positiva total en la solución debe ser igual a la carga negativa total. Ahora podemos usar estos datos sobre la conservación del acetato y la neutralidad de la solución para simplificar la expresión constante de equilibrio. Deje que la concentración de iones de hidrógeno que estamos buscando sea [H +] = y, y elimine [Ac -] a la vez usando la ecuación de equilibrio de carga:
-
- K a =
![\ textstyle\ frac {y^2} {[HaC]}](https://upload.wikimedia.org/math/b/c/2/bc263bb5a7e6fb1290ead8d14a7f6492.png) (ecuación de equilibrio)
(ecuación de equilibrio)
- K a =
-
- c 0 = [HaC] + y (ecuación de balance de masa)
La segunda ecuación nos dice que la concentración de hAC no disociada es igual a la concentración global original, c0, menos la cantidad que se ha disociado y:
-
- [HaC] = c 0 - y
La expresión de equilibrio entonces es
-
- K a =
 (5-34)
(5-34)
- K a =
Sustituyendo el valor de K a de la Tabla 5-3, obtenemos
-
- 1.76
 10 -5 =
10 -5 =
- 1.76
o
-
- y 2 + 1.76
 10 -5 y -
10 -5 y - 10 -7 = 0
10 -7 = 0
- y 2 + 1.76
Se trata de una ecuación cuadrática, que se puede resolver con la fórmula cuadrática. Si ay 2 + por + c = 0, entonces
y =(5-35)
Para este problema, a = 1, b = 1.76 10 -5, y c = -1.76
10 -5, y c = -1.76 10 -7.
10 -7.
-
- y =

- y =
o
-
- y =

- y =
Sólo la respuesta positiva es razonable, porque no se puede tener una concentración negativa. Así la respuesta es
-
- y = 4.11
 10 -4 mol litro -1
10 -4 mol litro -1
- y = 4.11
Bajo ciertas condiciones físicas se puede tomar un atajo para evitar la fórmula cuadrática. En este ejemplo, ya que sabes que el ácido solo está ligeramente disociado, puedes intentar descuidar y en el denominador de la expresión de equilibrio para K a, asumiendo así que es pequeño en comparación con 0.0100 mol litro -1, y que la concentración de ácido acético no disociado es prácticamente el mismo que el ácido acético total presente. Esta suposición da
-
- 1.76
 10 -5 =
10 -5 =
- 1.76
y una respuesta aproximada de
-
- y = 4.2
 10 -4 = 0.00042 mol litro -1
10 -4 = 0.00042 mol litro -1
- y = 4.2
Esto está cerca de la respuesta correcta de 0.000411 mol litro -1. Puedes hacer una rápida mejora usando este valor aproximado en la concentración de acetato no disociado en el denominador:
-
- 1.76
 10 -5 =
10 -5 =
-
-
-
- = 4.11
 10 -4 mol litro -1
10 -4 mol litro -1
- = 4.11
-
-
- 1.76
La repetición del proceso anterior hasta que la respuesta permanezca constante de un cucle al siguiente se denomina método de aproximación sucesiva. Si tu intuición de cuánta disociación sufre el ácido es lo suficientemente buena, muchas veces puedes resolver el problema de equilibrio mediante una solución aproximada y una rápida corrección en menos tiempo del que lleva resolver la fórmula cuadrática. Si tu suposición original no es tan buena, es posible que se requieran dos o tres ciclos de aproximación antes de llegar a un valor inmutable para y.
Como muestran nuestros resultados, el ácido acético es de hecho solo ligeramente disociado a una concentración de 0.0100M. De los 0.0100 moles de litro -1 iniciales, 0.000411 mol se ha disociado, y 0.0096 moles permanecen como moléculas de HAc disueltas pero no disociadas. El porcentaje de disociación es
-
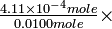 100 = 4.11%
100 = 4.11%
Dado que la concentración de iones hidrógeno es [H +] = 4.11 10 -4 M, el pH de esta solución es de 3.39.
10 -4 M, el pH de esta solución es de 3.39.
¿Qué pasa si diluimos la solución de ácido acético? ¿Se disocia entonces un mayor o menor porcentaje del ácido acético? ¿El pH aumenta o disminuye?
| ¿Cuál es el pH y el porcentaje de disociación en una solución de ácido acético 0.00100 M? |
|
Solución La expresión de equilibrio es como antes:
Despreciando y en comparación con c o, la solución aproximada es
y la solución obtenida usando este valor para corregir la concentración de HAc no disociada es
El uso de este segundo valor para corregir c 0 en otro ciclo de aproximación no hace ningún cambio en y, por lo que el proceso puede ser detenido. Ahora el pH es de 3.91 en lugar de 3.39, y el porcentaje de disociación es
|
Aunque la concentración real de iones de hidrógeno es menor (testigo del pH mayor), una mayor fracción del HAc presente se disocia en iones. Este es el principio de Le Chatelier nuevamente. Si se diluye una solución que contiene HAc, H + y Ac -, disminuyendo así su concentración total de todos los iones y moléculas, el equilibrio intentará restablecerse, a medida que cambian las reacciones, en la dirección que aumentará la concentración total de partículas de soluto de un tipo u otro. Comparar este comportamiento con el efecto de aumentar la presión sobre el equilibrio de gas amoniaco en el Capítulo 4.
Indicadores Editar

Un indicador es un ácido débil (o una base débil) que tiene colores muy diferentes en sus estados disociados y no disociados. El naranja de metilo (Figura 5-6) es un compuesto orgánico complejo que es rojo en su forma neutra, no ioniza y amarillo cuando se ioniza. Se puede representar como el ácido débil Hin:
-
 HiN H + + En -
HiN H + + En -- rojo amarillo
Agregar ácido desplaza el equilibrio del indicador hacia la izquierda, y agregar base lo desplaza hacia la derecha. De ahí que el naranja de metilo sea rojo en ácidos y amarillo en bases.
La intensidad de color de indicadores como el naranja de metilo es tan grande que los colores se pueden ver fácilmente incluso cuando la cantidad añadida a una solución es demasiado pequeña para tener una influencia apreciable en el pH de la solución. Sin embargo, la relación de indicador disociado a no disociado depende de la concentración de iones hidrógeno
Ka =(5-36)
y
(5-37)
log10() = pH - pka (5-38)
Para naranja de metilo, Ka = 1.6 X 10-4 y pKa = 3.8. Las formas neutra (roja) y disociada (amarilla) del indicador están presentes en concentraciones iguales cuando el pH = 3.8. El ojo es sensible a los cambios de color en un rango de proporciones de concentración de aproximadamente 100, o más de dos unidades de pH. Por debajo de pH 2.8, una solución que contiene naranja de metilo es roja, y por encima de aproximadamente 4.8 es claramente amarilla. Como puede ver en la Figura 5-5, un cambio de indicador sobre dos unidades de pH es bastante satisfactorio para valoraciones ácido-base fuertes.
El naranja de metilo podría usarse para la titulación en la Figura 5-5, aunque su pK a está lejos del punto de equivalencia de titulación de 7.0, solo porque el cambio en el pH en el punto de equivalencia es tan grande. Para titulaciones de ácidos débiles, esto no sería cierto, y sería mejor escoger un indicador con un pK más cerca del punto de equivalencia esperado. Otros indicadores se muestran en la Figura 5-7, junto con el rango de pH en el que ocurren sus cambios de color. La fenolftaleína es un indicador particularmente conveniente y común, que cambia de incoloro a rosa en el rango de pH 8 a 10.
Contribución a [H +] de la disociación del agua Editar

No se ha dicho nada en las discusiones de ácidos fuertes o ácidos débiles sobre una contribución a la concentración de iones hidrógeno de la disociación del agua misma. Se ha asumido tácitamente que todo el H + proviene del ácido. Esta es una suposición válida para todas menos las soluciones más diluidas de ácidos muy débiles como el HCN. La corrección por disociación del agua rara vez es necesaria, por lo que no se cubrirá en este capítulo. Se da un tratamiento completo en el Apéndice 5.
Ácidos Débiles y Sus Sales Editar
¿Qué pasará con un ácido débil como el ácido acético si agregamos algo de acetato de sodio (NaAc), que es la sal de una base fuerte (NaOH) y ácido acético? La sal se disolverá y disociará completamente en iones de sodio y acetato. Por el principio de Le Chatelier, esperaríamos que estos iones acetato añadidos fuercen al débil sistema de equilibrio de ácido acético en la dirección de una menor disociación. Esto es exactamente lo que sucede. La expresión de equilibrio ácido es la misma:
Ka =(5-39)
Sin embargo, actualmente existen dos fuentes de iones acetato: NaAc y HAc. El ion acetato suministrado por el acetato de sodio se mide por c s, la molaridad total de la sal, ya que la disociación es completa. La concentración de acetato del ácido acético se mide por la concentración de iones hidrógeno, ya que cada disociación de HAc para producir Ac - también produce un protón. Por lo tanto, la concentración total de iones acetato es
[Ac-]total = [Ac-]NaAc + [Ac-]HAc = cs + [H+] (5-40)
(Nuevamente, hemos descuidado cualquier protón aportado por la disociación del agua). La concentración de ácido acético no ionizado es la concentración total de ácido, c a, menos el acetato de la disociación:
[HAc] = ca - [Ac-]HAc = ca - [H+] (5-41)
Si representamos la concentración de iones hidrógeno por y, tenemos
Ka =(5-42)
Cuando la concentración de sal añadida, c s, es cero, esta es la expresión de equilibrio ácido-disociación débil simple que hemos visto previamente en la ecuación 5-34.

|
Cuáles son el pH y el porcentaje de disociación de una solución de 0.0L0M acético ácido en presencia de (a) sin NaAc, (b) 0.0050 M NaAc y (c) 0.010M NaAc? |
|
Solución Desde el principio de Le Chatelier, esperaríamos que la disociación de HaC se reprimiera a medida que se agrega más NaAc. El pH debería aumentar y el porcentaje de disociación debería disminuir. a) Este problema ya se resolvió en la Sección 5-6, produciendo pH 3.39 y 4.11% de disociación. b) Para c s = 0.0050 mol litro -1,
Esto se resuelve más fácilmente mediante aproximaciones sucesivas. Como primera aproximación podemos suponer que y será menor que 0.0050 o 0.010, y por lo tanto podemos descuidarlo cuando se suma o resta de estas cantidades:
Como segunda aproximación, podemos usar este valor de prueba de y tpo “correct” 0.0050 a 0.005035, y 0.010 a 0.009965, y resolver de nuevo la ecuación:
Una tercera aproximación es innecesaria, y la respuesta debe redondearse a 3.5, matemáticas>\ times</math> 10 -5 mole litro -1:
(c) Para c s = 0.010 mol litro -1
Observe que el ácido acético ahora se disocia tan poco que incluso la primera aproximación es adecuada. |
Los resultados para estas y algunas otras concentraciones de acetato de sodio se enumeran en la Tabla 5-6 y se representan gráficamente en la Figura 5-8. La primera sal añadida tiene un gran efecto sobre el grado de disociación y pH; las adiciones posteriores de sal causan menos cambios. Cuando el ácido y la sal están presentes en concentraciones iguales, el pH es igual al p K a del ácido.
|
||||||
| c s: | 0.0 | 0.001 | 0.002 | 0.005 | 0.010 | 0.020 |
| romper | ||||||
| pH: | 3.4 | 3.8 | 4.1 | 4.5 | 4.8 | 5.1 |
| romper | ||||||
| Porcentaje de disociación | 4.1 | 1.5 | 0.84 | 0.35 | 0.18 | 0.09 |
| de ácido acético: | ||||||
Editar búferes
Si las concentraciones de una solución de un ácido débil y una sal del anión ácido son razonablemente altas, entonces la solución es resistente a los cambios en la concentración de iones de hidrógeno.
|
Una solución es 0.050 M en HAc y 0.050 M en NaAc. Calcular el cambio en pH cuando se agrega 0.0010 moles de ácido clorhídrico (HCl) a un litro de solución, asumiendo que el aumento de volumen al agregar el HCl es despreciable. Compare esto con el pH si se agrega la misma cantidad de HCI a un litro de agua pura. |
|
Solución Antes de añadir HCl, el equilibrio de ácido acético es
Así
(Nuevamente, fuimos justificados en ignorar y en los términos [Ac -] y [HaC] porque el valor es pequeño comparado con 0.050.) Los protones añadidos de HCl se combinan con los iones acetato para formar más ácido acético:
Así, a una buena aproximación, se agotan todos los protones añadidos, y las nuevas concentraciones de ácido acético y acetato son
El pH cambia de 4.75 a 4.74, una diferencia de solo 0.01 unidades. En ausencia de HAc y NaAc, la misma concentración de HCl produciría un pH de 3.0. |
Esta resistencia al cambio de pH se llama acción amortiguadora, y la solución de HAc y NaAc es un tampón acetato. Los tampones se utilizan ampliamente para el control del pH en la química de laboratorio, en la industria química y en organismos vivos. Un sistema de tampón de carbonato en su torrente sanguíneo, que implica la reacción
H+ + HCO
H2CO3
CO2 + H2O (5-43)
mantiene el pH de la sangre alrededor de 7.4. Cuando un bioquímico estudia la actividad enzimática en el laboratorio, debe utilizar un sistema tampón para mantener un pH constante durante los experimentos, de lo contrario sus resultados pueden tener poco significado. Una de las disputas más tontas en la publicidad comercial es que entre dos compañías farmacéuticas en cuanto a si los tampones añadidos a la aspirina para combatir una reacción ácida en el estómago son un beneficio o un adulterante.
En general, si la concentración de ácido fuerte agregado a una solución tampón es y moles litro -1, la ecuación de equilibrio se convierte en
Ka =(5-44)
en el que c s y c a son las concentraciones de sal y ácido tampón, respectivamente. Después de la adición del ácido extraño, la concentración de iones de hidrógeno es
[H+] = Ka(5-45)
y el pH es
pH = pKa + log10(5-46)
Si se agrega base, se eliminan los iones hidrógeno, y se pueden usar las mismas expresiones con un valor negativo de y.
|
Se prepara un tampón de ácido fórmico con 0.010 mol litro -1 cada uno de ácido fórmico (HCOOH) y formiato de sodio (HCOONa). ¿Cuál es el pH de la solución? ¿Cuál es el pH si se agrega 0.0020 moles litro -1 de hidróxido de sodio sólido (NaOH) a un litro de tampón? ¿Cuál sería el pH de la solución de hidróxido de sodio sin tampón? ¿Cuál habría sido el pH después de agregar hidróxido de sodio si las concentraciones de tampón hubieran sido de 0.10 mol litro -1 en lugar de 0.0l0? |
||||||||||
|
Solución Las respuestas son
|
En el ejemplo anterior, se puede ver el efecto dramático del tampón de formiato en mantener la solución ácida a pesar de la base añadida, y la importancia de concentraciones de tampón razonablemente altas si no se va a exceder la capacidad de amortiguación de la solución.
Sales de Ácidos Débiles y Bases Fuertes: Hidrólisis Editar
Una solución de cloruro de sodio es neutra, con un pH de 7.0. Esto es razonable, porque el hidróxido de sodio es una base fuerte y el ácido clorhídrico es un ácido fuerte, y si se agregaran cantidades iguales de cada uno, la neutralización sería completa. En contraste, el acetato de sodio es la sal de una base fuerte y un ácido débil. Intuitivamente esperaríamos que una solución de acetato de sodio fuera algo básica, y lo es. Algunos de los iones acetato de la sal se combinan con agua para formar iones de ácido acético e hidróxido no disociados:
Ac- + H2OHAc + OH- (5-47)
Esto a veces se denomina reacción de hidrólisis, siendo la implicación que el H 2 O rompe los cristales de acetato de sodio. Lo hace, cuando el cristal de sal se disuelve en agua, pero este no es el punto. En solución el ion acetato actúa como base. Es una base Bronsted tan buena como el amoníaco, y el ion amonio es un ácido perfectamente bueno, como el HAc.
-
- NH 3 + H 2 O
 NH
NH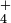 + OH -
+ OH -
- NH 3 + H 2 O
No debemos dejar que las diferentes cargas en el ion acetato (-1) y amoníaco (0) oscurezcan la similitud de su comportamiento ácido-base.
La constante de equilibrio para la hidrólisis de acetato tiene la misma forma que cualquier otra disociación de bases:
Kb =(5-48) Kb =
(5-30)
donde, como es habitual, la concentración de agua prácticamente inmutable se incorpora a la constante de equilibrio. Esta constante a veces se escribe K h para “constante de hidrólisis”, pero la nomenclatura agregada es innecesaria. Se trata de una constante de equilibrio base simple del tipo que hemos visto antes, excepto que el ion acetato es la base.
Como siempre, K b se relaciona con la constante de disociación ácida que responde, K a, por
Kb =(5-49)
(Recordemos las expresiones de equilibrio amoniaco-agua al final de la Sección 5-4.) Este valor es todo lo que necesitamos para calcular el pH de una solución de acetato de sodio.
| ¿Cuál es el pH de una solución de NaAc 0.010 M? |
|
Solución Los iones acetato de NaAc se combinan con H 2 0 para producir moléculas de HAc no disociadas e iones OH- (ecuación 5-47). La expresión de equilibrio es
Deje que la concentración de iones hidróxido sea y. Dado que cada reacción de un ion acetato con agua produce un ión hidróxido y una molécula de HAc no disociada, la concentración de cada una de las dos últimas especies debe ser molar litro -1. Los iones acetato restantes son los originalmente presentes a partir de NaAc menos los que se han combinado con agua:
y llegamos a la expresión familiar Kb = Esto es aún más fácil de resolver que los problemas débil-ácidos. Dado que la constante de equilibrio es tan pequeña, y será correspondientemente pequeña y se puede descuidar en el denominador en comparación con 0.010. El resultado es
|
(Como antes, hemos descuidado cualquier contribución a la concentración de iones de hidrógeno de las moléculas de agua. Nuestro procedimiento es lo suficientemente preciso para la mayoría de las situaciones, incluidos los propósitos de este capítulo. La derivación completa se encuentra en el Apéndice 5.)
Ácidos polipróticos: ácidos que liberan más de un ión de hidrógeno
Si el agua es el disolvente, el ácido sulfúrico, H 2 SO 4, pierde un protón como un ácido fuerte con una constante de disociación inconmensurablemente grande.
-
- H 2 SO 4 → H + + HSO

- H 2 SO 4 → H + + HSO
También puede perder un segundo protón como un ácido débil con una constante de disociación medible. Los ácidos que pueden liberar más de un protón se denominan ácidos polipróticos.
-
- HSO

 H + + SO
H + + SO K a 2 = 1.20
K a 2 = 1.20 10 -2 p K a 2 = 1.92
10 -2 p K a 2 = 1.92
- HSO
Para el ácido carbónico, H 2 C0 3, ambas disociaciones son débiles:
-
- H 2 CO 3
 H + + HCO
H + + HCO K a 1 = 4.3
K a 1 = 4.3 10 -7 p K a 1 = 6.37
10 -7 p K a 1 = 6.37 - HCO

 H + + CO
H + + CO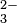 K a 2 = 5.61
K a 2 = 5.61 10 -11 p K a 2 = 10.25
10 -11 p K a 2 = 10.25
- H 2 CO 3
Los valores relativos de K a 1 y K a 2 para un ácido dado son intuitivamente razonables. Uno esperaría que HCO , que ya tiene una carga negativa, esté menos listo que el neutro H 2 C0 3 para perder otro protón.
, que ya tiene una carga negativa, esté menos listo que el neutro H 2 C0 3 para perder otro protón.
-
- El ácido fosfórico, H 3 PO 4, tiene tres disociaciones:
- H 3 PO 4
 H + + H 2 PO
H + + H 2 PO p K a 1 = 2.12
p K a 1 = 2.12 - H 2 PO

 H + + HPO
H + + HPO p K a 2 = 7.21
p K a 2 = 7.21 - HPO

 H + + PO
H + + PO p K a 3 = 12.67
p K a 3 = 12.67
Así, en una solución acuosa de ácido fosfórico habrá siete especies iónicas y moleculares presentes: H 3 PO 4, H 2 PO , HPO
, HPO , PO
, PO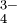 , H 2 O, H + y OH -. La vida podría parecer imposiblemente complicada, si no pudiéramos hacer algunas aproximaciones.
, H 2 O, H + y OH -. La vida podría parecer imposiblemente complicada, si no pudiéramos hacer algunas aproximaciones.
A un pH igual al p K a para una disociación particular, las dos formas de las especies disociantes están presentes en concentraciones iguales. Para la segunda disociación del ácido fosfórico, para la cual p K a 2 = 7.21,
-
-
-
- K a 2 =
![\ textstyle\ frac {[H^+] [HPO_4^ {2-}]} {[H_2PO_4^-]}](https://upload.wikimedia.org/math/5/3/2/5329c53cd739ccc318eeda1610575ce3.png)
- K a 2 =
-
- log
![\ textstyle\ frac {[HPO_4^ {2-}]} {[H_2PO_4^-]}](https://upload.wikimedia.org/math/3/8/2/38280aa1e825e29c5dda11c2dd8df6bb.png) = pH - pK a 2
= pH - pK a 2
-
Cuando pH = p K a 2, tenemos la relación
-
-
![\ textstyle\ frac {[HPO_4^ {2-}]} {[H_2PO_4^-]}](https://upload.wikimedia.org/math/3/8/2/38280aa1e825e29c5dda11c2dd8df6bb.png) = 1.00
= 1.00
-
Por lo tanto, en una solución neutra, H 2 PO y HPO
y HPO están presentes en aproximadamente las mismas concentraciones. Se encontrará muy poco H 3 PO 4 no disociado, ya que a partir de la primera constante de disociación,
están presentes en aproximadamente las mismas concentraciones. Se encontrará muy poco H 3 PO 4 no disociado, ya que a partir de la primera constante de disociación,
-
-
-
- K a 1 =
![\ textstyle\ frac {[H^+] [H_2PO_4^-]} {[H_3PO_4]}](https://upload.wikimedia.org/math/3/0/d/30d2e4c534e104521d650cae8862f78b.png)
- K a 1 =
-
- log
![\ textstyle\ frac {[H_2PO_4^-]} {[H_3PO_4]}](https://upload.wikimedia.org/math/d/a/0/da0fb5056212ccc8e2c228a287069e25.png) = pH - p K a 1 = 7.00 - 2.12 = 4.88
= pH - p K a 1 = 7.00 - 2.12 = 4.88 ![\ textstyle\ frac {[H_2PO_4^-]} {[H_3PO_4]}](https://upload.wikimedia.org/math/d/a/0/da0fb5056212ccc8e2c228a287069e25.png) = 10 4.88 = 7.6
= 10 4.88 = 7.6 10 4 = 76.000
10 4 = 76.000
-
Del mismo modo,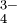 existirá poco PO:
existirá poco PO:
-
- log
![\ textstyle\ frac {[PO_4^ {3-}]} {[HPO_4^ {2-}]} =](https://upload.wikimedia.org/math/4/a/8/4a8ae9f95f42b5364d86e9b9ade008d1.png) pH - p K a 3 = 7.00 - 12.67 = -5.67
pH - p K a 3 = 7.00 - 12.67 = -5.67 ![\ textstyle\ frac {[PO_4^ {3-}]} {[HPO_4^ {2-}]} =](https://upload.wikimedia.org/math/4/a/8/4a8ae9f95f42b5364d86e9b9ade008d1.png) 10 -5.67 = 2.1
10 -5.67 = 2.1 10 -6 =
10 -6 =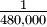
- log
Las únicas especies de fosfato que tenemos que considerar cerca de pH = 7 son H 2 PO y HPO
y HPO . De igual manera, en soluciones ácidas fuertes cercanas a pH = 3, solo
. De igual manera, en soluciones ácidas fuertes cercanas a pH = 3, solo son importantes H 3 P0 4 y H 2 P0. Siempre y cuando las pK a de disociaciones sucesivas estén separadas por tres o cuatro unidades (como casi siempre lo son), las materias se simplifican.
son importantes H 3 P0 4 y H 2 P0. Siempre y cuando las pK a de disociaciones sucesivas estén separadas por tres o cuatro unidades (como casi siempre lo son), las materias se simplifican.
Todavía hay otra simplificación. Cuando un ácido poliprótico como el ácido carbónico, H 2 CO 3, se disocia, la mayoría de los protones presentes provienen de la primera disociación:
-
- H 2 CO, sub>3
 H + + HCO
H + + HCO p K a 1 = 6.37
p K a 1 = 6.37
- H 2 CO, sub>3
Dado que la segunda constante de disociación es menor en cuatro órdenes de magnitud (y la p K a 2 más grande por cuatro unidades), la contribución de los iones de hidrógeno de la segunda disociación será solo una diezmilésima de grande. Correspondientemente, la segunda disociación tiene un efecto despreciable sobre la concentración del producto de la primera disociación, HCO .
.
|
A temperatura ambiente y 1 atm de presión de CO 2, el agua saturada en CO 2 tiene concentración de ácido carbónico de aproximadamente 0.040 mol litro -1. Calcular el pH y las concentraciones de todas las especies de carbonato para una solución 0.040 M H 2 CO 3. |
||||||||||||
|
Solución Considerando inicialmente solo la primera disociación:
De nuestra experiencia con el ácido acético, que tiene una K a aún mayor, deberíamos esperar poder descuidar y en el denominador. El grado de disociación de un ácido con una K a tan pequeña será muy pequeña:
Esta es la concentración tanto del ion hidrógeno como del ion bicarbonato, HCO
En consecuencia, las bebidas carbonatadas tienen una acidez en algún lugar entre las del vino y el jugo de tomate (ver Cuadro 5-2). Para la segunda disociación:
Dado que esta segunda disociación solo tiene un efecto menor en la primera, podemos suponer que las concentraciones de ión hidrógeno y ion bicarbonato son efectivamente las mismas:
¡Observe el resultado bastante sorprendente de que la concentración del segundo producto de disociación es igual a la segunda constante de disociación! |
|
Calcular la concentración de iones sulfuro en una solución saturada en H 2 S (0.10 mol litro -1, que se puede obtener de la aplicación de la Ley de Henry para la solubilidad de gases en agua) (a) si la solución está hecha de agua destilada y (b) si la solución se hace pH = 3.0 con HCl. Utilice los valores de K a en la Tabla 5-3. |
||||||||||||
|
Solución En agua destilada, la primera disociación es
La constante de disociación es tan pequeña que y en el denominador puede descuidarse inmediatamente. La disociación será extremadamente leve:
A partir de la segunda disociación:
Al igual que con el ejemplo de H 2 CO 3, el anión producido por la segunda disociación tiene una concentración igual a la segunda constante de disociación.
El ácido ha reprimido la disociación de H 2 S, haciendo que la concentración de iones sulfuro sea solo una centésima parte de lo que es en el agua pura. Como veremos en la siguiente sección, podemos usar ácidos para ejercer un control fino sobre la concentración de sulfuro en métodos analíticos mediante el control del pH. |
Equilibrios Con Sales Ligeras Solubles Editar
Cuando la mayoría de las sales sólidas se disuelven en agua, se disocian casi por completo en iones positivos y negativos hidratados. La solubilidad de una sal en agua representa un equilibrio entre la atracción de los iones en la red cristalina y la atracción entre estos iones y las moléculas polares de agua. Este equilibrio puede ser delicado, fácilmente cambiado al pasar de un compuesto a uno aparentemente similar, o de una temperatura a otra. No es posible dar reglas duras y rápidas sobre si un compuesto es soluble, o incluso dar cuenta de todo el comportamiento observado.
Un factor importante ciertamente es la atracción electrostática entre iones. Los cristales formados por iones pequeños que se pueden empaquetar estrechamente entre sí son generalmente más difíciles de separar que los cristales compuestos por iones grandes. Por lo tanto, para un catión dado, los fluoruros (F -) y los hidróxidos (OH-) son menos solubles que los nitratos (NO ) y los percloratos (ClO
) y los percloratos (ClO ). Los cloruros son de tamaño intermedio y su comportamiento es difícil de predecir a partir de principios generales.
). Los cloruros son de tamaño intermedio y su comportamiento es difícil de predecir a partir de principios generales.
La carga sobre los iones también es importante. Los iones más altamente cargados como los fosfatos (PO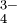 ) y los carbonatos (CO
) y los carbonatos (CO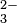 ) interactúan fuertemente con los cationes y son menos solubles que los nitratos y percloratos cargados individualmente.
) interactúan fuertemente con los cationes y son menos solubles que los nitratos y percloratos cargados individualmente.
Los términos soluble e insoluble son relativos, y el grado de solubilidad puede estar relacionado con una constante de equilibrio. Para una sal “ligeramente soluble” como el cloruro de plata, existe un equilibrio entre los iones disociados y el compuesto sólido:
AgCL(s)Ag+ + Cl- (5-51)
La expresión de equilibrio para esta reacción es
Keq =(5-52)
Mientras permanezca AgCl sólido, su efecto sobre el equilibrio no cambia. Al igual que con la concentración de H 2 O en el equilibrio de disociación de agua, la concentración de la sal sólida se puede incorporar a la constante de equilibrio:
Ksp = Keq[AgCl(s)] = [Ag+][Cl-] (5-53)
Esta nueva constante de equilibrio, K sp, se denomina constante solubilidad-producto. Para las sustancias en las que los iones no están en una relación 1:1, la forma de la expresión solubilidad-producto es análoga a nuestra expresión de equilibrio anterior:
-
-
PbCl 2 
Pb 2+ + 2Cl - K sp = [Pb 2+] [Cl -] 2 Al (OH) 3 
Al 3+ + 3OH - K sp = [Al 3+] [OH -] 3 Ag 2 CrO 4 
2Ag + + CrO 
K sp = [Ag +] + [CrO  ]
]Ba 3 (PO 4) 2 
3Ba 2+ + 2PO 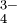
K sp = [Ba 2+] 3 [PO 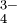 ] 2
] 2
-
Los equilibrios de solubilidad son útiles para predecir si se formará un precipitado en condiciones específicas, y en la elección de condiciones bajo las cuales dos sustancias químicas en solución pueden separarse por precipitación selectiva.
La constante solubilidad-producto de un compuesto ligeramente soluble puede calcularse a partir de su solubilidad en moles litro -1.
| La solubilidad de AgCl en agua es 0.000013 mol litro -1 a 25°C. ¿Cuál es su constante solubilidad-producto, K sp? | ||||||
|
Solución La expresión de equilibrio es
Las concentraciones de Ag + y Cl - son iguales porque por cada mol de AgCl sólido que se disuelve, se produce 1 mol de cada uno de los iones Ag + y Cl -. De ahí que la concentración de cada ion sea igual a la solubilidad global, s, del sólido en moles litro -1:
|
A cierta temperatura la solubilidad del Fe (OH) 2 en agua es 7.7 10 -6 mol litro -1. Calcular su K sp a esa temperatura. 10 -6 mol litro -1. Calcular su K sp a esa temperatura. |
|
Solución La ecuación de equilibrio es
y la expresión de solubilidad-producto es
Dado que un mol de Fe (OH) 2 disuelto produce un mol de Fe 2+ y dos moles de OH -,
|
Las constantes solubilidad-producto de una serie de sustancias se enumeran en el Cuadro 5-7. Las sustancias se agrupan por anión y se listan en el orden decreciente de K sp; los aniones se enumeran aproximadamente en el orden de solubilidad decreciente. Una vez que se conoce la constante solubilidad-producto, se puede utilizar para calcular la solubilidad de un compuesto a una temperatura especificada.

| ¿Cuál es la solubilidad del sulfato de plomo, PbS0 4, en agua a 25°C? |
|
Solución La reacción de disociación es
Dejar que la solubilidad desconocida sea s moles litro -1. Entonces, dado que cada mol de PBS0 4 disuelto produce 1 mol de cada ion,
La ecuación solubilidad-producto es
|
|
En el Cuadro 5-7 vemos que el carbonato de cadmio, CdC0 3, y el carbonato de plata, Ag 2 CO 3, tienen aproximadamente las mismas constantes solubilidad-producto. Comparar sus solubilidades molares en agua (a 25°C). |
|
Solución Para carbonato de cadmio,
Para Ag 2 CO 3 la expresión es ligeramente diferente. Si la solubilidad nuevamente es s moles litro -1, ya que cada mol de sal produce 2 moles de iones Ag +,
Aunque el carbonato de cadmio y el carbonato de plata tienen casi las mismas constantes solubilidad-producto, sus solubilidades en moles litro -1 difieren en un factor de 100 porque la forma de la expresión solubilidad-producto es diferente. La solubilidad de Ag 2 CO 3 es sensible al cuadrado de la concentración de iones metálicos, ya que son necesarios dos iones de plata por ion carbonato para construir el cristal sólido. |
Efecto Common-Ion Editar
En el ejemplo anterior, se calculó que la solubilidad del carbonato de plata en agua pura era de 1.3 10 -4 mol litro -1. ¿El carbonato de plata será más soluble o menos soluble en solución de nitrato de plata? El principio de Le Chatelier nos lleva a predecir que una nueva fuente externa de iones de plata desplazaría la reacción de equilibrio del carbonato de plata en la dirección de una menor disociación:
10 -4 mol litro -1. ¿El carbonato de plata será más soluble o menos soluble en solución de nitrato de plata? El principio de Le Chatelier nos lleva a predecir que una nueva fuente externa de iones de plata desplazaría la reacción de equilibrio del carbonato de plata en la dirección de una menor disociación:
Ag2 CO32Ag+ + CO
(5-54)
o que el carbonato de plata sería menos soluble en una solución de nitrato de plata que en agua pura. Esta disminución en la solubilidad de una sal en una solución de otra sal que tiene un catión o anión común se denomina efecto ion común.
| ¿Cuál es la solubilidad a 25°C del fluoruro de calcio, CaF 2, (a) en agua pura, (b) en cloruro de calcio 0.10 M, CaCl 2, y (c) en fluoruro de sodio 0.10 M, NaF? | |||||||||
|
Solución (a) Si la solubilidad en agua pura es s, entonces
(b) En CaCl 2 0.01 M, la concentración de iones calcio es la suma de la concentración de iones calcio del cloruro de calcio y del fluoruro de calcio, cuya solubilidad buscamos:
Se trata de una ecuación cúbica, pero el pensamiento de un momento sobre la química involucrada eliminará la necesidad de resolverla como tal. Con una constante solubilidad-producto tan pequeña, se puede predecir que la solubilidad del fluoruro de calcio será muy pequeña en comparación con 0.10 mol litro -1. (Ya debes darte cuenta de (a) y el principio de Le Chatelier de que en este problema s será menor a 2.1
Por lo tanto, se justifica la aproximación. Solo el 4.7% tanto CaF 2 se disolverá en CaCl 2 0.10 M como en agua pura:
c) En NaF 0.10 M,
ya que los iones fluoruro provienen de NaF así como de CaF 2. La ecuación solubilidad-producto es
Nuevamente, pensar en el significado químico evitará la necesidad de resolver una ecuación cúbica. El término de 2 s será muy pequeño en comparación con 0.10 mol litro -1, por lo tanto,
Esta aproximación es aún más válida que la anterior, ya que a partir del cálculo
solo 0.0019% tanto CaF 2 se disolverá en NaF 0.10 M como en agua pura. El fluoruro es más efectivo que el calcio como ión común porque tiene un efecto de segunda potencia en el equilibrio de solubilidad. |
El método de iones comunes para controlar la solubilidad a menudo se usa con soluciones de ion sulfuro, S2-, porque muchos metales forman sulfuros insolubles, y la concentración de iones sulfuro se puede controlar ajustando el pH.
| ¿Cuál es la concentración máxima posible de ion Ni 2+ en agua a 25°C que se satura con H 2 S y se mantiene a pH 3.0 con HCl? |
|
Solución A partir de la ecuación de equilibrio solubilidad-producto predecimos que demasiado ion níquel provocará la precipitación de sulfuro de níquel, NiS:
El único giro nuevo a este problema es encontrar la concentración de iones sulfuro a partir del equilibrio H 2 S. El sulfuro de hidrógeno se disocia en dos etapas, cada una con una constante de equilibrio:
Debido a que la disociación global es la suma de dos etapas de disociación, la constante de equilibrio global, K a 1.2, es el producto de K a 1 y K a 2:
El H 2 S saturado es aproximadamente 0.10 M a 25°C (que se puede obtener de la Ley de Henry para la solubilidad de los gases en agua), y el valor muy pequeño de K a 1.2 significa que la disociación de H 2 S es muy leve. De ahí que podamos escribir
en una solución saturada de H 2 S. Este “producto iónico” para H 2 S saturado es una relación útil para recordar. En este problema, el pH se ha ajustado a 3.0 con ácido clorhídrico, por lo que
Por lo tanto, la concentración de iones sulfuro se puede calcular a partir de
que da
Dado que los NIs precipitarán si se excede el producto de solubilidad, el valor más alto que puede tener la concentración de iones níquel es
|
Separación de Compuestos por Precipitación Editar
Las constantes de solubilidad-producto se pueden usar para idear métodos para separar la solución de iones por precipitación selectiva. Todo el esquema tradicional de análisis cualitativo se basa en el uso de estas constantes de equilibrio para determinar los iones precipitantes correctos y la estrategia correcta.
| Una solución es 0.010 M en cloruro de bario, BaCl 2 y 0.020 M en cloruro de estroncio, SrCl2. ¿Pueden precipitarse selectivamente Ba 2+ o Sr 2+ con sulfato de sodio concentrado, Na 2 SO 4, solución? ¿Qué ion precipitará primero? Cuando el segundo ion apenas comienza a precipitar, ¿cuál es la concentración residual del primer ion y qué fracción de la cantidad original del primer ion queda en solución? (Por simplicidad, supongamos que la solución de Na 2 SO 4 está tan concentrada que se puede descuidar el cambio de volumen en la solución de Ba-Sr). |
|
Solución El límite superior en la solubilidad del sulfato de bario viene dado por
Con 0.010 mol litro -1 de Ba 2+, la precipitación de sulfato de bario no ocurrirá hasta que la concentración de iones sulfato aumente a
El sulfato de estroncio precipitará cuando la concentración de sulfato sea
Por lo tanto, el bario precipitará primero. Cuando la concentración de sulfato ha subido a 3.8
La cantidad es
o 0.39% del Ba 2+ original presente. Así 99.6% del bario ha sido precipitado antes de que cualquier estroncio comience a precipitar. |
Resumen Editar
En este capítulo hemos aplicado los conceptos de equilibrio químico a iones en solución acuosa, especialmente a reacciones ácido-base y de precipitación. Se ha utilizado la expresión constante de equilibrio del Capítulo 4, con concentraciones expresadas en unidades de moles por litro (moles litro -1). Dado que la concentración de agua es efectivamente constante, especialmente en soluciones diluidas, hemos incorporado todos los términos de concentración de agua, [H 2 0], a las constantes de equilibrio.
El agua misma ioniza con una constante de equilibrio o ión-producto a temperatura ambiente de K w = [H +] [OH -] = 10 -14. Para evitar el inconveniente de grandes números exponenciales, se utiliza una notación de exponente negativo, donde pH = -log 10 [H +], PoH = -log 10 [OH-], y p K eq = -log 10 K eq. En esta notación, la disociación del agua puede ser representada por pH + PoH = p K w = 14. Para el agua pura, [H +] y [OH -] deben ser iguales, e iguales a 10 -7 mol litro -1, por lo que el pH y el PoH cada uno son iguales a 7. El pH es una medida conveniente de acidez, ya que en soluciones ácidas el pH es menor a 7, y en soluciones básicas es mayor a 7.
Según la teoría de Bronsted-Lowry de ácidos y bases, cualquier sustancia que renuncie a un protón es un ácido, y cualquier sustancia que pueda combinarse con un protón y eliminarlo de la solución es una base. Cuando un ácido pierde su protón, se convierte en la base conjugada. Un ácido fuerte como HCl tiene una base conjugada débil, Cl -, y un ácido débil como HAc o NH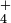 tiene una base conjugada relativamente fuerte, Ac - o NH 3. Cualquier ácido cuya base conjugada sea suficientemente más débil que H 2 O (tenga una menor afinidad por H +) se disociará completamente en solución acuosa, de ahí que se clasifique como un ácido fuerte. Los ácidos que se disocian solo parcialmente en solución acuosa son ácidos débiles.
tiene una base conjugada relativamente fuerte, Ac - o NH 3. Cualquier ácido cuya base conjugada sea suficientemente más débil que H 2 O (tenga una menor afinidad por H +) se disociará completamente en solución acuosa, de ahí que se clasifique como un ácido fuerte. Los ácidos que se disocian solo parcialmente en solución acuosa son ácidos débiles.
Los ácidos y bases fuertes son fáciles de tratar, ya que su disociación se completa en solución acuosa. Cuando se agrega un ácido fuerte al agua, el aumento en la concentración de iones de hidrógeno es igual a la concentración de ácido agregado. La neutralización ocurre cuando H + de un ácido se combina con OH - de una base para formar moléculas de agua. La cantidad de ácido presente en una muestra se puede determinar averiguando cuánta base de resistencia conocida se requiere para hacer que la solución sea neutra medida por un indicador ácido-base. Esto se llama titulación, y es un procedimiento analítico útil.
La expresión de equilibrio para un ácido débil, ecuación 5-34, se obtiene con la ayuda de dos expresiones de conservación: una ecuación de balance de masa que dice que la cantidad total de anión ácido es constante, y una ecuación de equilibrio de carga que dice que la solución debe permanecer neutra en su conjunto. Esta simple expresión puede resolverse como una ecuación cuadrática o por el método de aproximaciones sucesivas, y es válida siempre y cuando la solución sea tan ácida que se pueda descuidar la contribución a [H +] de la disociación del agua. Si no es así, entonces se debe utilizar una expresión más completa (Apéndice 5). Los indicadores ácido-base en sí mismos son ácidos débiles o bases débiles cuyas formas disociadas y no disociadas tienen diferentes colores.
Un tampón es una mezcla de un ácido débil y su sal con una base fuerte, o alternativamente, de una base débil y su sal con un ácido fuerte. El equilibrio entre la forma ácida y salina de las sustancias se desplaza para contrarrestar el efecto del ácido o base añadidos, haciendo que la solución tamponada sea resistente al cambio de pH. El pH en tales soluciones puede calcularse a partir de las ecuaciones 5-42 y 5-46.
La hidrólisis es la interacción de la sal de un ácido débil (o base débil) con el agua para formar ácido (o base) no disociado e iones OH - (o H +). Lo que a veces se describe como una constante de hidrólisis en realidad no es más que la constante de disociación para el conjugado del ácido o base débil. La constante base, K b, y la constante ácida, K a, están relacionadas por K a K b = K w.
Algunos ácidos pueden liberar más de un protón en sucesivas disociaciones. Estos se llaman ácidos polipróticos. Siempre y cuando las constantes de disociación sucesivas, K 1, K 2, y así sucesivamente, difieran por factores de 10 -4 o 10 -5, las disociaciones sucesivas pueden tratarse como eventos separados.
La mayoría de los comentarios generales recién hechos sobre la solución de problemas de equilibrio ácido-base son aplicables a los equilibrios de solubilidad, para situaciones en las que los iones se combinan para formar una sal insoluble. Los cálculos de solubilidad-producto son más útiles para indicar si la precipitación ocurrirá bajo ciertas condiciones, cuál puede ser el límite superior de concentración de un ion en solución y si dos iones pueden separarse en solución por precipitación selectiva.



 6.3
6.3![\ textstyle\ frac {k_w} {[OH^-]} =\ frac {10^ {-14}} {0.0050} =](https://upload.wikimedia.org/math/3/4/0/340e010d24433ba942e9edb709162219.png) 2.0
2.0
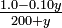 = 10 -4
= 10 -4 0.053 m moles ml -1 o mol litro -1
0.053 m moles ml -1 o mol litro -1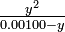

 12.4%
12.4% (de la ecuación 5-42)
(de la ecuación 5-42) 3.52
3.52 3.48
3.48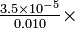 100 = 0.35%
100 = 0.35%![\ textstyle\ frac {[H^+] [Ac^-]} {[HaC]} =\ frac {y (0.050)} {(0.050)}](https://upload.wikimedia.org/math/e/d/e/ede609165664bce5f238319d62d5060b.png)
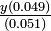
 1.83
1.83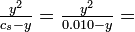 5.68
5.68 ![\ textstyle\ frac {k_w} {[OH^-]} =\ frac {10^ {-14}} {2.4\ veces 10^ {-6}}](https://upload.wikimedia.org/math/4/e/1/4e1a4a726bc3b30e45052a6a3b272184.png) = 4.2
= 4.2 en el que y = [H^+]
en el que y = [H^+]![\ textstyle\ frac {[H^+] [CO_3^ {2-}]} {[HCO_3^-]}](https://upload.wikimedia.org/math/f/4/2/f4216beaea2019904ed06cc660228366.png)
![\ textstyle\ frac {[HCO_3^-]} {[H^+]}\ veces](https://upload.wikimedia.org/math/c/f/a/cfa94ccdc702c926067a2a00491ce2af.png) K a 2 = K a 2 = 5.6
K a 2 = K a 2 = 5.6
![\ textstyle\ frac {[HS^-]} {[H^+]}\ veces](https://upload.wikimedia.org/math/7/0/5/705734bb0bbb1ade0c494d0d8eaf1158.png) K a 2 = K a 2 = 1.1
K a 2 = K a 2 = 1.1![\ textstyle\ frac {[H^+] [HS^-]} {[H_2S]} =\ frac {1.0\ veces 10^ {-3} [HS^-]} {0.10} =](https://upload.wikimedia.org/math/a/e/1/ae152bb34d5afa5fa506a43e2ab4565c.png) 9.1
9.1![\ textstyle\ frac {[H^+] [S^ {2-}]} {[HS^-]} =\ frac {1.0\ veces 10^ {-3} [S^ {2-}]} {9.1\ veces 10^ {-6}}](https://upload.wikimedia.org/math/5/d/c/5dc2c25e52284f3f2917e11f40325947.png) = 1.1
= 1.1 1.0
1.0 = 9.75
= 9.75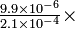 100 = 4.7%
100 = 4.7%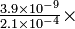 100 = 0.0019%
100 = 0.0019%![\ textstyle\ frac {[H^+] [HS^-]} {[H_2S]}\ veces\ frac {[H^+] [S^ {2-}]} {[HS^-]} =\ frac {[H^+] ^2 [S^ {2-}]} {[H_2S]}](https://upload.wikimedia.org/math/8/4/7/8472f7f2fa28040526d72d9870d745ef.png)
![\ times\ textstyle\ frac {[H_2S]} {[H^+] ^2} =](https://upload.wikimedia.org/math/5/c/b/5cb722e7b4943dc716a3104f94f10625.png) 1.0
1.0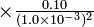
 = 3
= 3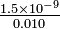 = 1.5
= 1.5![\ textstyle\ frac {K_ {sp (srSO_4)}} {[Sr^ {2+}]} =\ frac {7.6\ times 10^ {-7}} {0.020} =](https://upload.wikimedia.org/math/c/8/d/c8dc0fe7daa3d0005a9899644663b342.png) 3.8
3.8 = = 3.9
= = 3.9 100 = 0.39%
100 = 0.39%