3.5: Variaciones periódicas en las propiedades del elemento
- Page ID
- 77611
- Describir y explicar las tendencias observadas en el tamaño atómico, la energía de ionización y la afinidad electrónica de los elementos
Los elementos en grupos (columnas verticales) de la tabla periódica presentan un comportamiento químico similar. Esta similitud ocurre porque los miembros de un grupo tienen el mismo número y distribución de electrones en sus conchas de valencia. Sin embargo, también hay otros patrones en las propiedades químicas en la tabla periódica. Por ejemplo, a medida que bajamos un grupo, aumenta el carácter metálico de los átomos. El oxígeno, en la parte superior del Grupo 16 (6A), es un gas incoloro; en la mitad del grupo, el selenio es un sólido semiconductor; y, hacia el fondo, el polonio es un sólido gris plateado que conduce la electricidad.
A medida que atravesamos un periodo de izquierda a derecha, agregamos un protón al núcleo y un electrón a la concha de valencia con cada elemento sucesivo. A medida que bajamos los elementos en un grupo, el número de electrones en la capa de valencia permanece constante, pero el número cuántico principal aumenta en uno cada vez. La comprensión de la estructura electrónica de los elementos nos permite examinar algunas de las propiedades que rigen su comportamiento químico. Estas propiedades varían periódicamente a medida que cambia la estructura electrónica de los elementos. Son (1) tamaño (radio) de átomos e iones, (2) energías de ionización y (3) afinidades electrónicas.
Variación en el Radio Covalente
El cuadro mecánico cuántico dificulta establecer un tamaño definido de un átomo. Sin embargo, existen varias formas prácticas de definir el radio de los átomos y, así, determinar sus tamaños relativos que dan valores más o menos similares. Utilizaremos el radio covalente (Figura\(\PageIndex{1}\)), que se define como la mitad de la distancia entre los núcleos de dos átomos idénticos cuando están unidos por un enlace covalente (esta medición es posible porque los átomos dentro de las moléculas aún conservan gran parte de su identidad atómica).
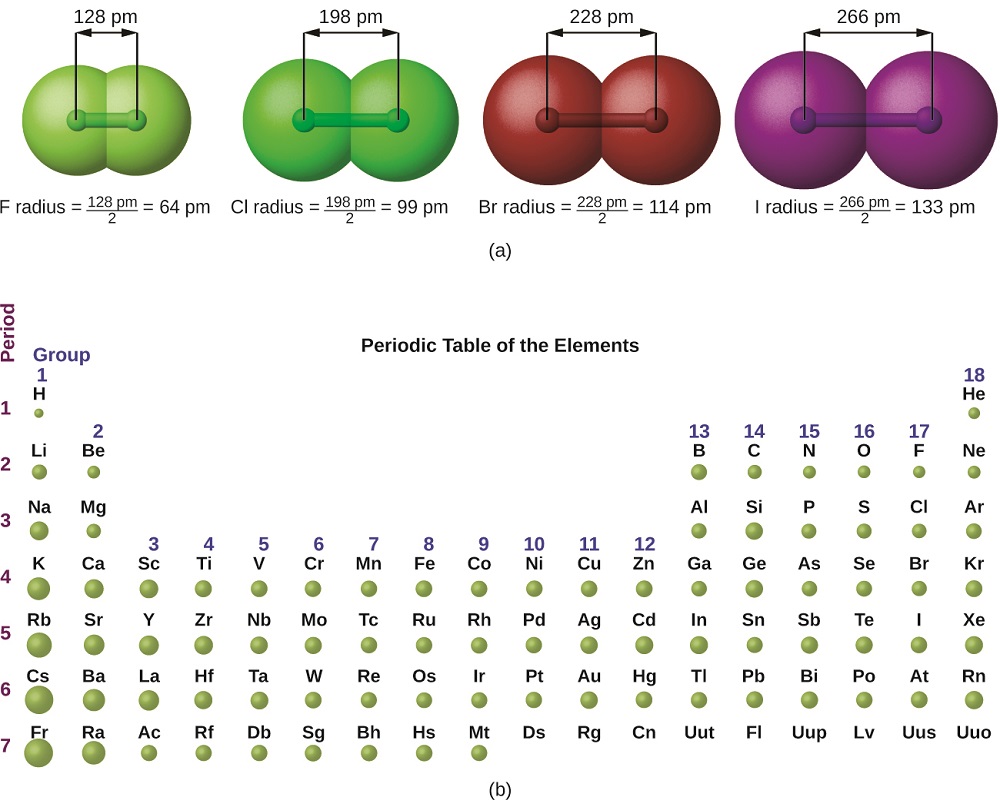
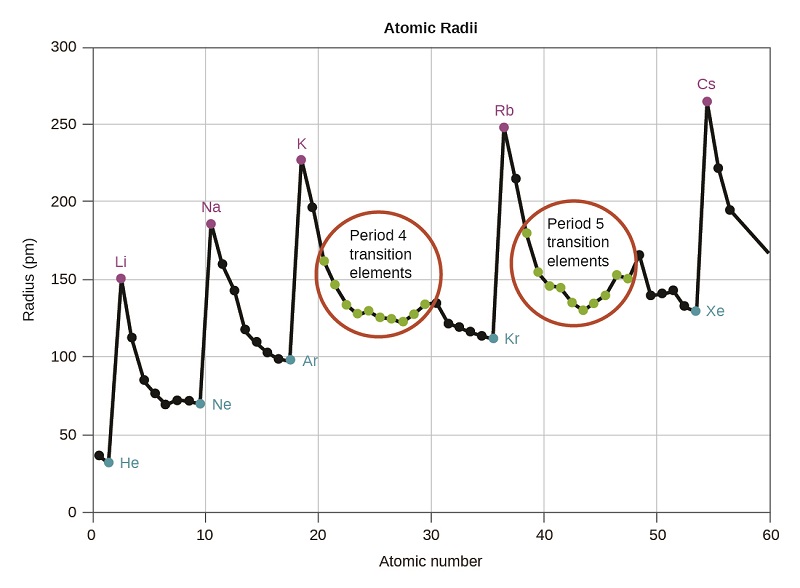
Sabemos que a medida que escaneamos un grupo, el número cuántico principal, n, aumenta en uno por cada elemento. Así, los electrones se están sumando a una región del espacio cada vez más distante del núcleo. En consecuencia, el tamaño del átomo (y su radio covalente) debe aumentar a medida que aumentamos la distancia de los electrones más externos desde el núcleo. Esta tendencia se ilustra para los radios covalentes de los halógenos en la Tabla\(\PageIndex{1}\) y Figura\(\PageIndex{1}\). Las tendencias para toda la tabla periódica se pueden ver en la Figura\(\PageIndex{2}\).
| Atom | Radio covalente (pm) | Carga nuclear |
|---|---|---|
| F | 64 | +9 |
| Cl | 99 | +17 |
| Br | 114 | +35 |
| I | 133 | +53 |
| En | 148 | +85 |
Como se muestra en la Figura\(\PageIndex{2}\), a medida que nos movemos a través de un periodo de izquierda a derecha, generalmente encontramos que cada elemento tiene un radio covalente menor que el elemento que lo precede. Esto puede parecer contrario a la intuición porque implica que los átomos con más electrones tienen un radio atómico más pequeño. Esto se puede explicar con el concepto de carga nuclear efectiva e,\(Z_{eff}\). Esta es la atracción ejercida sobre un electrón específico por el núcleo, teniendo en cuenta cualquier repulsión electrón-electrón. Para el hidrógeno, solo hay un electrón y así la carga nuclear (Z) y la carga nuclear efectiva (Z eff) son iguales. Para todos los demás átomos, los electrones internos protegen parcialmente a los electrones externos de la tracción del núcleo, y así:
\[Z_\ce{eff}=Z−shielding \nonumber \]
El blindaje está determinado por la probabilidad de que otro electrón esté entre el electrón de interés y el núcleo, así como por las repulsiones electrón-electrón que encuentra el electrón de interés. Los electrones centrales son expertos en el blindaje, mientras que los electrones en la misma capa de valencia no bloquean la atracción nuclear experimentada por los demás de manera tan eficiente. Así, cada vez que pasamos de un elemento al siguiente a lo largo de un periodo, Z aumenta en uno, pero el blindaje aumenta solo ligeramente. Así, Z eff aumenta a medida que avanzamos de izquierda a derecha a lo largo de un periodo. La atracción más fuerte (mayor carga nuclear efectiva) que experimentan los electrones en el lado derecho de la tabla periódica los acerca al núcleo, haciendo que los radios covalentes sean más pequeños.
Así, como cabría esperar, los electrones más externos o de valencia son más fáciles de eliminar porque tienen las energías más altas, están más protegidos, y están más alejados del núcleo. Como regla general, cuando los elementos representativos forman cationes, lo hacen por la pérdida de los electrones ns o np que se agregaron últimos en el proceso de Aufbau. Los elementos de transición, en cambio, pierden los electrones ns antes de que comiencen a perder los (n — 1) d electrones, aunque los electrones ns se agregan primero, según el principio Aufbau.
Predecir el orden de aumento del radio covalente para Ge, Fl, Br, Kr.
Solución
El radio aumenta a medida que bajamos un grupo, por lo que Ge < Fl (Nota: Fl es el símbolo para flerovio, elemento 114, NO flúor). El radio disminuye a medida que nos movemos a través de un periodo, por lo que Kr < Br Armando las tendencias, obtenemos Kr < Br < Ge < Fl.
Dar un ejemplo de un átomo cuyo tamaño es menor que el flúor.
- Contestar
-
Ne o Él
Variación en Radios Iónicos
El radio iónico es la medida utilizada para describir el tamaño de un ion. Un catión siempre tiene menos electrones y el mismo número de protones que el átomo parental; es menor que el átomo del que se deriva (Figura\(\PageIndex{3}\)). Por ejemplo, el radio covalente de un átomo de aluminio (1 s 2 2 s 2 2 p 6 3 s 2 3 p 1) es 118pm, mientras que el radio iónico de un Al 3 + (1 s 2 2 s 2 2 p 6) es 68 pm. A medida que los electrones se eliminan de la capa de valencia externa, los electrones centrales restantes que ocupan conchas más pequeñas experimentan una mayor carga nuclear efectiva Z eff (como se discutió) y se acercan aún más al núcleo.

Los cationes con cargas más grandes son más pequeños que los cationes con cargas más pequeñas (por ejemplo, V 2+ tiene un radio iónico de 79 pm, mientras que el de V 3+ es de 64 pm). Continuando por los grupos de la tabla periódica, encontramos que los cationes de elementos sucesivos con la misma carga generalmente tienen radios mayores, lo que corresponde a un incremento en el número cuántico principal, n.
Un anión (ion negativo) se forma por la adición de uno o más electrones a la capa de valencia de un átomo. Esto da como resultado una mayor repulsión entre los electrones y una disminución en\(Z_{eff}\) por electrón. Ambos efectos (el aumento del número de electrones y la disminución de Z eff) hacen que el radio de un anión sea mayor que el del átomo parental (Figura\(\PageIndex{3}\)). Por ejemplo, un átomo de azufre ([Ne] 3 s 2 3 p 4) tiene un radio covalente de 104pm, mientras que el radio iónico del anión sulfuro ([Ne] 3 s 2 3 p 6) es de 170pm. Para los elementos consecutivos que descienden por cualquier grupo, los aniones tienen números cuánticos principales mayores y, por lo tanto, radios más grandes.
Se dice que los átomos e iones que tienen la misma configuración electrónica son isoelectrónicos. Ejemplos de especies isoelectrónicas son N 3—, O 2—, F —, Ne, Na +, Mg 2 + y Al 3 + (1 s 2 2 s 2 p 6). Otra serie isoelectrónica es P 3—, S 2—, Cl —, Ar, K +, Ca 2 +, y Sc 3 + ([Ne] 3 s 2 3 p 6). Para los átomos o iones que son isoelectrónicos, el número de protones determina el tamaño. Cuanto mayor es la carga nuclear, menor es el radio en una serie de iones y átomos isoelectrónicos.
Variación en las energías de ionización
La cantidad de energía requerida para eliminar el electrón más libremente unido de un átomo gaseoso en su estado fundamental se llama su primera energía de ionización (IE 1). La primera energía de ionización para un elemento, X, es la energía requerida para formar un catión con +1 carga:
\[\ce{X}(g)⟶\ce{X+}(g)+\ce{e-}\hspace{20px}\ce{IE_1} \nonumber \]
La energía requerida para eliminar el segundo electrón más libremente unido se llama la segunda energía de ionización (IE 2).
\[\ce{X+}(g)⟶\ce{X^2+}(g)+\ce{e-}\hspace{20px}\ce{IE_2} \nonumber \]
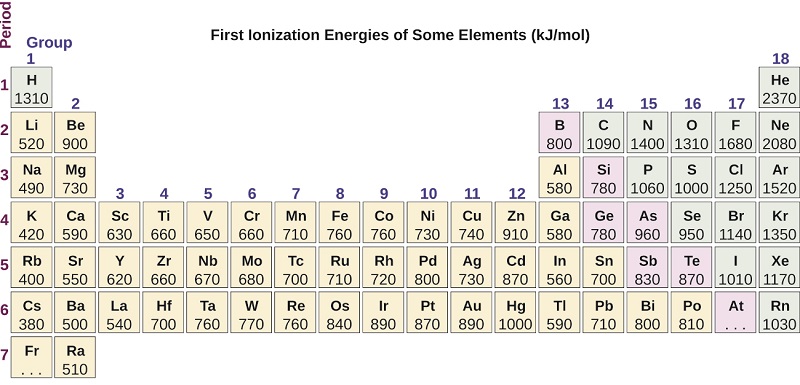
La energía requerida para eliminar el tercer electrón es la tercera energía de ionización, y así sucesivamente. Siempre se requiere energía para eliminar electrones de átomos o iones, por lo que los procesos de ionización son endotérmicos y los valores de IE siempre son positivos. Para átomos más grandes, el electrón más libremente unido se encuentra más lejos del núcleo y por lo tanto es más fácil de eliminar. Así, a medida que aumenta el tamaño (radio atómico), la energía de ionización debería disminuir. Al relacionar esta lógica con lo que acabamos de aprender sobre los radios, esperaríamos que las primeras energías de ionización disminuyeran en un grupo y aumentaran a lo largo de un periodo.
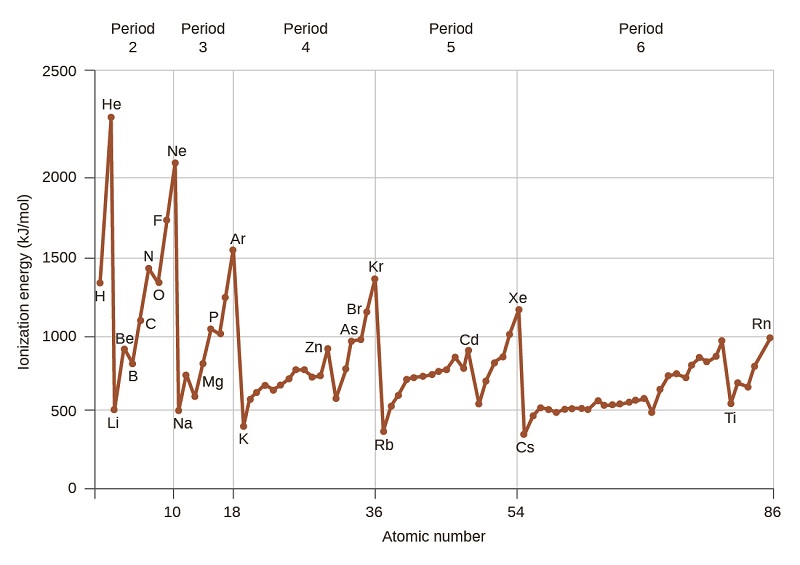
La figura\(\PageIndex{4}\) grafica la relación entre la primera energía de ionización y el número atómico de varios elementos. Dentro de un periodo, los valores de la primera energía de ionización para los elementos (IE 1) generalmente aumentan con Z creciente. Abajo de un grupo, el valor de IE 1 generalmente disminuye con Z creciente. Sin embargo, hay algunas desviaciones sistemáticas de esta tendencia. Nótese que la energía de ionización del boro (número atómico 5) es menor que la del berilio (número atómico 4) a pesar de que la carga nuclear del boro es mayor en un protón. Esto se puede explicar porque la energía de las subconchas aumenta a medida que aumenta l, debido a la penetración y blindaje (como se discutió anteriormente en este capítulo). Dentro de cualquier caparazón, los electrones s son más bajos en energía que los electrones p. Esto significa que un electrón s es más difícil de eliminar de un átomo que un electrón p en la misma concha. El electrón eliminado durante la ionización del berilio ([He] 2 s 2) es un electrón s, mientras que el electrón eliminado durante la ionización del boro ([He] 2 s 2 2 p 1) es un electrón p; esto da como resultado un menor energía de primera ionización para el boro, a pesar de que su carga nuclear es mayor en un protón. Así, vemos una pequeña desviación de la tendencia predicha que ocurre cada vez que comienza un nuevo subshell.
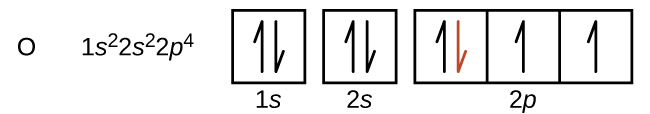
Otra desviación ocurre a medida que los orbitales se llenan más de la mitad. La primera energía de ionización para el oxígeno es ligeramente menor que la del nitrógeno, a pesar de la tendencia al aumento de los valores de IE 1 a lo largo de un periodo. Al observar el diagrama orbital del oxígeno, podemos ver que la eliminación de un electrón eliminará la repulsión electron—electrón causada por el emparejamiento de los electrones en el orbital 2p y dará como resultado un orbital medio lleno (que es energéticamente favorable). Cambios análogos ocurren en períodos sucesivos (nótese la caída para azufre después del fósforo en la Figura\(\PageIndex{4}\).
Eliminar un electrón de un catión es más difícil que eliminar un electrón de un átomo neutro debido a la mayor atracción electrostática hacia el catión. De igual manera, eliminar un electrón de un catión con una carga positiva más alta es más difícil que eliminar un electrón de un ion con una carga menor. Así, las sucesivas energías de ionización para un elemento siempre aumentan. Como se ve en la Tabla\(\PageIndex{2}\), hay un gran incremento en las energías de ionización (cambio de color) para cada elemento. Este salto corresponde a la eliminación de los electrones centrales, que son más difíciles de eliminar que los electrones de valencia. Por ejemplo, Sc y Ga tienen ambos tres electrones de valencia, por lo que el rápido aumento de la energía de ionización ocurre después de la tercera ionización.
| Element | IE 1 | IE 2 | IE 3 | IE 4 | IE 5 | IE 6 | IE 7 |
|---|---|---|---|---|---|---|---|
| K | 418.8 | 3051.8 | 4419.6 | 5876.9 | 7975.5 | 9590.6 | 11343 |
| Ca | 589.8 | 1145.4 | 4912.4 | 6490.6 | 8153.0 | 10495.7 | 12272.9 |
| Sc | 633.1 | 1235.0 | 2388.7 | 7090.6 | 8842.9 | 10679.0 | 13315.0 |
| Ga | 578.8 | 1979.4 | 2964.6 | 6180 | 8298.7 | 10873.9 | 13594.8 |
| Ge | 762.2 | 1537.5 | 3302.1 | 4410.6 | 9021.4 | No disponible | No disponible |
| Como | 944.5 | 1793.6 | 2735.5 | 4836.8 | 6042.9 | 12311.5 | No disponible |
Predecir el orden de aumento de energía para los siguientes procesos: IE 1 para Al, IE 1 para Tl, IE 2 para Na, IE 3 para Al.
Solución
Eliminar el electrón 6 p 1 de Tl es más fácil que eliminar el electrón 3 p 1 de Al porque el orbital n superior está más alejado del núcleo, por lo que IE 1 (Tl) < IE 1 (Al). Ionizar el tercer electrón de
\[\ce{Al}\hspace{20px}\ce{(Al^2+⟶Al^3+ + e- )} \nonumber \]
requiere más energía porque el catión Al 2 + ejerce una atracción más fuerte sobre el electrón que el átomo de Al neutro, por lo que IE 1 (Al) < IE 3 (Al). La segunda energía de ionización para el sodio elimina un electrón central, que es un proceso de energía mucho mayor que la eliminación de electrones de valencia. Armando todo esto, obtenemos:
IE 1 (Tl) < IE 1 (Al) < IE 3 (Al) < IE 2 (Na).
¿Cuál tiene el valor más bajo para IE 1: O, Po, Pb o Ba?
- Contestar
-
Ba
Variación en las afinidades de electrones
La afinidad electrónica [EA] es el cambio de energía para el proceso de adición de un electrón a un átomo gaseoso para formar un anión (ion negativo).
\[\ce{X}(g)+\ce{e-}⟶\ce{X-}(g)\hspace{20px}\ce{EA_1} \nonumber \]
Este proceso puede ser endotérmico o exotérmico, dependiendo del elemento. El EA de algunos de los elementos se da en la Figura\(\PageIndex{6}\). Se puede ver que muchos de estos elementos tienen valores negativos de EA, lo que significa que la energía se libera cuando el átomo gaseoso acepta un electrón. Sin embargo, para algunos elementos, se requiere energía para que el átomo se cargue negativamente y el valor de su EA sea positivo. Al igual que con la energía de ionización, los valores de EA posteriores se asocian con la formación de iones con más carga. El segundo EA es la energía asociada con la adición de un electrón a un anión para formar un ion —2, y así sucesivamente.

Como podríamos predecir, se vuelve más fácil agregar un electrón a través de una serie de átomos a medida que aumenta la carga nuclear efectiva de los átomos. Encontramos, a medida que avanzamos de izquierda a derecha a lo largo de un período, los EA tienden a volverse más negativos. Las excepciones encontradas entre los elementos del grupo 2 (2A), grupo 15 (5A) y grupo 18 (8A) se pueden entender en base a la estructura electrónica de estos grupos. Los gases nobles, grupo 18 (8A), tienen una cáscara completamente llena y el electrón entrante debe agregarse a un nivel de n más alto, lo cual es más difícil de hacer. El grupo 2 (2A) tiene una subcapa ns llena, y así el siguiente electrón agregado entra en la energía más alta np, por lo que, nuevamente, el valor de EA observado no es como la tendencia predeciría. Finalmente, el grupo 15 (5A) tiene una subcapa np medio llena y el siguiente electrón debe emparejarse con un electrón np existente. En todos estos casos, la estabilidad relativa inicial de la configuración electrónica interrumpe la tendencia en EA.
También podríamos esperar que el átomo en la parte superior de cada grupo tenga el EA más grande; sus primeros potenciales de ionización sugieren que estos átomos tienen las mayores cargas nucleares efectivas. No obstante, a medida que bajamos un grupo, vemos que el segundo elemento del grupo suele tener el mayor EA. La reducción de la EA del primer miembro se puede atribuir al pequeño tamaño del caparazón n = 2 y a las grandes repulsiones electrones-electrones resultantes. Por ejemplo, el cloro, con un valor EA de —348 kJ/mol, tiene el valor más alto de cualquier elemento de la tabla periódica. El EA de flúor es —322 kJ/mol. Cuando agregamos un electrón a un átomo de flúor para formar un anión fluoruro (F —), agregamos un electrón a la cáscara n = 2. El electrón es atraído hacia el núcleo, pero también hay una repulsión significativa de los otros electrones ya presentes en esta pequeña concha de valencia. El átomo de cloro tiene la misma configuración electrónica en la capa de valencia, pero debido a que el electrón entrante va a entrar en el caparazón n = 3, ocupa una región de espacio considerablemente mayor y las repulsiones electrón-electrón se reducen. El electrón entrante no experimenta tanta repulsión y el átomo de cloro acepta un electrón adicional más fácilmente.
Las propiedades discutidas en esta sección (tamaño de átomos e iones, carga nuclear efectiva, energías de ionización y afinidades electrónicas) son fundamentales para comprender la reactividad química. Por ejemplo, debido a que el flúor tiene un EA energéticamente favorable y una gran barrera energética a la ionización (IE), es mucho más fácil formar aniones flúor que cationes. Las propiedades metálicas que incluyen conductividad y maleabilidad (la capacidad de formarse en láminas) dependen de tener electrones que se puedan eliminar fácilmente. Así, el carácter metálico aumenta a medida que bajamos un grupo y disminuye a lo largo de un periodo en la misma tendencia observada para el tamaño atómico porque es más fácil eliminar un electrón que está más lejos del núcleo.
Resumen
Las configuraciones de electrones nos permiten comprender muchas tendencias periódicas. El radio covalente aumenta a medida que bajamos de un grupo debido a que aumenta el nivel n (tamaño orbital). El radio covalente disminuye principalmente a medida que nos movemos de izquierda a derecha a lo largo de un período debido a que la carga nuclear efectiva experimentada por los electrones aumenta, y los electrones son arrastrados más apretados hacia el núcleo. Los radios aniónicos son más grandes que el átomo parental, mientras que los radios catiónicos son más pequeños, debido a que el número de electrones de valencia ha cambiado mientras que la carga nuclear se ha mantenido constante. La energía de ionización (la energía asociada con la formación de un catión) disminuye en un grupo y en su mayoría aumenta a lo largo de un período porque es más fácil eliminar un electrón de una órbita más grande y de mayor energía. La afinidad electrónica (la energía asociada con la formación de un anión) es más favorable (exotérmica) cuando los electrones se colocan en orbitales de menor energía, más cerca del núcleo. Por lo tanto, la afinidad electrónica se vuelve cada vez más negativa a medida que nos movemos de izquierda a derecha a través de la tabla periódica y disminuye a medida que bajamos Tanto para los datos de IE como de afinidad electrónica, existen excepciones a las tendencias cuando se trata de subconchas completamente llenas o semillenas.
Glosario
- radio covalente
- la mitad de la distancia entre los núcleos de dos átomos idénticos cuando están unidos por un enlace covalente
- carga nuclear efectiva
- carga que conduce a la fuerza Coulomb ejercida por el núcleo sobre un electrón, calculada como la carga nuclear menos blindaje
- afinidad de electrones
- energía requerida para añadir un electrón a un átomo gaseoso para formar un anión
- energía de ionización
- energía requerida para eliminar un electrón de un átomo o ion gaseoso. El número asociado (por ejemplo, segunda energía de ionización) corresponde a la carga del ion producido (X 2+)
- isoelectrónico
- grupo de iones o átomos que tienen configuraciones electrónicas idénticas


