6.1: Fórmula Masa y el Concepto Mole
- Page ID
- 77516
- Calcular masas de fórmula para compuestos covalentes e iónicos
- Definir la cantidad unidad mol y la cantidad relacionada con el número de Avogadro
- Explicar la relación entre la masa, los moles y el número de átomos o moléculas, y realizar cálculos que deriven estas cantidades entre sí
Podemos argumentar que la ciencia química moderna comenzó cuando los científicos comenzaron a explorar los aspectos cuantitativos y cualitativos de la química. Por ejemplo, la teoría atómica de Dalton fue un intento de explicar los resultados de mediciones que le permitieron calcular las masas relativas de elementos combinados en diversos compuestos. Comprender la relación entre las masas de átomos y las fórmulas químicas de los compuestos permite describir cuantitativamente la composición de las sustancias.
Masa de Fórmula
En un capítulo anterior describimos el desarrollo de la unidad de masa atómica, el concepto de masas atómicas promedio y el uso de fórmulas químicas para representar la composición elemental de sustancias. Estas ideas pueden extenderse para calcular la masa de fórmula de una sustancia sumando las masas atómicas promedio de todos los átomos representados en la fórmula de la sustancia.
Masa de Fórmula para Sustancias Covalentes
Para las sustancias covalentes, la fórmula representa los números y tipos de átomos que componen una sola molécula de la sustancia; por lo tanto, la masa de fórmula puede denominarse correctamente masa molecular. Considere el cloroformo (CHCl 3), un compuesto covalente que alguna vez se usó como anestésico quirúrgico y que ahora se usó principalmente en la producción de tetrafluoroetileno, el bloque de construcción del polímero “antiadherente”, el teflón. La fórmula molecular del cloroformo indica que una sola molécula contiene un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro. La masa molecular promedio de una molécula de cloroformo es, por lo tanto, igual a la suma de las masas atómicas promedio de estos átomos. La figura\(\PageIndex{1}\) resume los cálculos utilizados para derivar la masa molecular del cloroformo, que es de 119.37 amu.
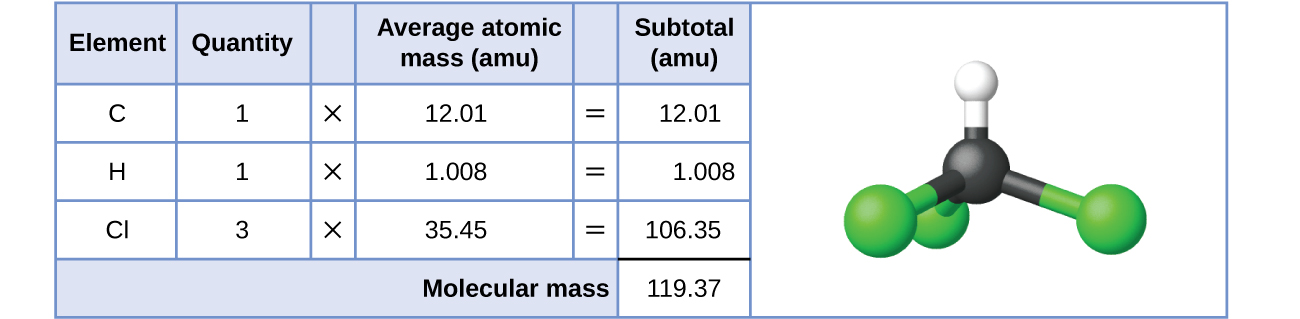
Asimismo, la masa molecular de una molécula de aspirina, C 9 H 8 O 4, es la suma de las masas atómicas de nueve átomos de carbono, ocho átomos de hidrógeno y cuatro átomos de oxígeno, que asciende a 180.15 amu (Figura\(\PageIndex{2}\)).
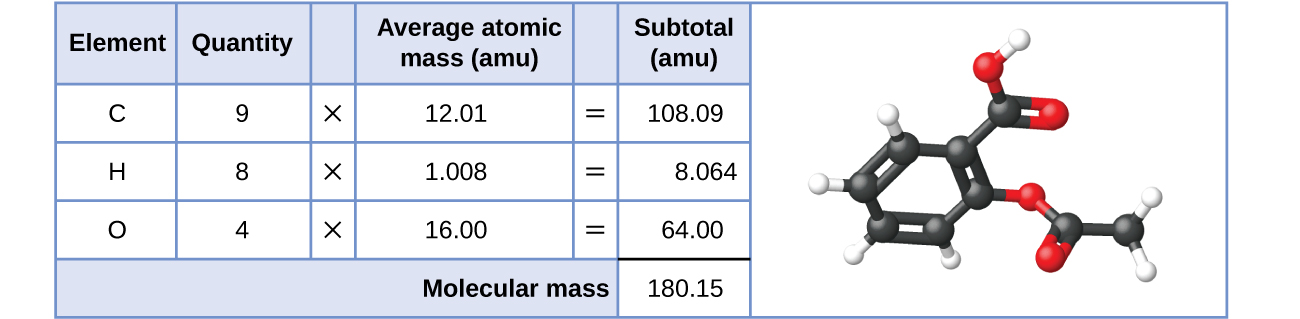
 Figura
Figura

