10.3: Transiciones de fase
- Page ID
- 77428
- Definir transiciones de fase y temperaturas de transición de fase
- Explicar la relación entre las temperaturas de transición de fase y las fuerzas de atracción intermoleculares
- Describir los procesos representados por las curvas típicas de calentamiento y enfriamiento, y calcular los flujos de calor y los cambios de entalpía que acompañan a estos procesos
Somos testigos y utilizamos cambios de estado físico, o transiciones de fase, de muchas maneras. Como un ejemplo de importancia global, considere la evaporación, condensación, congelación y fusión del agua. Estos cambios de estado son aspectos esenciales del ciclo hídrico de nuestra tierra así como muchos otros fenómenos naturales y procesos tecnológicos de importancia central para nuestras vidas. En este módulo se exploran los aspectos esenciales de las transiciones de fase.
Vaporización y Condensación
Cuando un líquido se vaporiza en un recipiente cerrado, las moléculas de gas no pueden escapar. A medida que estas moléculas en fase gaseosa se mueven aleatoriamente, ocasionalmente colisionarán con la superficie de la fase condensada, y en algunos casos, estas colisiones darán como resultado que las moléculas vuelvan a entrar en la fase condensada. El cambio de la fase gaseosa al líquido se llama condensación. Cuando la velocidad de condensación se vuelve igual a la velocidad de vaporización, ni la cantidad de líquido ni la cantidad de vapor en el recipiente cambian. Entonces se dice que el vapor en el recipiente está en equilibrio con el líquido. Tenga en cuenta que esta no es una situación estática, ya que las moléculas se intercambian continuamente entre las fases condensada y gaseosa. Tal es un ejemplo de un equilibrio dinámico, el estado de un sistema en el que los procesos recíprocos (por ejemplo, vaporización y condensación) ocurren a tasas iguales. La presión ejercida por el vapor en equilibrio con un líquido en un recipiente cerrado a una temperatura dada se denomina presión de vapor del líquido (o presión de vapor de equilibrio). El área de la superficie del líquido en contacto con un vapor y el tamaño del recipiente no tienen ningún efecto sobre la presión de vapor, aunque sí afectan el tiempo requerido para que se alcance el equilibrio. Podemos medir la presión de vapor de un líquido colocando una muestra en un recipiente cerrado, como el ilustrado en la Figura\(\PageIndex{1}\), y usando un manómetro para medir el aumento de presión que se debe al vapor en equilibrio con la fase condensada.
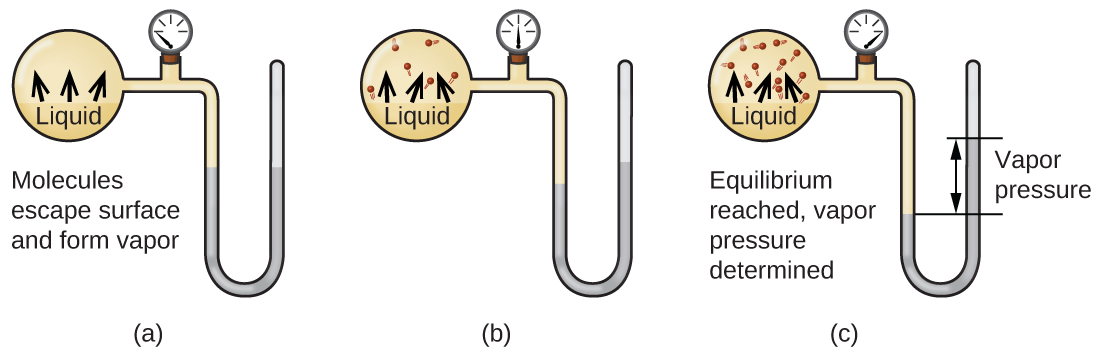
Las identidades químicas de las moléculas en un líquido determinan los tipos (y fortalezas) de atracciones intermoleculares posibles; en consecuencia, diferentes sustancias exhibirán diferentes presiones de vapor de equilibrio. Las fuerzas de atracción intermolecular relativamente fuertes servirán para impedir la vaporización así como favorecer la “recaptura” de moléculas en fase gaseosa cuando chocan con la superficie del líquido, resultando en una presión de vapor relativamente baja. Las débiles atracciones intermoleculares presentan menos barrera a la vaporización y una menor probabilidad de recaptura de gas, produciendo presiones de vapor relativamente altas. El siguiente ejemplo ilustra esta dependencia de la presión de vapor de las fuerzas de atracción intermoleculares.
Dadas las fórmulas estructurales mostradas para estos cuatro compuestos, explicar sus presiones de vapor relativas en términos de tipos y extensiones de IMF:
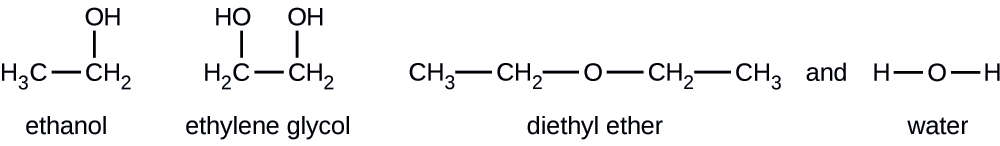
Solución
El éter dietílico tiene un dipolo muy pequeño y la mayoría de sus atractivos intermoleculares son las fuerzas londinenses. Si bien esta molécula es la más grande de las cuatro bajo consideración, sus IMF son las más débiles y, como resultado, sus moléculas escapan más fácilmente del líquido. También tiene la presión de vapor más alta. Debido a su menor tamaño, el etanol exhibe fuerzas de dispersión más débiles que el éter dietílico. Sin embargo, el etanol es capaz de formar enlaces de hidrógeno y, por lo tanto, exhibe IMF globales más fuertes, lo que significa que menos moléculas escapan del líquido a cualquier temperatura dada, y así el etanol tiene una presión de vapor más baja que el éter dietílico. El agua es mucho más pequeña que cualquiera de las sustancias anteriores y exhibe fuerzas de dispersión más débiles, pero su extenso enlace de hidrógeno proporciona atracciones intermoleculares más fuertes, menos moléculas que escapan del líquido y una presión de vapor más baja que para el éter dietílico o el etanol. El etilenglicol tiene dos grupos −OH, por lo que, al igual que el agua, exhibe extensos enlaces de hidrógeno. Es mucho más grande que el agua y por lo tanto experimenta fuerzas más grandes de Londres. Sus IMF generales son las más grandes de estas cuatro sustancias, lo que significa que su velocidad de vaporización será la más lenta y, en consecuencia, su presión de vapor la más baja.


