18.2: Metales del Grupo 1A
- Page ID
- 73200
Li, Na, K, Rb y Cs son todos elementos del grupo IA, también conocidos como metales alcalinos. El séptimo miembro del grupo, el francium (Fr) es radiactivo y tan raro que solo 20 átomos de Fr pueden existir en la Tierra en un momento dado [1]. El término álcali se deriva de una palabra árabe que significa “cenizas”. Los compuestos de potasio y otros metales alcalinos fueron obtenidos de cenizas de madera por químicos tempranos. Todos los metales alcalinos son blandos y, a excepción del Cs que es amarillo, son de color gris plateado.
El litio, el sodio, el potasio, el rubidio y el cesio tienen muchas otras propiedades en común. Todos son sólidos a 0°C y funden por debajo de 200°C. Cada uno tiene propiedades metálicas como buena conducción de calor y electricidad, maleabilidad (la capacidad de ser martillado en láminas) y ductilidad (la capacidad de ser arrastrados en cables). La alta conductividad térmica (calor) y el punto de fusión relativamente bajo (para un metal) del sodio lo convierten en un fluido de transferencia de calor ideal. Se utiliza para enfriar ciertos tipos de reactores nucleares (reactores criadores rápidos de metal líquido, LMFBRs) y para enfriar las válvulas de motores de automóviles de alta potencia por esta razón.
Algunas propiedades generales de los metales alcalinos se resumen en la siguiente tabla. Todos estos átomos metálicos contienen un electrón individual fuera de una configuración de gas noble-gas, por lo que el electrón de valencia está bien protegido de la carga nuclear y los radios atómicos son relativamente grandes. El gran volumen de cada átomo da como resultado una densidad baja, lo suficientemente pequeña como para que Li, Na y K floten en el agua a medida que reaccionan con ella.
| Element | Símbolo | Configuración de electrones | Estado de oxidación habitual | Radio atómico/PM | Radio iónico (M +) /PM |
|---|---|---|---|---|---|
| Litio | Li | [Él] 2 s 1 | +1 | 122 | 60 |
| Sodio | Na | [Ne] 3 s 1 | +1 | 157 | 95 |
| Potasio | K | [Ar] 4 s 1 | +1 | 202 | 133 |
| Rubidio | Rb | [Kr] 5 s 1 | +1 | 216 | 148 |
| Cesio | Cs | [Xe] 6 s 1 | +1 | 235 | 169 |
| Símbolo | Energía de ionización/MJ mol —1 | Densidad/ g cm —3 | Electronegatividad | Punto de fusión (en °C) | |
|---|---|---|---|---|---|
| Primero | Segundo | ||||
| Li | 0.526 | 7.305 | 0.534 | 1.0 | 179 |
| Na | 0.502 | 4.569 | 0.97 | 0.9 | 98 |
| K | 0.425 | 3.058 | 0.86 | 0.8 | 64 |
| Rb | 0.409 | 2.638 | 1.52 | 0.8 | 39 |
| Cs | 0.382 | 2.430 | 1.87 | 0.7 | 28 |
Los átomos no tienen una fuerte atracción por el electrón de valencia única, por lo que se pierde fácilmente (pequeña energía de primera ionización) a partir de un ion +1. Debido a que donan fácilmente electrones de esta manera, todos los metales alcalinos son fuertes agentes reductores. Son bastante reactivas, incluso reduciendo el agua.
La débil atracción por el electrón de valencia también resulta en enlaces metálicos débiles, porque es la atracción entre los núcleos y numerosos electrones de valencia lo que mantiene unidos los átomos metálicos. La unión metálica débil da como resultado puntos de fusión bajos, especialmente para los átomos más grandes hacia la parte inferior del grupo. Cs, por ejemplo, se funde justo por encima de la temperatura ambiente. La débil unión metálica también explica el hecho de que todos estos metales son bastante blandos.
Que la química de los metales alcalinos está confinada al estado de oxidación +1 es confirmado por las grandes energías de segunda ionización. Eliminar el primer electrón del orbital grande difuso es fácil, pero eliminar un segundo electrón de un octeto en un ion M + es demasiado difícil de hacer para cualquier agente oxidante.
Otros dos elementos se encuentran en el grupo IA. El hidrógeno, aunque muchos de sus compuestos tienen fórmulas similares a los metales alcalinos, es un no metal y es casi único en su comportamiento químico. Por lo tanto, no suele incluirse en este grupo. El Francium (Fr) es bastante radiactivo, y solo se dispone de pequeñas cantidades para su estudio; por lo que también suele omitirse. Sus propiedades, sin embargo, parecen ser similares a las del Cs y los otros metales alcalinos.
Reacciones Químicas y Compuestos
El elemento litio combina violentamente y espectacularmente con el agua. Se emite gas hidrógeno, que impulsa el metal de litio a través del agua a medida que reacciona. Si se evapora el exceso de agua, el compuesto hidróxido de litio (LiOH) permanece atrás. El LiOH se visualiza mediante el indicador de fenolftaleína, que se vuelve rosado a medida que se produce LiOH, una base. Así, la ecuación para esta reacción es
\[\text{2Li}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2LiOH}(aq) + \text{H}_\text{2}(g)\nonumber \]
Los elementos sodio, potasio, rubidio y cesio también se combinan violentamente con el agua para formar hidróxidos. Las ecuaciones para sus reacciones son
\[\text{2Na}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2NaOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
\[\text{2K}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2KOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
\[\text{2Rb}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2RbOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
\[\text{2Cs}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2CsOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
Dado que todos los metales alcalinos reaccionan con el agua de la misma manera, se puede escribir una ecuación general:
\[\text{2M}(s) + \text{2H}_\text{2}\text{O}(l) \rightarrow \text{2MOH}(aq) + \text{H}_\text{2} (g)\nonumber \]
con M = K, Li, Na, Rb o Cs.
El símbolo M representa cualquiera de los cinco elementos.
Además de su comportamiento cuando se agregan al agua, los metales alcalinos reaccionan directamente con muchos elementos. Todos se combinan con rapidez con oxígeno en el aire para formar óxido blanco:
\[\text{4M}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}(s)\nonumber \]
con M = Li, Na, K, Rb o Cs
(Li 2 O es óxido de litio, Na 2 O es óxido de sodio, etc.)
Todos excepto el litio reaccionan adicionalmente para formar peróxidos amarillos, M 2 O 2:
\[\text{2M}_2 \text{O}(s) + \text{O}_2(g) \rightarrow \text{2M}_2 \text{O}_2(s)\nonumber \]M = Na, K, Rb o Cs
(Na 2 O 2 es peróxido de sodio, etc.)
El potasio, el rubidio y el cesio son suficientemente reactivos para que se puedan formar superóxidos amarillos (cuya fórmula general es MO 2):
\[\text{2M}_2 \text{O}_2(s) + \text{O}_2(g) \rightarrow \text{2MO}_2(s)\nonumber \]
con M = K, Rb o Cs
A menos que la superficie de una muestra de un metal alcalino se raspe limpia, aparecerá blanca o gris en lugar de tener un brillo metálico plateado. Esto se debe al recubrimiento de óxido, peróxido o superóxido que se forma después de unos segundos de exposición al aire. La siguiente película muestra cómo una pieza de litio recién cortada es brillante, pero se opaca a gris cuando se expone al oxígeno en el aire. El video también se enfoca en otra propiedad importante de los metales alcalinos: son blandos, y fáciles de cortar, en comparación con otros metales.
Se corta un cilindro oxidado gris opaco de metal litio, revelando una superficie plateada brillante. Después de 1 minuto, la superficie se ha embotado, y después de 10 minutos, la superficie cortada ha vuelto al gris opaco del resto del metal de litio. Dado que el metal alcalino es el litio, la única reacción con el oxígeno que se produce es:
\[\text{4Li}(s) + \text{O}_2(g) \rightarrow \text{2Li}_2\text{O}(s)\nonumber \]
El álcali también se combina directamente con gas hidrógeno para formar compuestos conocidos como hidruros, MH:
\[\text{2M}(s) + \text{H}_2(g) \rightarrow \text{2MH}(s)\nonumber \]
con M = Li, Na, K, Rb o Cs
Reaccionan con azufre para formar sulfuros, M 2 S:
\[\text{2M}(s) + \text{S}(g) \rightarrow \text{M}_2\text{S}(s)\nonumber \]
con M = Li, Na, K, Rb o Cs
Estos óxidos, hidruros, hidróxidos y sulfuros se disuelven en agua para dar soluciones básicas, y estos compuestos se encuentran entre las bases fuertes.
Los peróxidos y superóxidos formados cuando los metales alcalinos más pesados reaccionan con O 2 también se disuelven para dar soluciones básicas:
\[\text{2NaO}_2(s) + \text{2H}_2\text{O}(l) \rightarrow \text{4Na}^{+}(aq) + \text{4OH}^{-}(aq) + \text{O}_2(g)\nonumber \]
\[\text{4K}_2\text{O}(s) + \text{2H}_2\text{O}(l) \rightarrow \text{4K}^{+}+ \text{4OH}^{-} + \text{3O}_2(g)\nonumber \]
Ambas ecuaciones describen procesos redox así como ácido-base, como se puede confirmar asignando números de oxidación. Los iones peróxido y superóxido contienen átomos de O en los estados de oxidación inusuales (para O) —1 y —½:
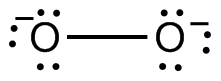
Por lo tanto, es posible la desproporción (oxidación y reducción simultáneas) de O 2 2 — o O 2 — a los estados de oxidación más comunes de 0 (en O 2) y —2 (en OH —).
Los metales alcalinos también reaccionan directamente con los halógenos, por ejemplo con cloro, formando cloruros,
\[\text{2M}(s) + \text{Cl}_2(g) \rightarrow \text{2MCl}(s)\nonumber \]M = Li, Na, K, Rb o Cs
A continuación se muestra un ejemplo de la reacción de Na con Cl 2
Se agrega un trozo de metal de sodio a un matraz que contiene gas cloro. Inicialmente no se produce ninguna reacción, pero cuando se agrega una gota de agua, el sodio y el cloro reaccionan, encendiendo violentamente y produciendo tanto calor que se necesita arena en el fondo del matraz para absorber el calor y evitar que el vidrio se agriete. Esta ecuación para esta reacción es:
\[\text{2Na}(s) + \text{Cl}_2(g) \rightarrow \text{2NaCl}(s)\nonumber \]
con flúor para formar fluoruros, MF:
\[\text{2M}(s) + \text{F}_2(g) \rightarrow \text{2MF}(s)\nonumber \]M = Li, Na, K, Rb o Cs
y con bromo para formar bromuros, MBr:
\[\text{2M}(s) + \text{Br}_2(g) \rightarrow \text{2MBr}(s)\nonumber \]M = Li, Na, K, Rb o Cs
A continuación se muestra un ejemplo de K reaccionando con Br 2
En este video, el potasio, que se almacena en aceite mineral inerte debido a su alta reactividad, se coloca en un vaso de precipitados de bromo líquido después de que se haya eliminado la capa protectora del aceite mineral. El potasio reacciona explosivamente con el bromo. El contenedor se cubre durante todo el proceso para evitar que los reactivos y productos ingresen al ambiente. La ecuación química para esta reacción es:
\[\text{2K}(s) + \text{Br}_2(g) \rightarrow \text{2KBr}(s)\nonumber \]
El sodio y el potasio son bastante abundantes, ocupando el sexto y séptimo lugar entre todos los elementos de la corteza terrestre, pero los otros metales alcalinos son raros. Los iones sodio y potasio son componentes de numerosas redes cristalinas de silicato que se ven en la corteza terrestre, pero como la mayoría de sus compuestos son solubles en agua, también son constituyentes importantes del agua de mar y depósitos subterráneos de salmuera. El cloruro de sodio obtenido de tales salmueras es la principal fuente comercial de sodio, mientras que el potasio se puede obtener de los minerales sylvita (KCl) o carnalita (KCl•MgCl 2 •6H 2 O).
Tanto los iones sodio (Na +) como el potasio (K +) son esenciales para los sistemas vivos. El Na + es el catión principal en los fluidos que rodean las células, mientras que K + es el más importante dentro de las células. Na + juega un papel en la contracción muscular, y tanto K + como Na + juegan un papel en la transmisión de impulsos nerviosos. El K es más importante que el Na en las plantas, y es uno de los tres elementos (K, P, N) que deben suministrarse en fertilizante para mantener altos rendimientos de los cultivos. La K es especialmente abundante en los árboles: las cenizas de madera de los fuegos de la cocina (potasa) fueron la principal fuente de este elemento tan recientemente como hace un siglo, y todavía hacen un buen fertilizante para su jardín. Las cenizas de madera contienen una mezcla de óxido de potasio y carbonato de potasio, este último formado por combinación de K 2 O con CO 2 producido cuando C en la madera se combina con O 2:
\[\text{K}_2\text{O} + \text{CO}_2 \rightarrow \text{K}_2\text{CO}_3\nonumber \]
Los compuestos de Na se obtienen comercialmente de salmuera o de agua de mar. Cuando se pasa una corriente eléctrica a través de una solución de NaCl (un proceso llamado electrólisis), se obtienen Cl 2 (g), H 2 (g) y una solución concentrada de NaOH (sosa cáustica o lejía):
\[\text{Na}^{+}(aq) + \text{2Cl}^{-}(aq) + \text{2H}_2\text{O}(l) \xrightarrow{\text{electrolysis}} \text{Cl}_2(g) + \text{H}_2(g) + \text{Na}^{+}(aq) + \text{2OH}^{-}(aq)\nonumber \]
Este proceso se describe con más detalle en la sección sobre celdas electroquímicas, pero se puede ver en la ecuación que la corriente eléctrica oxida Cl — a Cl 2 y reduce H 2 O a H 2. El NaOH (aq) se utiliza como base fuerte en numerosos procesos industriales para hacer jabón, rayón, celofán, papel, tintes y muchos otros productos. Lye también se usa en limpiadores de drenaje domésticos. Debe manejarse con cuidado porque es fuertemente básico, altamente cáustico, y puede quemar severamente la piel. Un segundo uso industrial importante de la salmuera es el proceso Solvay:
\[\text{CO}_2(g) + \text{NH}_3(aq) + \text{Na}^{+}(aq) + \text{Cl}^{-}(aq) + \text{H}_2\text{O}(l) \rightarrow \text{NaHCO}_3(s) + \text{NH}_4^{+}(aq) + \text{Cl}^{-}(aq)\nonumber \]
El proceso Solvay es una reacción ácido-base combinada con una precipitación. El anhídrido de ácido, CO 2, reacciona con H 2 O para producir H 2 CO 3. Este ácido débil dona un protón a NH 3, produciendo NH 4 + y HCO 3 —, y este último ion precipita con Na +. El hidrogenocarbonato de sodio débilmente básico producido por el proceso Solvay puede purificarse para su uso como antiácido (bicarbonato de soda), pero la mayor parte se convierte en carbonato de sodio (ceniza de soda) calentando:
\[\text{2NaHCO}_3(s) \xrightarrow{\Delta } \text{Na}_2\text{CO}_3(s) + \text{H}_2\text{O}(g) + \text{CO}_2(g)\nonumber \]
(El Δ en esta ecuación indica calentamiento del reactivo.) El carbonato de sodio (Na 2 CO 3) se utiliza en la fabricación de vidrio y papel, y en algunos detergentes. El ion carbonato es una base bastante fuerte, sin embargo, y los detergentes que contienen Na 2 CO 3 (sosa de lavado) han resultado en quemaduras químicas severas a algunos niños pequeños que, por curiosidad, los han comido.

