18.8: La Química del Nitrógeno
- Page ID
- 73217
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Al igual que los elementos del grupo 14, el miembro más ligero del grupo 15, el nitrógeno, se encuentra en la naturaleza como elemento libre, y los elementos más pesados se conocen desde hace siglos porque se aíslan fácilmente de sus minerales. Si bien el nitrógeno es el elemento más abundante en la atmósfera, fue el último de los pnicogenos (elementos del Grupo 15) que se obtuvo en forma pura. En 1772, Daniel Rutherford, trabajando con Joseph Black (quien descubrió CO 2), notó que quedaba un gas cuando se eliminó CO 2 de una reacción de combustión. Antoine Lavoisier llamó al gas azote, que significa “sin vida”, porque no soportaba la vida. Cuando se descubrió que el mismo elemento también estaba presente en el ácido nítrico y sales de nitrato como el KNO 3 (nitre), se le denominó nitrógeno. Alrededor del 90% del nitrógeno producido hoy en día se utiliza para proporcionar una atmósfera inerte para procesos o reacciones sensibles al oxígeno, como la producción de acero, refinación de petróleo y envasado de alimentos y productos farmacéuticos.
Preparación y Propiedades Generales del Nitrógeno
Debido a que la atmósfera contiene varios billones de toneladas de nitrógeno elemental con una pureza de alrededor del 80%, es una enorme fuente de gas nitrógeno. La destilación del aire licuado produce gas nitrógeno que es más de 99.99% puro, pero pequeñas cantidades de gas nitrógeno muy puro se pueden obtener de la descomposición térmica de la azida sódica:
\[\ce{2NaN3(s) ->[\Delta] 2Na(l) + 3N2(g)} \label{Eq1} \]
En contraste, la corteza terrestre es relativamente pobre en nitrógeno. Los únicos minerales de nitrógeno importantes son los grandes depósitos de KNO 3 y NaNO 3 en los desiertos de Chile y Rusia, que aparentemente se formaron cuando los antiguos lagos alcalinos se evaporaron. En consecuencia, prácticamente todos los compuestos de nitrógeno producidos a escala industrial utilizan nitrógeno atmosférico como material de partida. El fósforo, que constituye sólo alrededor de 0.1% de la corteza terrestre, es mucho más abundante en minerales que el nitrógeno. Al igual que el aluminio y el silicio, el fósforo siempre se encuentra en combinación con el oxígeno, y se requieren grandes insumos de energía para aislarlo.
Reacciones y Compuestos de Nitrógeno
Al igual que el carbono, el nitrógeno tiene cuatro orbitales de valencia (uno 2s y tres 2p), por lo que puede participar en como máximo cuatro enlaces de pares de electrones mediante el uso de orbitales híbridos sp 3. Sin embargo, a diferencia del carbono, el nitrógeno no forma cadenas largas debido a interacciones repulsivas entre pares solitarios de electrones en átomos adyacentes. Estas interacciones adquieren importancia en las distancias internucleares más cortas que se encuentran con los elementos más pequeños del segundo período de los grupos 15, 16 y 17. Los compuestos estables con enlaces N-N se limitan a cadenas de no más de tres átomos de N, como el ion azida (N 3 −).
El nitrógeno es el único pnicogeno que normalmente forma múltiples enlaces consigo mismo y otros elementos del segundo período, utilizando el solapamiento π de orbitales np adyacentes. Así, la forma estable del nitrógeno elemental es N 2, cuyo enlace N=N es tan fuerte (D N=942 kJ/mol) comparado con los enlaces N—N y N=N (D N—N = 167 kJ/mol; D N = 418 kJ/mol) que todos los compuestos que contienen enlaces N—N y N=N son termodinámicamente inestable con respecto a la formación de N 2. De hecho, la formación del enlace N=N es tan favorecida termodinámicamente que prácticamente todos los compuestos que contienen enlaces N-N son potencialmente explosivos.
Nuevamente en contraste con el carbono, el nitrógeno experimenta solo dos reacciones químicas importantes a temperatura ambiente: reacciona con el litio metálico para formar nitruro de litio, y es reducido a amoníaco por ciertos microorganismos. A temperaturas más altas, sin embargo, el N 2 reacciona con más elementos electropositivos, como los del grupo 13, para dar nitruros binarios, que varían de carácter covalente a iónico. Al igual que los correspondientes compuestos de carbono, los compuestos binarios de nitrógeno con oxígeno, hidrógeno u otros no metales suelen ser sustancias moleculares covalentes.
Pocos compuestos moleculares binarios de nitrógeno se forman por reacción directa de los elementos. A temperaturas elevadas, N 2 reacciona con H 2 para formar amoníaco, con O 2 para formar una mezcla de NO y NO 2, y con carbono para formar cianógeno (N=C—C=N); el nitrógeno elemental no reacciona con los halógenos ni con los otros calcógenos. Sin embargo, todos los haluros binarios de nitrógeno (NX 3) son conocidos. A excepción de NF 3, todos son tóxicos, termodinámicamente inestables y potencialmente explosivos, y todos se preparan haciendo reaccionar el halógeno con NH 3 en lugar de N 2. Tanto el monóxido de nitrógeno (NO) como el dióxido de nitrógeno (NO 2) son termodinámicamente inestables, con energías libres positivas de formación. A diferencia del NO, el NO 2 reacciona fácilmente con el exceso de agua, formando una mezcla 1:1 de ácido nitroso (HNO 2) y ácido nítrico (HNO 3):
\[\ce{2NO2(g) + H2O(l) -> HNO2(aq) + HNO3(aq)} \label{Eq2} \]
El nitrógeno también forma\(\ce{N2O}\) (monóxido de dinitrógeno, u óxido nitroso), una molécula lineal que es isoelectrónica con\(\ce{CO2}\) y puede representarse como − N=N + =O. Al igual que los otros dos óxidos de nitrógeno, el óxido nitroso es termodinámicamente inestable. Las estructuras de los tres óxidos comunes de nitrógeno son las siguientes:
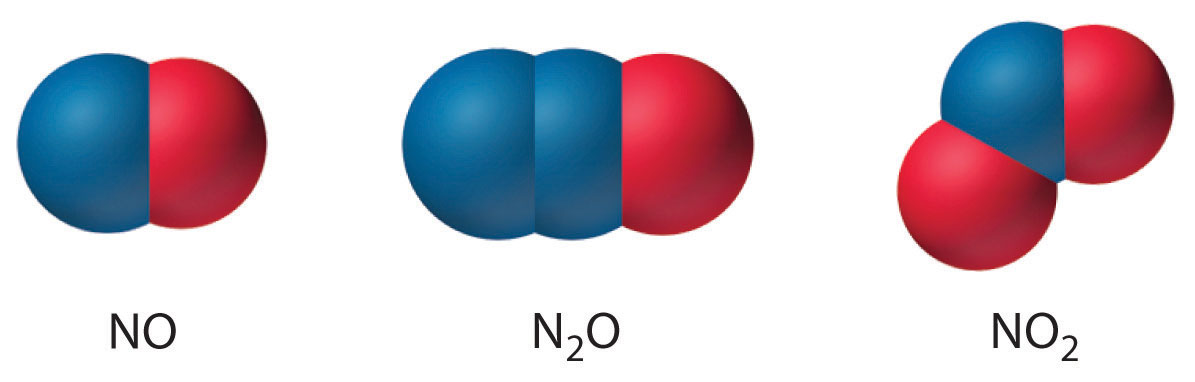
Pocos compuestos moleculares binarios de nitrógeno se forman por la reacción directa de los elementos.
A temperaturas elevadas, el nitrógeno reacciona con metales altamente electropositivos para formar nitruros iónicos, como\(\ce{Li3N}\) y\(\ce{Ca3N2}\). Estos compuestos consisten en redes iónicas formadas por\(\ce{M^{n+}}\) e\(\ce{N^{3−}}\) iones. Así como el boro forma boruros intersticiales y el carbono forma carburos intersticiales, con menos metales electropositivos el nitrógeno forma una gama de nitruros intersticiales, en los que el nitrógeno ocupa agujeros en una estructura metálica compacta. Al igual que los carburos y boruros intersticiales, estas sustancias suelen ser materiales muy duros y de alto punto de fusión que tienen brillo metálico y conductividad.
El nitrógeno también reacciona con semimetales a temperaturas muy altas para producir nitruros covalentes, tales como\(\ce{Si3N4}\) y\(\ce{BN}\), que son sólidos con estructuras de red covalente extendida similares a las del grafito o diamante. En consecuencia, suelen ser materiales de alto punto de fusión y químicamente inertes.
El amoníaco (NH 3) es uno de los pocos compuestos binarios termodinámicamente estables de nitrógeno con un no metal. No es inflamable en el aire, pero se quema en una\(\ce{O2}\) atmósfera:
\[\ce{4NH3(g) + 3O2(g) -> 2N2(g) + 6H2O(g)} \label{Eq3} \]
Alrededor del 10% del amoníaco que se produce anualmente se utiliza para fabricar fibras y plásticos que contienen enlaces amida, como nailon y poliuretanos, mientras que el 5% se usa en explosivos, como nitrato de amonio, TNT (trinitrotolueno) y nitroglicerina. Se utilizan grandes cantidades de amoníaco líquido anhidro como fertilizante.
El nitrógeno forma otros dos compuestos binarios importantes con hidrógeno. El ácido hidrazoico (\(\ce{HN3}\)), también llamado azida de hidrógeno, es una sustancia incolora, altamente tóxica y explosiva. La hidrazina (\(\ce{N2H4}\)) también es potencialmente explosiva; se utiliza como propulsor de cohetes y para inhibir la corrosión en calderas.
B, C y N reaccionan con metales de transición para formar compuestos intersticiales que son materiales duros de alto punto de fusión.
Para cada reacción, explique por qué se forman los productos dados cuando se calientan los reactivos.
- \(\ce{Sr(s) + N2O(g) ->[\Delta] SrO(s) + N2(g)}\)
- \(\ce{NH4NO2(s) ->[\Delta] N2(g) + 2H2O(g)}\)
- \(\ce{Pb(NO3)2(s) ->[\Delta] PbO2(s) + 2NO2(g)}\)
Dado: ecuaciones químicas balanceadas
Preguntado por: por qué forman los productos dados
Estrategia:
Clasificar el tipo de reacción. Usando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explicar por qué se forman los productos de reacción observados.
Solución
- Como metal alcalino, el estroncio es un reductor fuerte. Si el otro reactivo puede actuar como oxidante, entonces se producirá una reacción redox. El óxido nitroso contiene nitrógeno en un estado de oxidación baja (+1), por lo que normalmente no lo consideraríamos un oxidante. El óxido nitroso es, sin embargo, termodinámicamente inestable (ΔH° f > 0 y ΔG° f > 0), y puede reducirse a N 2, que es una especie estable. En consecuencia, predecimos que ocurrirá una reacción redox.
- Cuando se calienta una sustancia, probablemente se producirá una reacción de descomposición, que a menudo implica la liberación de gases estables. En este caso, el nitrito amónico contiene nitrógeno en dos estados de oxidación diferentes (−3 y +3), por lo que una reacción redox interna es una posibilidad. Debido a su estabilidad termodinámica, N 2 es el producto probable que contiene nitrógeno, mientras que predecimos que H y O se combinarán para formar H 2 O.
- Nuevamente, esta es probablemente una reacción de descomposición térmica. Si un elemento está en un estado de oxidación generalmente alto y otro en un estado de oxidación baja, probablemente se producirá una reacción redox. El nitrato de plomo contiene el catión Pb 2 + y el anión nitrato, el cual contiene nitrógeno en su estado de oxidación más alto posible (+5). De ahí que se pueda reducir el nitrógeno, y sabemos que el plomo se puede oxidar al estado de oxidación +4. En consecuencia, es probable que el nitrato de plomo (II) se descomponga en óxido de plomo (IV) y dióxido de nitrógeno cuando se calienta. Aunque el PbO 2 es un poderoso oxidante, la liberación de un gas como el NO 2 a menudo puede conducir una reacción desfavorable hasta su finalización (principio de Le Chatelier). Tenga en cuenta, sin embargo, que el PbO 2 probablemente se descompondrá a PbO a altas temperaturas.
Predecir el producto o productos de cada reacción y escribir una ecuación química equilibrada para cada reacción.
- \(\ce{NO(g) + H2O(l) ->[\Delta]}\)
- \(\ce{NH4NO3(s) ->[\Delta]}\)
- \(\ce{Sr(s) + N2(g) ->}\)
Responder
- \(\ce{NO(g) + H2O(l) ->[\Delta] no reaction}\)
- \(\ce{NH4NO3(s) ->[\Delta] N2O(g) + 2H2O(g)}\)
- \(\ce{3Sr(s) + N2(g) -> Sr3N2(s)}\)
Resumen
El nitrógeno se comporta químicamente como no metales, el nitrógeno forma compuestos en nueve estados de oxidación diferentes. El nitrógeno no forma compuestos catenados estables debido a las repulsiones entre pares solitarios de electrones en átomos adyacentes, pero sí forma múltiples enlaces con otros átomos del segundo período. El nitrógeno reacciona con elementos electropositivos para producir sólidos que van de carácter covalente a iónico. La reacción con metales electropositivos produce nitruros iónicos, la reacción con menos metales electropositivos produce nitruros intersticiales y la reacción con semimetales produce nitruros covalentes.

