2.7: Compuestos - Fórmulas, Nombres y Masas
- Page ID
- 78494
- Describir la composición de un compuesto químico.
- Para nombrar compuestos covalentes que contengan hasta tres elementos.
Al igual que con los compuestos iónicos, el sistema para nombrar compuestos covalentes permite a los químicos escribir la fórmula molecular a partir del nombre y viceversa. Esta y la siguiente sección describen las reglas para nombrar compuestos covalentes simples, comenzando con compuestos inorgánicos y luego recurriendo a compuestos orgánicos simples que contienen solo carbono e hidrógeno.
Cuando los químicos sintetizan un nuevo compuesto, es posible que aún no conozcan su fórmula molecular o estructural. En tales casos, suelen comenzar por determinar su fórmula empírica, los números relativos de átomos de los elementos en un compuesto, reducidos a los números enteros más pequeños. Debido a que la fórmula empírica se basa en mediciones experimentales de los números de átomos en una muestra del compuesto, solo muestra las proporciones de los números de los elementos presentes. La diferencia entre fórmulas empíricas y moleculares se puede ilustrar con butano, un compuesto covalente utilizado como combustible en encendedores desechables. La fórmula molecular para el butano es\(\ce{C4H10}\). La relación de átomos de carbono a átomos de hidrógeno en butano es 4:10, que puede reducirse a 2:5. Por lo tanto, la fórmula empírica para el butano es\(\ce{C2H5}\). La unidad de fórmula es el agrupamiento absoluto de átomos o iones representados por la fórmula empírica de un compuesto, ya sea iónico o covalente. El butano tiene la fórmula empírica\(\ce{C2H5}\), pero contiene dos unidades de\(\ce{C2H5}\) fórmula, dando una fórmula molecular de\(\ce{C4H10}\).
Debido a que los compuestos iónicos no contienen moléculas discretas, se utilizan fórmulas empíricas para indicar sus composiciones. Todos los compuestos, sean iónicos o covalentes, deben ser eléctricamente neutros. En consecuencia, los cargos positivos y negativos en una unidad de fórmula deben cancelarse exactamente entre sí. Si el catión y el anión tienen cargas de igual magnitud, como\(\ce{Na^{+}}\) y\(\ce{Cl^{−}}\), entonces el compuesto debe tener una relación 1:1 de cationes a aniones, y la fórmula empírica debe ser\(\ce{NaCl}\). Si las cargas no son de la misma magnitud, entonces se necesita una relación catión:anión distinta de 1:1 para producir un compuesto neutro. En el caso de\(\ce{Mg^{2+}}\) y\(\ce{Cl^{−}}\), por ejemplo, se necesitan dos iones Cl − para equilibrar las dos cargas positivas en cada ion Mg 2 +, dando una fórmula empírica de\(\ce{MgCl2}\). De manera similar, la fórmula para el compuesto iónico que contiene iones Na + y O2- es Na 2 O.
Los compuestos iónicos no contienen moléculas discretas, por lo que se utilizan fórmulas empíricas para indicar sus composiciones.
Compuestos iónicos binarios
Un compuesto iónico que contiene solo dos elementos, uno presente como catión y otro como anión, se denomina compuesto iónico binario. Un ejemplo es\(\ce{MgCl_2}\), un coagulante utilizado en la preparación de tofu a partir de soja. Para los compuestos iónicos binarios, los subíndices en la fórmula empírica también se pueden obtener cruzando cargas: usar el valor absoluto de la carga en un ion como subíndice para el otro ión. Este método se muestra esquemáticamente de la siguiente manera:
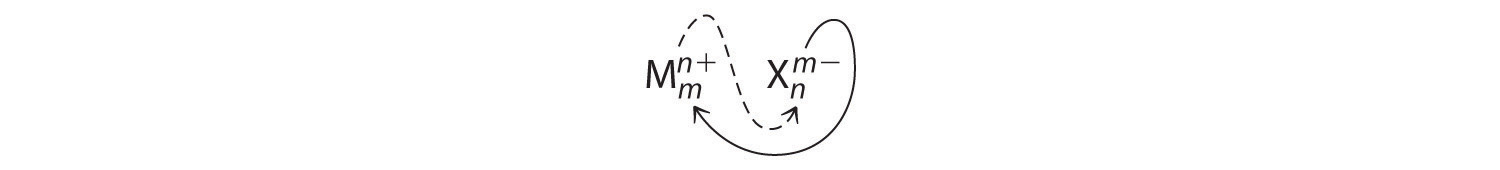
Al cruzar cargas, a veces es necesario reducir los subíndices a su relación más simple para escribir la fórmula empírica. Consideremos, por ejemplo, el compuesto formado por Mg 2 + y O 2−. El uso de los valores absolutos de las cargas en los iones como subíndices da la fórmula\(\ce{Mg2O2}\):
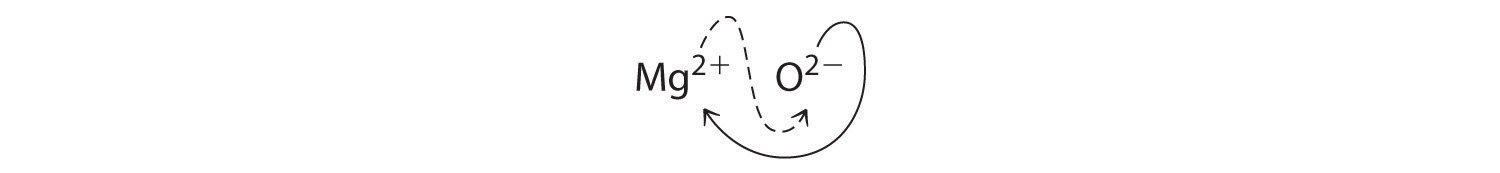
Esto simplifica a su correcta fórmula empírica MgO. La fórmula empírica tiene un ion Mg 2 + y un ion O 2−.
Escriba la fórmula empírica para el compuesto iónico binario más simple formado a partir de cada ion o par de elementos.
- Ga 3 + y As 3 −
- Eu 3 + y O 2−
- calcio y cloro
Dado: iones o elementos
Preguntado por: fórmula empírica para compuesto iónico binario
Estrategia:
- Si no se dan, determinar las cargas iónicas con base en la ubicación de los elementos en la tabla periódica.
- Utilice el valor absoluto de la carga en cada ion como subíndice para el otro ion. Reducir los subíndices a los números más bajos
para escribir la fórmula empírica. Verifique para asegurarse de que la fórmula empírica es eléctricamente neutra.
Solución
a. B El uso de los valores absolutos de las cargas en los iones como subíndices da\(\ce{Ga3As3}\):
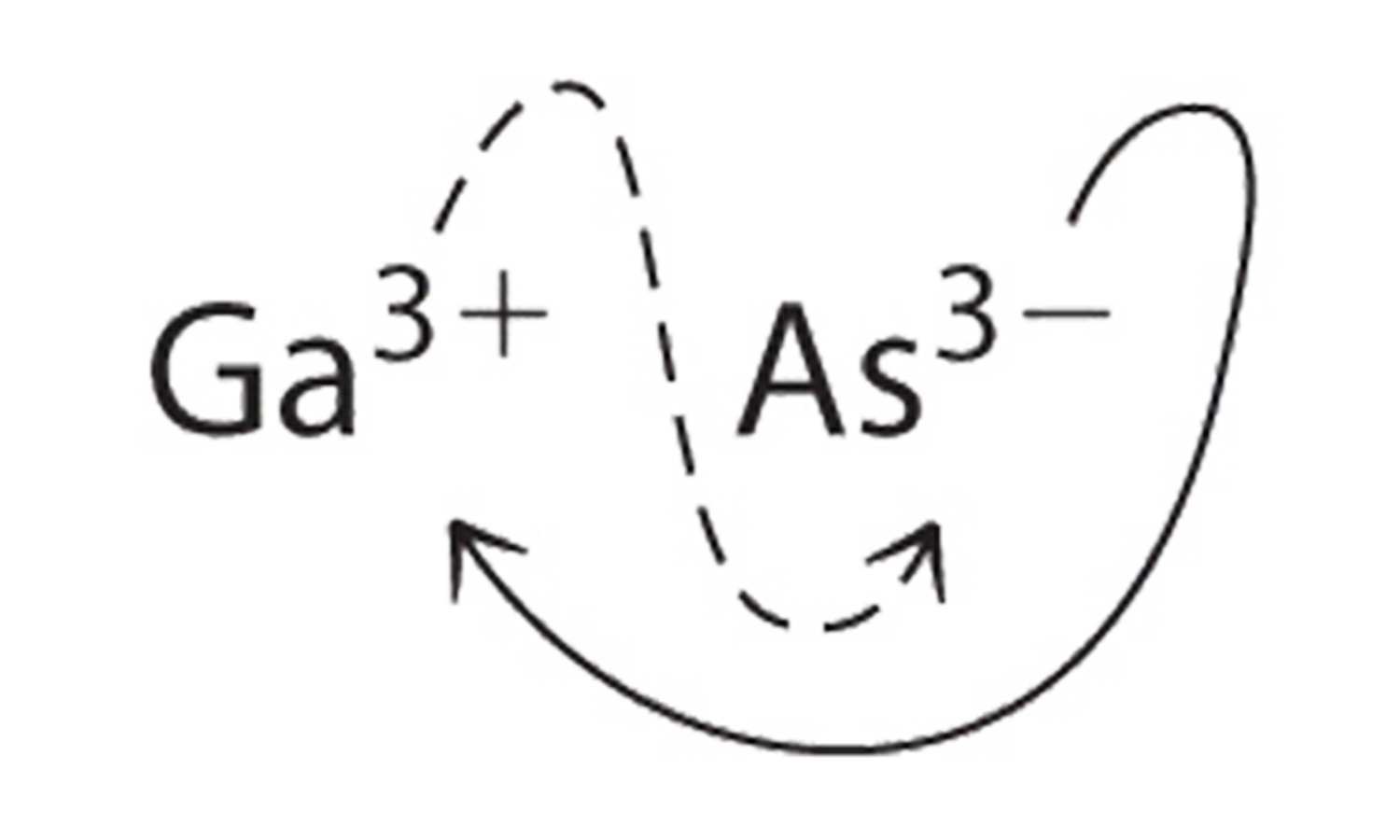
Reducir los subíndices a los números enteros más pequeños da la fórmula empírica GaAs, que es eléctricamente neutra [+3 + (−3) = 0]. Alternativamente, podríamos reconocer que Ga 3 + y As 3 − tienen cargas de igual magnitud pero signos opuestos. Un ion Ga 3 + equilibra la carga en un ion As 3 −, y un compuesto 1:1 no tendrá carga neta. Debido a que escribimos subíndices solo si el número es mayor que 1, la fórmula empírica es GaAs. GaAs es arseniuro de galio, que es ampliamente utilizado en la industria electrónica en transistores y otros dispositivos.
b. B Debido a que Eu 3 + tiene una carga de +3 y O 2− tiene una carga de −2, un compuesto 1:1 tendría una carga neta de +1. Por lo tanto, debemos encontrar múltiplos de los cargos que cancelan. Cruzamos cargas, usando el valor absoluto de la carga en un ion como subíndice para el otro ion:
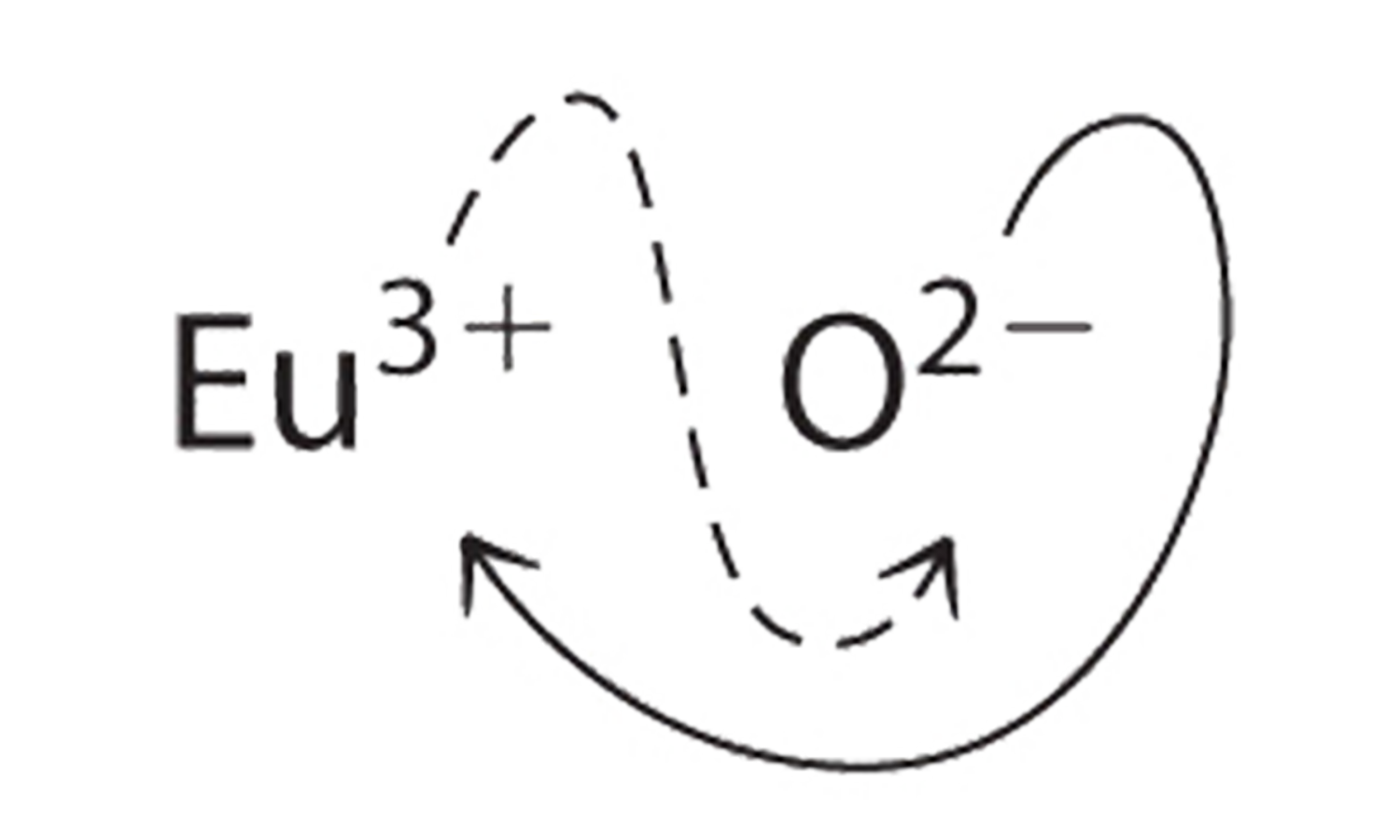
El subíndice para Eu 3 + es 2 (de O 2−), y el subíndice para O 2− es 3 (de Eu 3 +), dando Eu 2 O 3; los subíndices no pueden reducirse más. La fórmula empírica contiene una carga positiva de 2 (+3) = +6 y una carga negativa de 3 (−2) = −6, para una carga neta de 0. El compuesto Eu 2 O 3 es neutro. El óxido de europio es responsable del color rojo en las pantallas de televisión y computadoras.
c. A Debido a que no se dan las cargas sobre los iones, primero debemos determinar las cargas esperadas para los iones más comunes derivados del calcio y el cloro. El calcio se encuentra en el grupo 2, por lo que debería perder dos electrones para formar Ca 2 +. El cloro se encuentra en el grupo 17, por lo que debe ganar un electrón para formar Cl −.
B Dos iones Cl − son necesarios para equilibrar la carga en un ion Ca 2 +, lo que lleva a la fórmula empírica CaCl 2. También podríamos cruzar cargas, usando el valor absoluto de la carga en Ca 2 + como subíndice para Cl y el valor absoluto de la carga en Cl − como subíndice para Ca:
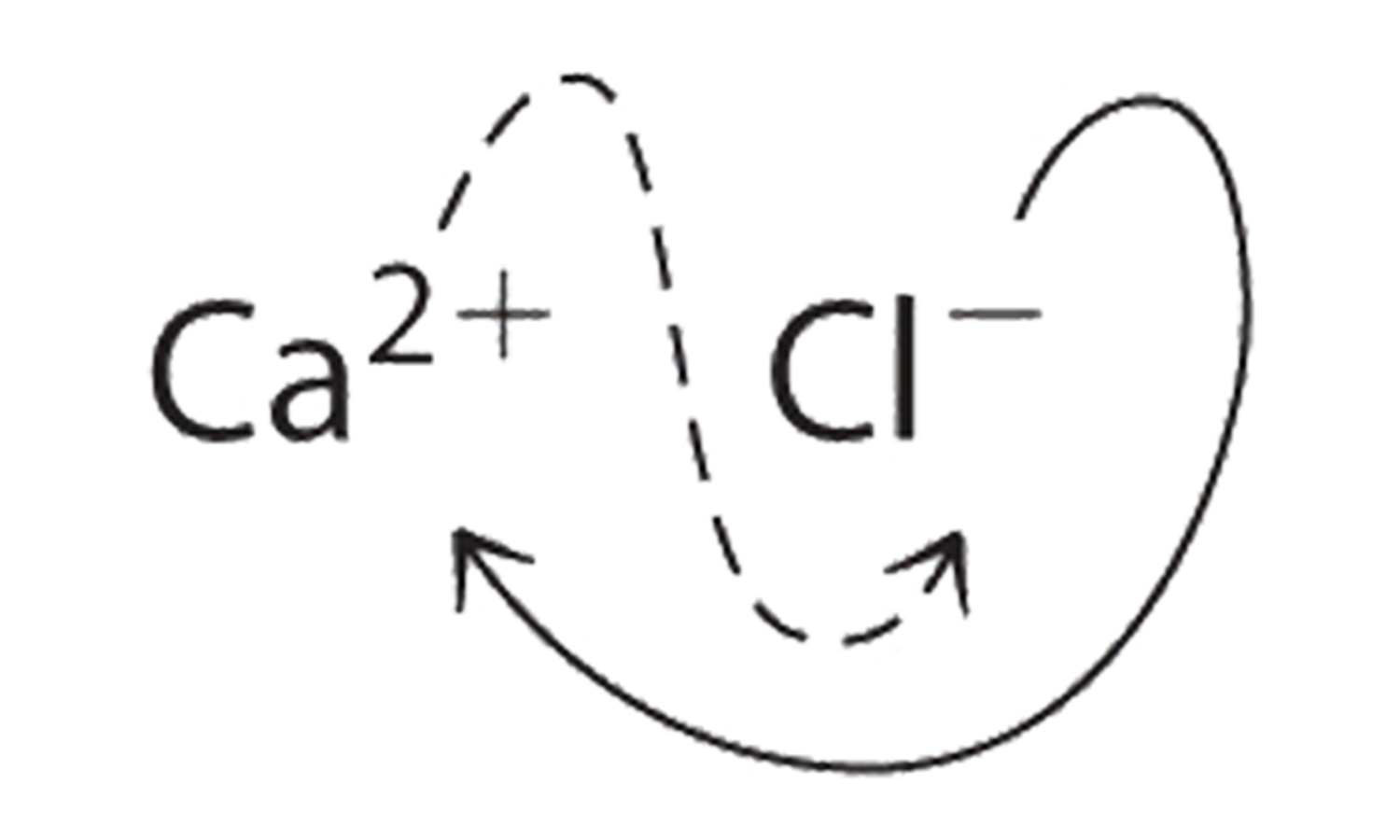
Los subíndices en CaCl 2 no se pueden reducir aún más. La fórmula empírica es eléctricamente neutra [+2 + 2 (−1) = 0]. Este compuesto es el cloruro de calcio, una de las sustancias utilizadas como “sal” para derretir el hielo en carreteras y aceras en invierno.
Escriba la fórmula empírica para el compuesto iónico binario más simple formado a partir de cada ion o par de elementos.
- Li + y N 3−
- Al 3 + y O 2−
- litio y oxígeno
- Responder a
-
Li 3 N
- Respuesta b
-
Al 2 O 3
- Respuesta c
-
Li 2 O
Nomenclatura de Metales: Nomenclatura de Metales (opens in new window) [youtu.be]
Iones Poliatómicos
Los iones poliatómicos son grupos de átomos que llevan cargas eléctricas netas, aunque los átomos en un ion poliatómico se mantienen unidos por los mismos enlaces covalentes que mantienen a los átomos unidos en moléculas. Así como hay muchos más tipos de moléculas que elementos simples, hay muchos más tipos de iones poliatómicos que iones monoatómicos. Dos ejemplos de cationes poliatómicos son los iones amonio (NH 4 +) y metilamonio (CH 3 NH 3 +). Los aniones poliatómicos son mucho más numerosos que los cationes poliatómicos; algunos ejemplos comunes están en la Tabla\(\PageIndex{1}\).
| Fórmula | Nombre de Ion | Fórmula | Nombre de Ion |
|---|---|---|---|
| NH 4 + | amonio | HPO 4 2 − | fosfato de hidrógeno |
| CH 3 NH 3 + | metilamonio | H 2 PO 4 − | fosfato de dihidrógeno |
| OH − | hidróxido | ClO − | hipoclorito |
| O 2 2 − | peróxido | ClO 2 − | clorito |
| CN − | cianuro | ClO 3 − | clorato |
| SCN - | tiocianato | ClO 4 − | perclorato |
| NO 2 − | nitrito | MnO 4 - | permanganato |
| NO 3 − | nitrato | CrO4 2 − | cromato |
| CO 3 2 − | carbonato | Cr 2 O 7 2 − | dicromato |
| HCO 3 − | carbonato de hidrógeno o bicarbonato | C 2 O 4 2 − | oxalato |
| SO 3 2 − | sulfito | HCO 2 − | formiato |
| SO 4 2 − | sulfato | CH 3 CO 2 − | acetato |
| HSO 4 − | sulfato de hidrógeno o bisulfato | C 6 H 5 CO 2 − | benzoato |
| PO 4 3 − | fosfato |
El método utilizado para predecir las fórmulas empíricas para compuestos iónicos que contienen iones monoatómicos también se puede utilizar para compuestos que contienen iones poliatómicos. La carga general sobre los cationes debe equilibrar la carga general sobre los aniones en la unidad de fórmula. Así, los iones K + y NO 3 − se combinan en una proporción 1:1 para formar KNO 3 (nitrato de potasio o salitre), un ingrediente principal en la pólvora negra. De igual manera, Ca 2 + y SO 4 2 − forman CaSO 4 (sulfato de calcio), que se combina con cantidades variables de agua para formar yeso y yeso de París. Los iones poliatómicos NH 4 + y NO 3 − forman NH 4 NO 3 (nitrato amónico), un fertilizante ampliamente utilizado y, en las manos equivocadas, un explosivo. Un ejemplo de un compuesto en el que los iones tienen cargas de diferentes magnitudes es el fosfato de calcio, que está compuesto por iones Ca 2 + y PO 4 3 −; es un componente importante de los huesos. El compuesto es eléctricamente neutro porque los iones se combinan en una proporción de tres iones Ca 2 + [3 (+2) = +6] por cada dos iones [2 (−3) = −6], dando una fórmula empírica de Ca 3 (PO 4) 2; los paréntesis alrededor de PO 4 en el empírico fórmula indican que es un ion poliatómico. Escribir la fórmula para el fosfato de calcio como Ca 3 P 2 O 8 da el número correcto de cada átomo en la unidad de fórmula, pero oscurece el hecho de que el compuesto contiene iones PO 4 3 − fácilmente identificables.
Escriba la fórmula empírica para el compuesto formado a partir de cada par iónico.
- Na + y HPO 4 2 −
- catión potasio y anión cianuro
- catión calcio y anión hipoclorito
Dado: iones
Preguntado por: fórmula empírica para compuesto iónico
Estrategia:
- Si no se da, determinar la carga sobre un ion monatómico desde su ubicación en la tabla periódica. Utilice la Tabla\(\PageIndex{1}\) para encontrar la carga en un ion poliatómico.
- Utilice el valor absoluto de la carga en cada ion como subíndice para el otro ion. Reducir los subíndices a los números enteros más pequeños al escribir la fórmula empírica.
Solución:
- B Debido a que HPO 4 2 − tiene una carga de −2 y Na + tiene una carga de +1, la fórmula empírica requiere dos iones Na + para equilibrar la carga del ion poliatómico, dando Na 2 HPO 4. Los subíndices se reducen a los números más bajos, por lo que la fórmula empírica es Na 2 HPO 4. Este compuesto es hidrogenofosfato de sodio, que se utiliza para proporcionar textura en quesos procesados, pudines y desayunos instantáneos.
- A El catión potasio es K +, y el anión cianuro es CN −. B Debido a que la magnitud de la carga en cada ion es la misma, la fórmula empírica es KCN. El cianuro de potasio es altamente tóxico, y en un momento se utilizó como veneno para ratas. Este uso ha sido descontinuado, sin embargo, debido a que demasiadas personas estaban siendo envenenadas accidentalmente.
- A El catión calcio es Ca 2 +, y el anión hipoclorito es ClO −. B Se necesitan dos iones ClO − para equilibrar la carga en un ion Ca 2 +, dando Ca (ClO) 2. Los subíndices no se pueden reducir aún más, por lo que la fórmula empírica es Ca (ClO) 2. Se trata del hipoclorito de calcio, el “cloro” utilizado para purificar el agua en las piscinas.
Escriba la fórmula empírica para el compuesto formado a partir de cada par iónico.
- Ca 2 + y H 2 PO 4 −
- catión de sodio y anión bicarbonato
- catión amónico y anión sulfato
- Contestar a
-
Ca (H 2 PO 4) 2: el dihidrogenofosfato de calcio es uno de los ingredientes en la levadura en polvo.
- Respuesta b
-
NaHCO 3: el bicarbonato de sodio se encuentra en los antiácidos y el polvo de hornear; en forma pura, se vende como bicarbonato de sodio.
- Respuesta c
-
(NH 4) 2 SO 4: el sulfato amónico es una fuente común de nitrógeno en los fertilizantes.
Poliatómica: Poliatómica, YouTube (opens in new window) [youtu.be] (opens in new window)
Hidratos
Muchos compuestos iónicos se presentan como hidratos, compuestos que contienen proporciones específicas de moléculas de agua poco unidas, llamadas aguas de hidratación. Las aguas de hidratación a menudo se pueden eliminar simplemente calentando. Por ejemplo, el dihidrogenofosfato de calcio puede formar un sólido que contiene una molécula de agua por\(\ce{Ca(H2PO4)2}\) unidad y se usa como agente leudante en la industria alimentaria para hacer que los productos horneados aumenten. La fórmula empírica para el sólido es\(\ce{Ca(H2PO4)2·H2O}\). En contraste, el sulfato de cobre suele formar un sólido azul que contiene cinco aguas de hidratación por unidad de fórmula, con la fórmula empírica\(\ce{CuSO4·5H2O}\). Cuando se calientan, las cinco moléculas de agua se pierden, dando un sólido blanco con la fórmula empírica\(\ce{CuSO4}\).


Los compuestos que difieren sólo en el número de aguas de hidratación pueden tener propiedades muy diferentes. Por ejemplo,\(\ce{CaSO4·½H2O}\) es el yeso de París, que a menudo se usaba para hacer moldes resistentes para brazos o piernas rotos, mientras que\(\ce{CaSO4·2H2O}\) es el yeso menos denso y escamoso, un mineral utilizado en los paneles de yeso para la construcción de viviendas. Cuando un molde se fraguaba, una mezcla de yeso de París y agua cristalizaba para dar sólido\(\ce{CaSO4·2H2O}\). Procesos similares se utilizan en el fraguado de cemento y concreto.
Ácidos binarios
Algunos compuestos que contienen hidrógeno son miembros de una clase importante de sustancias conocidas como ácidos. La química de estos compuestos se explora con más detalle en capítulos posteriores de este texto, pero por ahora, bastará señalar que muchos ácidos liberan iones hidrógeno, H +, cuando se disuelven en agua. Para denotar esta propiedad química distinta, a una mezcla de agua con un ácido se le da un nombre derivado del nombre del compuesto. Si el compuesto es un ácido binario (compuesto por hidrógeno y otro elemento no metálico):
- La palabra “hidrógeno” se cambia por el prefijo hidro-
- El nombre del otro elemento no metálico se modifica agregando el sufijo - ic
- La palabra “ácido” se agrega como segunda palabra
Por ejemplo, cuando el gas\(\ce{HCl}\) (cloruro de hidrógeno) se disuelve en agua, la solución se llama ácido clorhídrico. Varios otros ejemplos de esta nomenclatura se muestran en la Tabla\(\PageIndex{2}\).
| Nombre de Gas | Nombre del ácido |
|---|---|
| HF (g), fluoruro de hidrógeno | HF (aq), ácido fluorhídrico |
| HCl (g), cloruro de hidrógeno | HCl (ac), ácido clorhídrico |
| HBr (g), bromuro de hidrógeno | HBr (aq), ácido bromhídrico |
| HI (g), yoduro de hidrógeno | HI (aq), ácido yodhídrico |
| H 2 S (g), sulfuro de hidrógeno | H 2 S (aq), ácido hidrosulfúrico |
Oxiácidos
Muchos compuestos que contienen tres o más elementos (como compuestos orgánicos o compuestos de coordinación) están sujetos a reglas de nomenclatura especializadas que aprenderás más adelante. Sin embargo, discutiremos brevemente los compuestos importantes conocidos como oxiácidos, compuestos que contienen hidrógeno, oxígeno y al menos otro elemento, y están unidos de tal manera que imparten propiedades ácidas al compuesto (aprenderás los detalles de esto en un capítulo posterior). Los oxiácidos típicos consisten en hidrógeno combinado con un ion poliatómico que contiene oxígeno. Para nombrar oxiácidos:
- Omitir “hidrógeno”
- Comience con el nombre de la raíz del anión
- Reemplazar — comió con — ic, o — ite con — ous
- Añadir “ácido”
Por ejemplo, considere H 2 CO 3 (que podría tener la tentación de llamar “carbonato de hidrógeno”). Para nombrar esto correctamente, se omite “hidrógeno”; el —ato de carbonato se reemplaza con —ic; y se agrega ácido— por lo que su nombre es ácido carbónico. Otros ejemplos se dan en la Tabla\(\PageIndex{3}\). Hay algunas excepciones al método general de nomenclatura (por ejemplo, H 2 SO 4 se llama ácido sulfúrico, no ácido sulfúrico, y H 2 SO 3 es ácido sulfuroso, no sulfoso).
| Fórmula | Nombre del anión | Nombre ácido |
|---|---|---|
| HC 2 H 3 O 2 | acetato | ácido acético |
| HNO 3 | nitrato | ácido nítrico |
| HNO 2 | nitrito | ácido nitroso |
| HClO 4 | perclorato | ácido perclórico |
| H 2 CO 3 | carbonato | ácido carbónico |
| H 2 SO 4 | sulfato | ácido sulfúrico |
| H 2 SO 3 | sulfito | ácido sulfuroso |
| H 3 PO 4 | fosfato | ácido fosfórico |
Nomenclatura de Ácidos: Nomenclatura de Ácidos, YouTube (opens in new window) [youtu.be]
Bases
Presentaremos definiciones más completas de bases en capítulos posteriores, pero prácticamente todas las bases que encuentres mientras tanto serán un compuesto iónico, como el hidróxido de sodio (NaOH) y el hidróxido de bario [Ba (OH) 2], que contienen el ion hidróxido y un catión metálico. Estos tienen la fórmula general M (OH) n. Es importante reconocer que los alcoholes, con la fórmula general ROH, son compuestos covalentes, no compuestos iónicos; en consecuencia, no se disocian en agua para formar una solución básica (que contiene iones OH −). Cuando una base reacciona con alguno de los ácidos que hemos comentado, acepta un protón (H +). Por ejemplo, el ion hidróxido (OH −) acepta un protón para formar H 2 O. Así, las bases también se conocen como aceptores de protones.
Las soluciones acuosas concentradas de amoníaco (NH 3) contienen cantidades significativas del ión hidróxido, aunque la sustancia disuelta no es principalmente hidróxido de amonio (NH 4 OH) como a menudo se indica en la etiqueta. Por lo tanto, la solución acuosa de amoníaco también es una base común. Reemplazar un átomo de hidrógeno de NH 3 por un grupo alquilo da como resultado una amina (RNH 2), que también es una base. Las aminas tienen olores picantes, por ejemplo, la metilamina (CH 3 NH 2) es uno de los compuestos responsables del mal olor asociado con el pescado en mal estado. La importancia fisiológica de las aminas se sugiere en la palabra vitamina, la cual se deriva de la frase aminas vitales. La palabra fue acuñada para describir sustancias dietéticas que fueron efectivas para prevenir el escorbuto, el raquitismo y otras enfermedades debido a que se suponía que estas sustancias eran aminas. Posteriormente, efectivamente se ha confirmado que algunas vitaminas son aminas.
Compuestos inorgánicos binarios
Los compuestos covalentes binarios —compuestos covalentes que contienen solo dos elementos— se nombran usando un procedimiento similar al utilizado para compuestos iónicos simples, pero se agregan prefijos según sea necesario para indicar el número de átomos de cada tipo. El procedimiento, esquematizado en la Figura,\(\PageIndex{2}\) consta de los siguientes pasos:
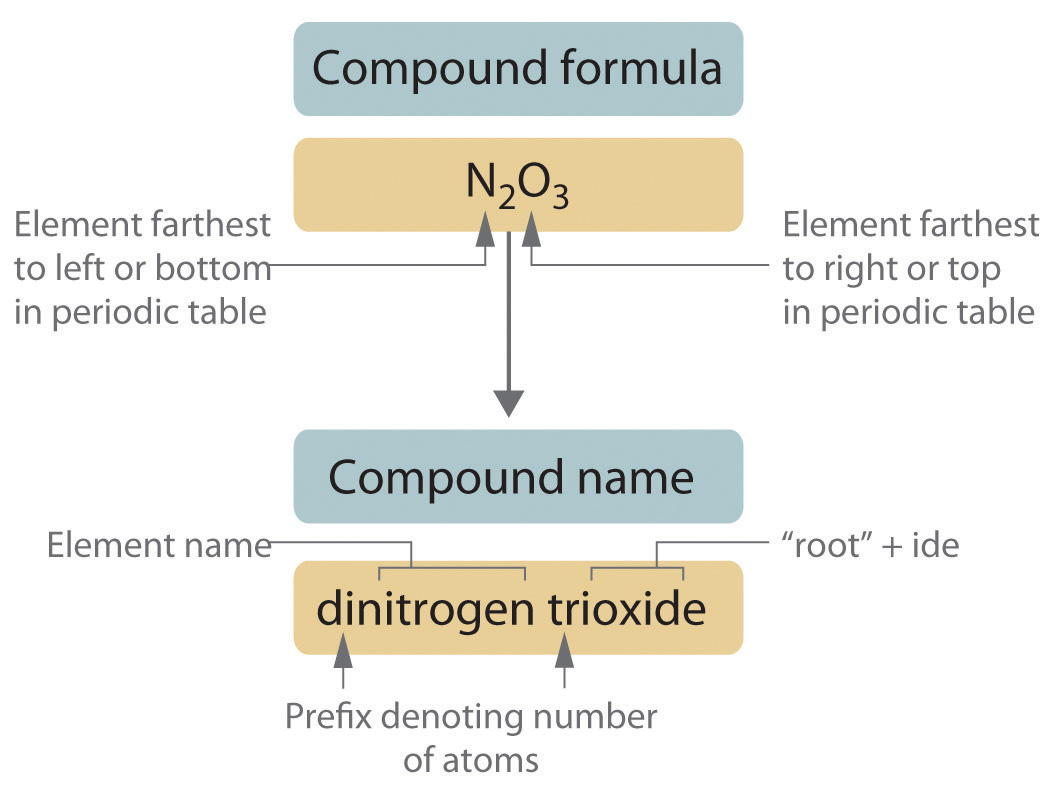
- Colocar los elementos en su orden adecuado.
- El elemento más alejado a la izquierda en la tabla periódica suele denominarse primero. Si ambos elementos están en el mismo grupo, el elemento más cercano a la parte inferior de la columna se nombra primero.
- El segundo elemento se nombra como si fuera un anión monoatómico en un compuesto iónico (aunque no lo sea), con el sufijo -ide unido a la raíz del nombre del elemento.
- Identificar el número de cada tipo de átomo presente.
- Los prefijos derivados de tallos griegos se utilizan para indicar el número de cada tipo de átomo en la fórmula unidad (Tabla\(\PageIndex{3}\)). El prefijo mono - (“uno”) se usa sólo cuando es absolutamente necesario para evitar confusiones, así como el subíndice 1 se omite al escribir fórmulas moleculares.
Para demostrar los pasos 1 y 2a, HCl se denomina cloruro de hidrógeno (porque el hidrógeno está a la izquierda del cloro en la tabla periódica), y PCl 5 es pentacloruro de fósforo. El orden de los elementos a nombre de BrF 3, trifluoruro de bromo, está determinado por el hecho de que el bromo se encuentra por debajo del flúor en el Grupo 17.
Tabla\(\PageIndex{3}\): Prefijos para indicar el número de átomos en nombres químicos Prefijo Número mono 1 di- 2 tri- 3 tetra 4 penta- 5 hexa- 6 hepta 7 octa 8 nona- 9 deca- 10 undeca- 11 dodeca- 12 - Si una molécula contiene más de un átomo de ambos elementos, entonces se utilizan prefijos para ambos. Así, N 2 O 3 es trióxido de di nitrógeno, como se muestra en la Figura 2.13.
- En algunos nombres, se deja caer la a u o final del prefijo para evitar una pronunciación incómoda. Por lo tanto, OsO 4 es tetróxido de osmio en lugar de tetraóxido de osmio.
- Los prefijos derivados de tallos griegos se utilizan para indicar el número de cada tipo de átomo en la fórmula unidad (Tabla\(\PageIndex{3}\)). El prefijo mono - (“uno”) se usa sólo cuando es absolutamente necesario para evitar confusiones, así como el subíndice 1 se omite al escribir fórmulas moleculares.
- Escriba el nombre del compuesto.
- Los compuestos binarios de los elementos con oxígeno generalmente se denominan “óxido de elemento”, con prefijos que indican el número de átomos de cada elemento por unidad de fórmula. Por ejemplo, el CO es monóxido de carbono. La única excepción son los compuestos binarios de oxígeno con flúor, los cuales se denominan fluoruros de oxígeno.
- Ciertos compuestos siempre son llamados por los nombres comunes que se asignaron antes de que se usaran las fórmulas. Por ejemplo, H 2 O es agua (no óxido de dihidrógeno); NH 3 es amoníaco; PH 3 es fosfina; SiH 4 es silano; y B 2 H 6, un dímero de BH 3, es diborano. Para muchos compuestos, el nombre sistemático y el nombre común se utilizan con frecuencia, requiriendo familiaridad con ambos. Por ejemplo, el nombre sistemático para NO es monóxido de nitrógeno, pero es mucho más comúnmente llamado óxido nítrico. Del mismo modo, el N 2 O se suele llamar óxido nitroso en lugar de monóxido de dinitrógeno. Observe que los sufijos - ic y - ous son los mismos que se utilizan para los compuestos iónicos.
Comience con el elemento en el extremo izquierdo en la tabla periódica y trabaje hacia la derecha. Si dos o más elementos están en el mismo grupo, comience con el elemento inferior y trabaje.
Escriba el nombre de cada compuesto covalente binario.
- SF 6
- N 2 O 4
- ClO 2
Dado: fórmula molecular
Preguntado por: nombre del compuesto
Estrategia:
- Listar los elementos en orden según sus posiciones en la tabla periódica. Identificar el número de cada tipo de átomo en la fórmula química y luego usar Tabla\(\PageIndex{2}\) para determinar los prefijos necesarios.
- Si el compuesto contiene oxígeno, siga el paso 3a. De no ser así, decidir si usar el nombre común o el nombre sistemático.
Solución:
- A Debido a que el azufre está a la izquierda del flúor en la tabla periódica, el azufre se nombra primero. Debido a que solo hay un átomo de azufre en la fórmula, no se necesita ningún prefijo. B Hay, sin embargo, seis átomos de flúor, por lo que usamos el prefijo para seis: hexa - (Tabla\(\PageIndex{2}\)). El compuesto es hexafluoruro de azufre.
- A Debido a que el nitrógeno está a la izquierda del oxígeno en la tabla periódica, el nitrógeno se nombra primero. Debido a que más de un átomo de cada elemento está presente, se necesitan prefijos para indicar el número de átomos de cada uno. Según Table\(\PageIndex{2}\) "Prefixes for Indicating the Number of Atoms in Chemical Names", el prefijo para dos es di -, y el prefijo para cuatro es tetra -. B El compuesto es tetroxido de dinitrógeno (omitiendo el a in tetra - según la etapa 2c) y se utiliza como componente de algunos combustibles para cohetes.
- A Aunque el oxígeno se encuentra a la izquierda del cloro en la tabla periódica, no se nombra primero porque ClO 2 es un óxido de un elemento distinto al flúor (paso 3a). En consecuencia, el cloro se nombra primero, pero no es necesario un prefijo porque cada molécula tiene sólo un átomo de cloro. B Debido a que hay dos átomos de oxígeno, el compuesto es un dióxido. Así, el compuesto es dióxido de cloro. Es ampliamente utilizado como sustituto del cloro en plantas de tratamiento de agua municipales ya que, a diferencia del cloro, no reacciona con compuestos orgánicos en el agua para producir compuestos clorados potencialmente tóxicos.
Escriba el nombre de cada compuesto covalente binario.
- SI 7
- N 2 O 5
- DE 2
- Contestar a
-
heptafluoruro de yodo
- Respuesta b
-
pentóxido de dinitrógeno
- Respuesta c
-
difluoruro de oxígeno
Escriba la fórmula para cada compuesto covalente binario.
- trióxido de azufre
- pentóxido de diyodo
Dado: nombre del compuesto
Preguntado por: fórmula
Estrategia:
Enumere los elementos en el mismo orden que en la fórmula, use Tabla\(\PageIndex{2}\) para identificar el número de cada tipo de átomo presente, y luego indicar esta cantidad como subíndice a la derecha de ese elemento al escribir la fórmula.
Solución:
- El azufre no tiene prefijo, lo que significa que cada molécula tiene solo un átomo de azufre. El prefijo tri - indica que hay tres átomos de oxígeno. Por lo tanto, la fórmula es SO 3. El trióxido de azufre se produce industrialmente en grandes cantidades como intermediario en la síntesis de ácido sulfúrico.
- El prefijo di - te dice que cada molécula tiene dos átomos de yodo, y el prefijo penta - indica que hay cinco átomos de oxígeno. La fórmula es así I 2 O 5, un compuesto utilizado para eliminar el monóxido de carbono del aire en los respiradores.
Escriba la fórmula para cada compuesto covalente binario.
- tetracloruro de silicio
- decafluoruro de disulfur
- Contestar a
-
SiCl 4
- Respuesta b
-
S 2 F 10
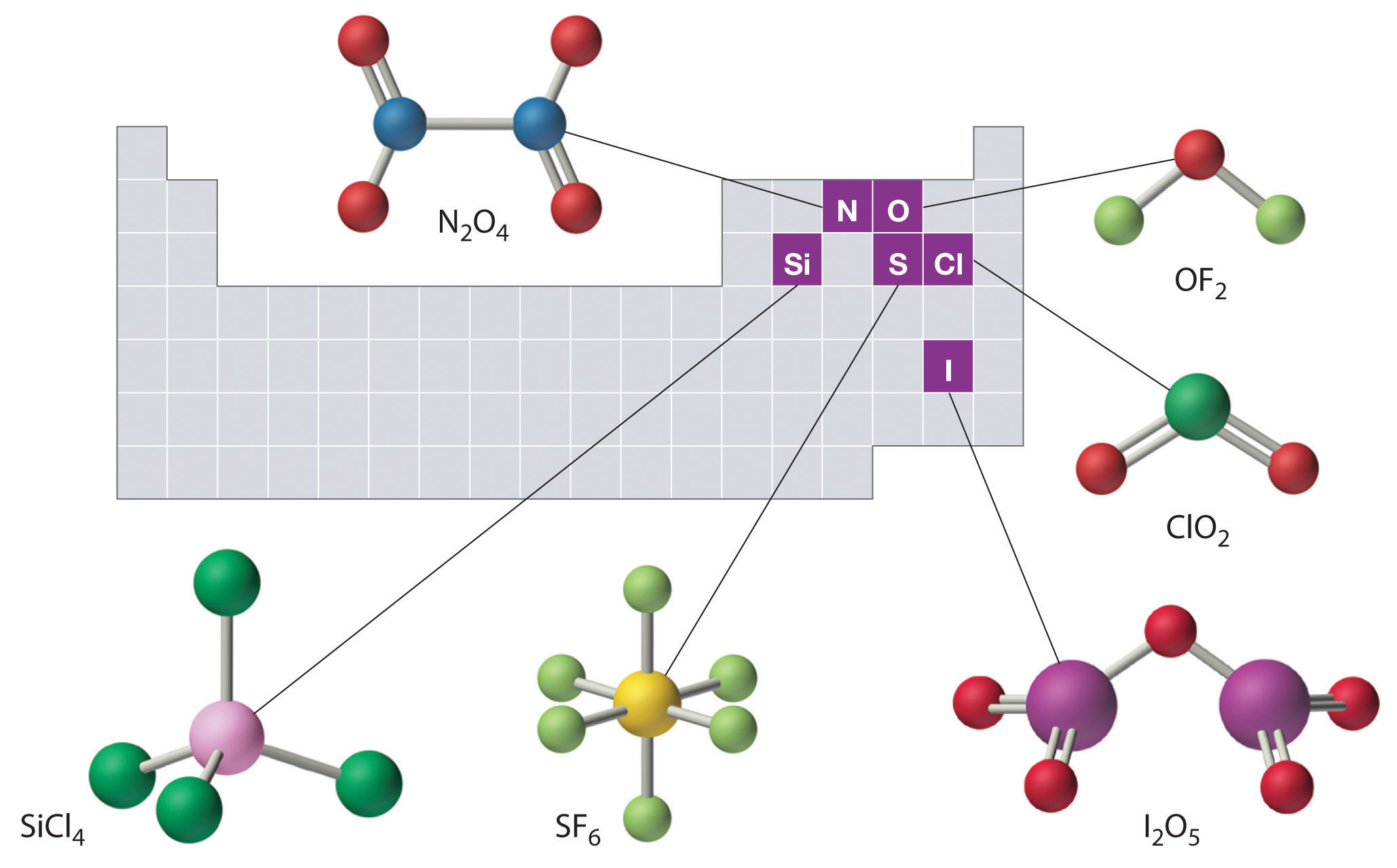
Las estructuras de algunos de los compuestos en los Ejemplos\(\PageIndex{3}\) y se\(\PageIndex{4}\) muestran en la Figura\(\PageIndex{2}\) junto con la ubicación del “átomo central” de cada compuesto en la tabla periódica. Puede parecer que las composiciones y estructuras de tales compuestos son completamente aleatorias, pero esto no es cierto. Después de dominar el material discutido más adelante en este curso, uno es capaz de predecir las composiciones y estructuras de compuestos de este tipo con un alto grado de precisión.
Nomenclatura de no metales: Nomenclatura de no metales, YouTube (opens in new window) [youtu.be] (opens in new window)
Resumen
La composición de un compuesto está representada por una fórmula empírica o molecular, cada una de las cuales consiste en al menos una unidad de fórmula. Los compuestos inorgánicos covalentes se nombran usando un procedimiento similar al utilizado para los compuestos iónicos, mientras que los hidrocarburos utilizan un sistema basado en el número de enlaces entre los átomos de carbono. Los compuestos inorgánicos covalentes son nombrados por un procedimiento similar al utilizado para los compuestos iónicos, usando prefijos para indicar los números de átomos en la fórmula molecular. Una fórmula empírica da los números relativos de átomos de los elementos en un compuesto, reducidos a los números enteros más bajos. La unidad de fórmula es el agrupamiento absoluto representado por la fórmula empírica de un compuesto, ya sea iónico o covalente. Las fórmulas empíricas son particularmente útiles para describir la composición de compuestos iónicos, que no contienen moléculas fácilmente identificables. Algunos compuestos iónicos se presentan como hidratos, que contienen proporciones específicas de moléculas de agua poco unidas llamadas aguas de hidratación.

