4.1: Concentración de la solución y el papel del agua como solvente
- Page ID
- 78500
- Describir cuantitativamente las concentraciones de soluciones
Muchas personas tienen una idea cualitativa de lo que se entiende por concentración. Cualquiera que haya hecho café instantáneo o limonada sabe que demasiado polvo da una bebida fuertemente aromatizada y altamente concentrada, mientras que muy poco da como resultado una solución diluida que puede ser difícil de distinguir del agua. En química, la concentración de una solución es la cantidad de un soluto que está contenido en una cantidad particular de disolvente o solución. Conocer la concentración de solutos es importante para controlar la estequiometría de los reactivos para reacciones en solución. Los químicos utilizan muchos métodos diferentes para definir las concentraciones, algunos de los cuales se describen en esta sección.
Molaridad
La unidad de concentración más común es la molaridad, que también es la más útil para los cálculos que involucran la estequiometría de reacciones en solución. La molaridad (M) se define como el número de moles de soluto presentes en exactamente 1 L de solución. Es, equivalentemente, el número de milimoles de soluto presentes en exactamente 1 mL de solución:
\[ molarity = \dfrac{moles\: of\: solute}{liters\: of\: solution} = \dfrac{mmoles\: of\: solute} {milliliters\: of\: solution} \label{4.5.1} \]
Las unidades de molaridad son, por lo tanto, moles por litro de solución (mol/L), abreviado como\(M\). Una solución acuosa que contiene 1 mol (342 g) de sacarosa en suficiente agua para dar un volumen final de 1.00 L tiene una concentración de sacarosa de 1.00 mol/L o 1.00 M. En notación química, los corchetes alrededor del nombre o fórmula del soluto representan la concentración molar de un soluto. Por lo tanto,
\[[\rm{sucrose}] = 1.00\: M \nonumber \]
se lee como “la concentración de sacarosa es de 1.00 molar”. Las relaciones entre el volumen, la molaridad y los moles pueden expresarse como
\[ V_L M_{mol/L} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = moles \label{4.5.2} \]
o
\[ V_{mL} M_{mmol/mL} = \cancel{mL} \left( \dfrac{mmol} {\cancel{mL}} \right) = mmoles \label{4.5.3} \]
La figura\(\PageIndex{1}\) ilustra el uso de Ecuaciones\(\ref{4.5.2}\) y\(\ref{4.5.3}\).

Calcular el número de moles de hidróxido de sodio (NaOH) en 2.50 L de NaOH 0.100 M.
Dado: identidad de soluto y volumen y molaridad de solución
Preguntado por: cantidad de soluto en moles
Estrategia:
Usa la Ecuación\ ref {4.5.2} o la Ecuación\ ref {4.5.3}, dependiendo de las unidades dadas en el problema.
Solución:
Debido a que se nos da el volumen de la solución en litros y se nos pide el número de moles de sustancia, la Ecuación\ ref {4.5.2} es más útil:
\( moles\: NaOH = V_L M_{mol/L} = (2 .50\: \cancel{L} ) \left( \dfrac{0.100\: mol } {\cancel{L}} \right) = 0 .250\: mol\: NaOH \)
Calcular el número de milimoles de alanina, una molécula biológicamente importante, en 27.2 mL de alanina 1.53 M.
- Responder
-
41.6 mmol
Cálculos que involucran molaridad (M): Cálculos que involucran molaridad (M), YouTube (opens in new window) [youtu.be]
Las concentraciones también se reportan a menudo sobre una base de masa a masa (m/m) o sobre una base de masa a volumen (m/v), particularmente en laboratorios clínicos y aplicaciones de ingeniería. Una concentración expresada en base m/m es igual al número de gramos de soluto por gramo de solución; una concentración en base m/v es el número de gramos de soluto por mililitro de solución. Cada medición se puede expresar como un porcentaje multiplicando la relación por 100; el resultado se reporta como porcentaje m/m o porcentaje m/v Las concentraciones de soluciones muy diluidas a menudo se expresan en partes por millón (ppm), que es gramos de soluto por 10 6 g de solución, o en partes por mil millones (ppb), que es gramos de soluto por 10 9 g de solución. Para soluciones acuosas a 20°C, 1 ppm corresponde a 1 μg por mililitro, y 1 ppb corresponde a 1 ng por mililitro. Estas concentraciones y sus unidades se resumen en la Tabla\(\PageIndex{1}\).
| Concentración | Unidades |
|---|---|
| m/m | g de soluto/g de solución |
| m/v | g de soluto/ml de solución |
| ppm | g de soluto/10 6 g de solución |
| μg/mL | |
| ppb | g de soluto/10 9 g de solución |
| ng/mL |
La preparación de soluciones
Para preparar una solución que contenga una concentración especificada de una sustancia, es necesario disolver el número deseado de moles de soluto en suficiente disolvente para dar el volumen final deseado de solución. La Figura\(\PageIndex{1}\) ilustra este procedimiento para una solución de cloruro de cobalto (II) dihidrato en etanol. Tenga en cuenta que no se especifica el volumen del disolvente. Debido a que el soluto ocupa espacio en la solución, el volumen del disolvente necesario es casi siempre menor que el volumen deseado de solución. Por ejemplo, si el volumen deseado fuera 1.00 L, sería incorrecto agregar 1.00 L de agua a 342 g de sacarosa porque eso produciría más de 1.00 L de solución. Como se muestra en la Figura\(\PageIndex{2}\), para algunas sustancias este efecto puede ser significativo, especialmente para soluciones concentradas.
La solución contiene 10.0 g de cloruro de cobalto (II) dihidrato, CoCl 2 •2H 2 O, en suficiente etanol para hacer exactamente 500 mL de solución. ¿Cuál es la concentración molar de\(\ce{CoCl2•2H2O}\)?
Dado: masa de soluto y volumen de solución
Preguntado por: concentración (M)
Estrategia:
Para encontrar el número de moles de\(\ce{CoCl2•2H2O}\), dividir la masa del compuesto por su masa molar. Calcular la molaridad de la solución dividiendo el número de moles de soluto por el volumen de la solución en litros.
Solución:
La masa molar de CoCl 2 •2H 2 O es 165.87 g/mol. Por lo tanto,
\[ moles\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10.0 \: \cancel{g}} {165 .87\: \cancel{g} /mol} \right) = 0 .0603\: mol \nonumber \]
El volumen de la solución en litros es
\[ volume = 500\: \cancel{mL} \left( \dfrac{1\: L} {1000\: \cancel{mL}} \right) = 0 .500\: L \nonumber \]
La molaridad es el número de moles de soluto por litro de solución, por lo que la molaridad de la solución es
\[ molarity = \dfrac{0.0603\: mol} {0.500\: L} = 0.121\: M = CoCl_2 \cdot H_2O \nonumber \]
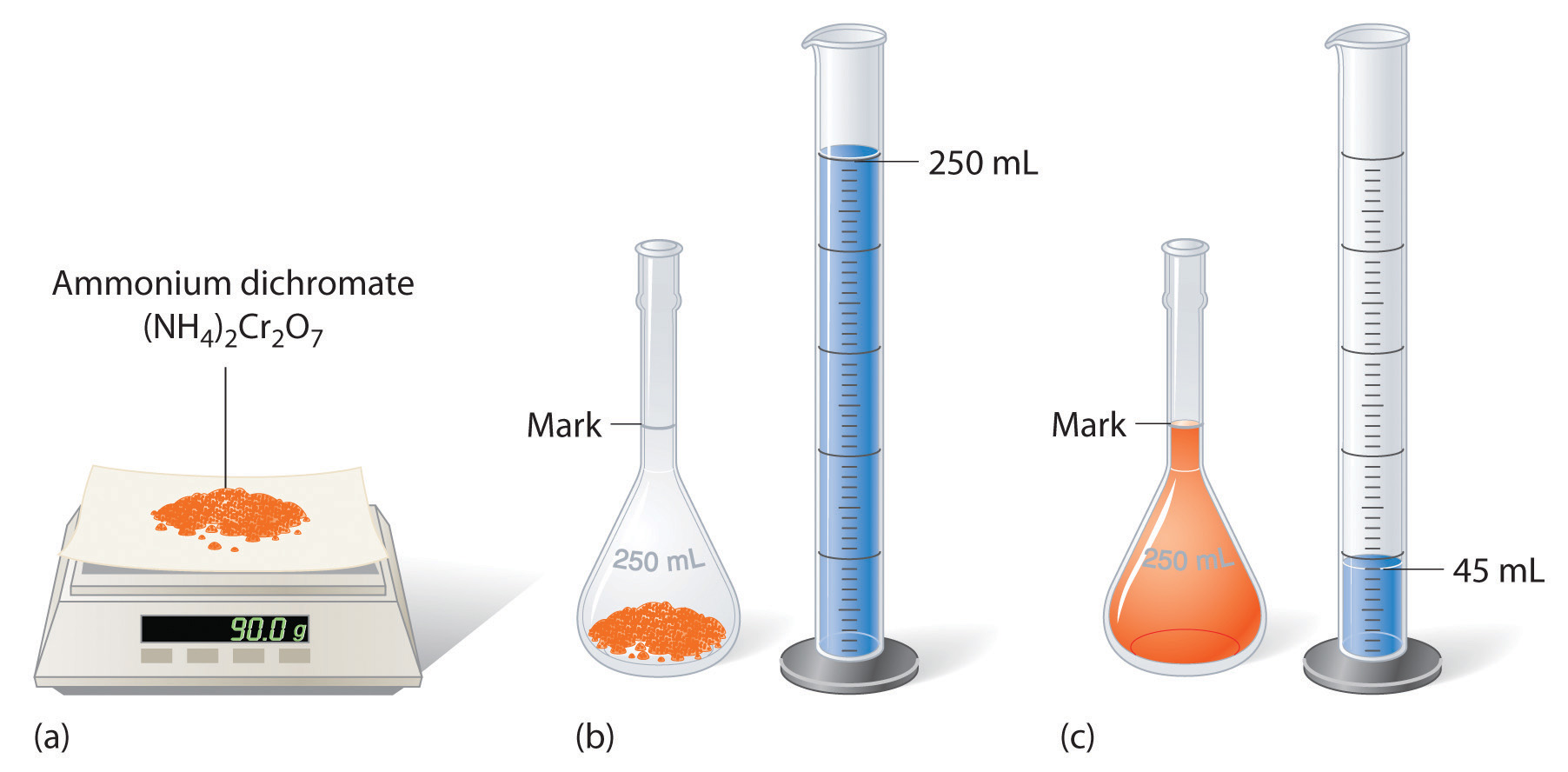
La solución mostrada en la Figura\(\PageIndex{2}\) contiene 90.0 g de (NH 4) 2 Cr 2 O 7 en agua suficiente para dar un volumen final de exactamente 250 mL. ¿Cuál es la concentración molar del dicromato amónico?
- Responder
-
\[(NH_4)_2Cr_2O_7 = 1.43\: M \nonumber \]
Para preparar un volumen particular de una solución que contenga una concentración especificada de un soluto, primero necesitamos calcular el número de moles de soluto en el volumen deseado de solución usando la relación que se muestra en la Ecuación\(\ref{4.5.2}\). Luego convertimos el número de moles de soluto a la masa correspondiente de soluto necesaria. Este procedimiento se ilustra en Ejemplo\(\PageIndex{3}\).
La llamada solución D5W utilizada para el reemplazo intravenoso de fluidos corporales contiene 0.310 M de glucosa. (D5W es una solución aproximadamente al 5% de dextrosa [el nombre médico de la glucosa] en agua.) Calcular la masa de glucosa necesaria para preparar una bolsa de 500 mL de D5W. La glucosa tiene una masa molar de 180.16 g/mol.
Dado: molaridad, volumen y masa molar de soluto
Preguntado por: masa de soluto
Estrategia:
- Calcular el número de moles de glucosa contenidos en el volumen especificado de solución multiplicando el volumen de la solución por su molaridad.
- Obtener la masa de glucosa necesaria multiplicando el número de moles del compuesto por su masa molar.
Solución:
A Primero debemos calcular el número de moles de glucosa contenidos en 500 mL de una solución 0.310 M:
\( V_L M_{mol/L} = moles \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0 .310\: mol\: glucose} {1\: \cancel{L}} \right) = 0 .155\: mol\: glucose \)
B Luego convertimos el número de moles de glucosa a la masa requerida de glucosa:
\( mass \: of \: glucose = 0.155 \: \cancel{mol\: glucose} \left( \dfrac{180.16 \: g\: glucose} {1\: \cancel{mol\: glucose}} \right) = 27.9 \: g \: glucose \)
Otra solución comúnmente utilizada para inyecciones intravenosas es la solución salina normal, una solución 0.16 M de cloruro de sodio en agua. Calcular la masa de cloruro de sodio necesaria para preparar 250 mL de solución salina normal.
- Responder
-
2.3 g de NaCl
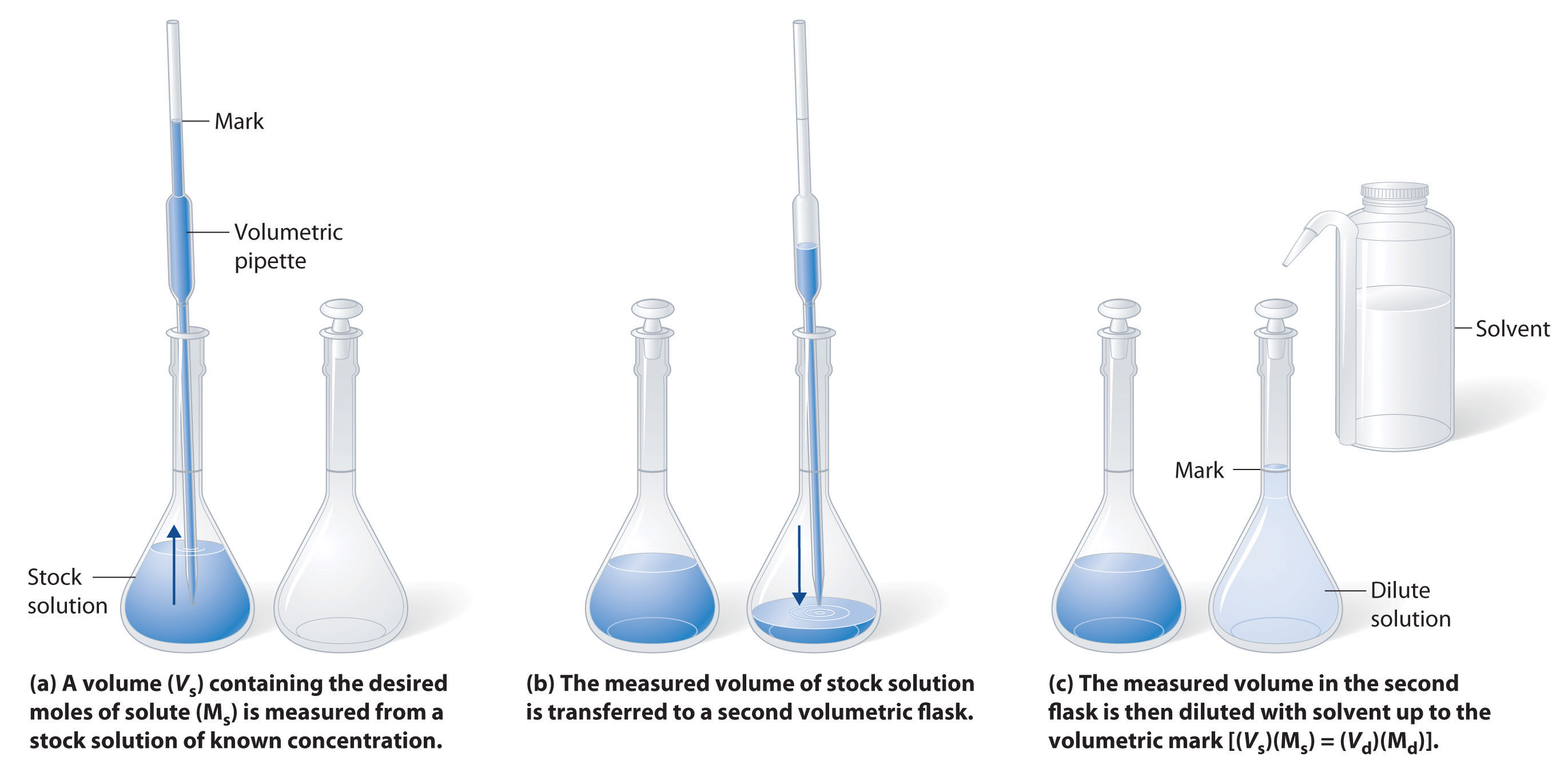
También se puede preparar una solución de una concentración deseada diluyendo un pequeño volumen de una solución más concentrada con disolvente adicional. Una solución madre es una solución preparada comercialmente de concentración conocida y a menudo se usa para este propósito. Se prefiere diluir una solución madre porque el método alternativo, que pesa pequeñas cantidades de soluto, es difícil de llevar a cabo con un alto grado de precisión. La dilución también se utiliza para preparar soluciones a partir de sustancias que se venden como soluciones acuosas concentradas, como los ácidos fuertes.
El procedimiento para preparar una solución de concentración conocida a partir de una solución madre se muestra en la Figura\(\PageIndex{3}\). Requiere calcular el número de moles de soluto deseados en el volumen final de la solución más diluida y luego calcular el volumen de la solución madre que contiene esta cantidad de soluto. Recuerde que diluir una cantidad dada de solución madre con disolvente no cambia el número de moles de soluto presentes. Por lo tanto, la relación entre el volumen y la concentración de la solución madre y el volumen y concentración de la solución diluida deseada es
\[(V_s)(M_s) = moles\: of\: solute = (V_d)(M_d)\label{4.5.4} \]
donde los subíndices s y d indican las soluciones madre y diluidas, respectivamente. Ejemplo\(\PageIndex{4}\) demuestra los cálculos involucrados en la dilución de una solución madre concentrada.
¿Qué volumen de una solución madre de glucosa 3.00 M es necesario para preparar 2500 mL de la solución D5W en el Ejemplo\(\PageIndex{3}\)?
Dado: volumen y molaridad de solución diluida
Preguntado por: volumen de solución de stock
Estrategia:
- Calcular el número de moles de glucosa contenidos en el volumen indicado de solución diluida multiplicando el volumen de la solución por su molaridad.
- Para determinar el volumen de solución madre necesario, divida el número de moles de glucosa por la molaridad de la solución madre.
Solución:
A La solución de D5W en el Ejemplo 4.5.3 fue de glucosa 0.310 M. Comenzamos usando la Ecuación 4.5.4 para calcular el número de moles de glucosa contenidos en 2500 mL de la solución:
\[ moles\: glucose = 2500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0 .310\: mol\: glucose} {1\: \cancel{L}} \right) = 0 .775\: mol\: glucose \nonumber \]
B Ahora debemos determinar el volumen de la solución madre 3.00 M que contiene esta cantidad de glucosa:
\[ volume\: of\: stock\: soln = 0 .775\: \cancel{mol\: glucose} \left( \dfrac{1\: L} {3 .00\: \cancel{mol\: glucose}} \right) = 0 .258\: L\: or\: 258\: mL \nonumber \]
Para determinar el volumen de solución madre que se necesitaba, tuvimos que dividir el número deseado de moles de glucosa por la concentración de la solución madre para obtener las unidades adecuadas. Además, el número de moles de soluto en 258 mL de la solución madre es el mismo que el número de moles en 2500 mL de la solución más diluida; sólo la cantidad de solvente ha cambiado. La respuesta que obtuvimos tiene sentido: diluir la solución madre aproximadamente diez veces aumenta su volumen en aproximadamente un factor de 10 (258 mL → 2500 mL). En consecuencia, la concentración del soluto debe disminuir en aproximadamente un factor de 10, como lo hace (3.00 M → 0.310 M).
También podríamos haber resuelto este problema en un solo paso resolviendo la Ecuación 4.5.4 para V s y sustituyendo los valores apropiados:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s} = \dfrac{(2 .500\: L)(0 .310\: \cancel{M} )} {3 .00\: \cancel{M}} = 0 .258\: L \nonumber \]
Como hemos señalado, muchas veces hay más de una forma correcta de resolver un problema.
¿Qué volumen de una solución madre de NaCl 5.0 M es necesario para preparar 500 mL de solución salina normal (NaCl 0.16 M)?
- Responder
-
16 mL
Concentraciones de iones en solución
En Ejemplo\(\PageIndex{2}\), se calculó que la concentración de una solución que contenía 90.00 g de dicromato amónico en un volumen final de 250 mL fue de 1.43 M. Consideremos con más detalle exactamente lo que eso significa. Dicromato de amonio es un compuesto iónico que contiene dos iones NH 4 + y un ion Cr 2 O 7 2 − por unidad de fórmula. Al igual que otros compuestos iónicos, es un electrolito fuerte que se disocia en solución acuosa para dar iones NH 4 + y Cr 2 O 7 2 − hidratados:
\[ (NH_4 )_2 Cr_2 O_7 (s) \xrightarrow {H_2 O(l)} 2NH_4^+ (aq) + Cr_2 O_7^{2-} (aq)\label{4.5.5} \]
Así, 1 mol de unidades de fórmula dicromato amónico se disuelve en agua para producir 1 mol de aniones Cr 2 O 7 2 − y 2 mol de cationes NH 4 + (ver Figura\(\PageIndex{4}\)).
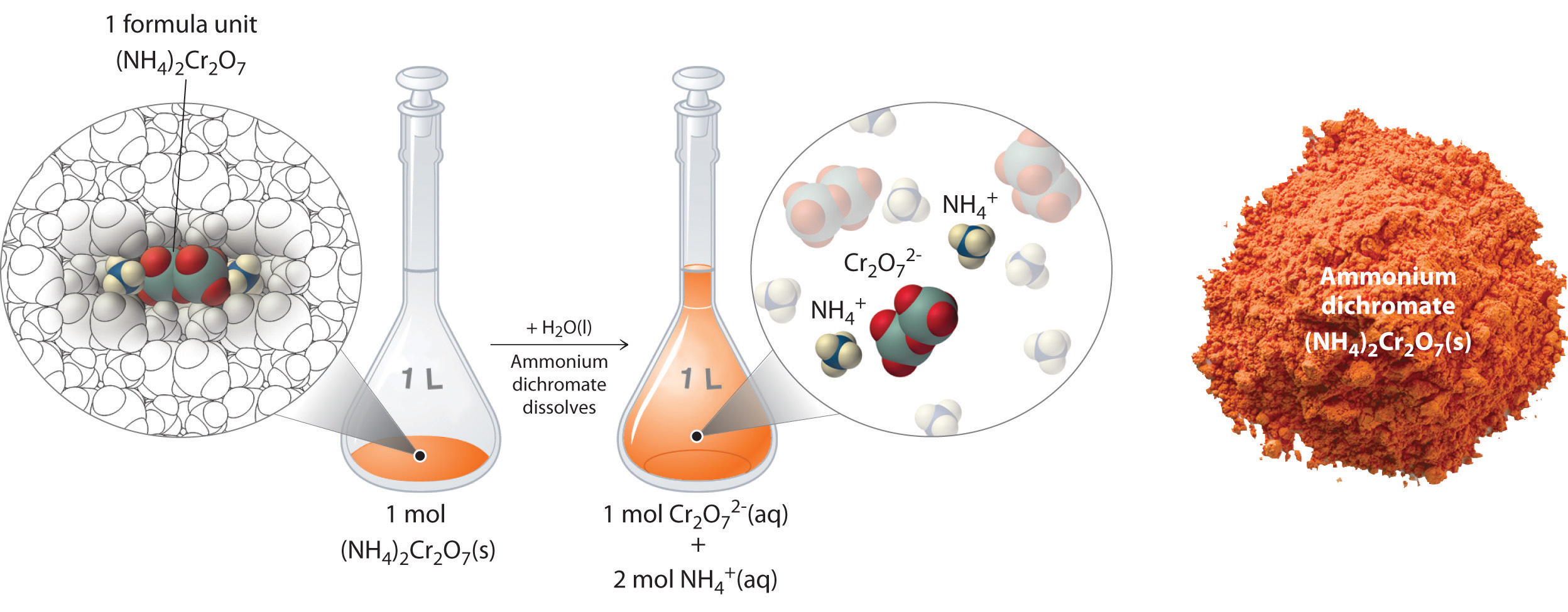
Al realizar una reacción química utilizando una solución de una sal como el dicromato amónico, es importante conocer la concentración de cada ion presente en la solución. Si una solución contiene 1.43 M (NH 4) 2 Cr 2 O 7, entonces la concentración de Cr 2 O 7 2 − también debe ser 1.43 M porque hay un ion Cr 2 O 7 2 − por fórmula unidad. Sin embargo, hay dos iones NH 4 + por unidad de fórmula, por lo que la concentración de iones NH 4 + es de 2 × 1.43 M = 2.86 M. Debido a que cada unidad de fórmula de (NH 4) 2 Cr 2 O 7 produce tres iones cuando disuelto en agua (2NH 4 + + 1Cr 2 O 7 2 −), la concentración total de iones en la solución es de 3 × 1.43 M = 4.29 M.
Concentración de iones en solución a partir de una sal soluble: concentración de iones en solución a partir de una sal soluble, YouTube (opens in new window) [youtu.be]
¿Cuáles son las concentraciones de todas las especies derivadas de los solutos en estas soluciones acuosas?
- NaOH 0.21 M
- 3.7 M (CH 3) 2 CHOH
- 0.032 M En (NO 3) 3
Dado: molaridad
Preguntado por: concentraciones
Estrategia:
A Clasifique cada compuesto como un electrolito fuerte o un no electrolito.
B Si el compuesto es un no electrolito, su concentración es la misma que la molaridad de la solución. Si el compuesto es un electrolito fuerte, determine el número de cada ion contenido en una unidad de fórmula. Encontrar la concentración de cada especie multiplicando el número de cada ion por la molaridad de la solución.
Solución:
- El hidróxido de sodio es un compuesto iónico que es un electrolito fuerte (y una base fuerte) en solución acuosa:\( NaOH(s) \xrightarrow {H_2 O(l)} Na^+ (aq) + OH^- (aq) \)
B Debido a que cada unidad de fórmula de NaOH produce un ion Na + y un ion OH −, la concentración de cada ion es la misma que la concentración de NaOH: [Na +] = 0.21 M y [OH −] = 0.21 M.
- A La fórmula (CH 3) 2 CHOH representa 2-propanol (alcohol isopropílico) y contiene el grupo —OH, por lo que es un alcohol. Recordemos de la Sección 4.1 que los alcoholes son compuestos covalentes que se disuelven en agua para dar soluciones de moléculas neutras. Así, los alcoholes no son electrolitos.
B La única especie de soluto en solución es por lo tanto (CH 3) 2 moléculas CHOH, por lo que [(CH 3) 2 CHOH] = 3.7 M.
- Un nitrato de indio es un compuesto iónico que contiene iones In 3 + y iones NO 3 −, por lo que esperamos que se comporte como un electrolito fuerte en solución acuosa:
\( In(NO _3 ) _3 (s) \xrightarrow {H_ 2 O(l)} In ^{3+} (aq) + 3NO _3^- (aq) \)
B Una unidad de fórmula de In (NO 3) 3 produce un ion In 3 + y tres iones NO 3 −, por lo que una solución de 0.032 M In (NO 3) 3 contiene 0.032 M In 3 + y 3 × 0.032 M = 0.096 M NO 3 — —es decir, [En 3 +] = 0.032 M y [NO 3 −] = 0.096 M.
¿Cuáles son las concentraciones de todas las especies derivadas de los solutos en estas soluciones acuosas?
- 0.0012 M Ba (OH) 2
- 0.17 M Na 2 SO 4
- 0.50 M (CH 3) 2 CO, comúnmente conocido como acetona
- Responder a
-
\([Ba^{2+}] = 0.0012\: M; \: [OH^-] = 0.0024\: M\)
- Respuesta b
-
\([Na^+] = 0.34\: M; \: [SO_4^{2-}] = 0.17\: M\)
- Respuesta c
-
\([(CH_3)_2CO] = 0.50\: M\)
Resumen
Las concentraciones de solución se expresan típicamente como molaridades y se pueden preparar disolviendo una masa conocida de soluto en un disolvente o diluyendo una solución madre.
- definición de molaridad:\[ molarity = \dfrac{moles\: of\: solute}{liters\: of\: solution} = \dfrac{mmoles\: of\: solute} {milliliters\: of\: solution} \nonumber \]
- relación entre volumen, molaridad y moles:\[ V_L M_{mol/L} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = moles \nonumber \]
- relación entre volumen y concentración de stock y soluciones diluidas:\[(V_s)(M_s) = moles\: of\: solute = (V_d)(M_d) \nonumber \]
La concentración de una sustancia es la cantidad de soluto presente en una cantidad dada de solución. Las concentraciones generalmente se expresan en términos de molaridad, definida como el número de moles de soluto en 1 L de solución. Las soluciones de concentración conocida se pueden preparar ya sea disolviendo una masa conocida de soluto en un disolvente y diluyendo hasta un volumen final deseado o diluyendo el volumen apropiado de una solución más concentrada (una solución madre) hasta el volumen final deseado.
Colaboradores y Atribuciones
Modified by Joshua Halpern (Howard University)

