8.E: Configuración Electrónica y Periodicidad Química (Ejercicios)
- Page ID
- 78819
7.1: Elaboración de la Tabla Periódica
Problemas conceptuales
- A Johannes Dobereiner se le atribuye el desarrollo del concepto de tríadas químicas. ¿Cuál de los 15 elementos del grupo esperarías para componer una tríada? ¿Esperarías que B, Al y Ga actúen como tríada? Justifica tus respuestas.
- A pesar de que Dobereiner, Newlands, Meyer y Mendeleev contribuyeron al desarrollo de la tabla periódica moderna, Mendeleev se le atribuye su origen. ¿Por qué se aceptó tan rápidamente la tabla periódica de Mendeleev?
- ¿Cómo explicó la contribución de Moseley al desarrollo de la tabla periódica la ubicación de los gases nobles?
- Se utilizó el esquema de nomenclatura eka ideado por Mendeleev para describir elementos no descubiertos.
- Utilice este método de nomenclatura para predecir el número atómico de eka -mercurio, eka -astatino, eka -talio y eka -hafnio.
- Usando el prefijo eka, identifique los elementos con estos números atómicos: 79, 40, 51, 117 y 121.
Problema Numérico
- Con base en los datos dados, complete la tabla.
Especies Masa molar (g/mol) Densidad (g/cm3) Volumen molar (cm3/mol) A 40.078 25.85 B 39.09 0.856 C 32.065 16.35 D 1.823 16.98 E 26.98 9.992 F 22.98 0.968 Trazar volumen molar versus masa molar para estas sustancias. Según Meyer, ¿cuáles serían considerados metales y cuáles serían considerados no metales?
Respuesta Numérica
-
Especies Masa molar (g/mol) Densidad (g/cm 3) Volumen molar (cm 3 /mol) A 40.078 1.550 25.85 B 39.09 0.856 45.67 C 32.065 1.961 16.35 D 30.95 1.823 16.98 E 26.98 2.700 9.992 F 22.98 0.968 23.7 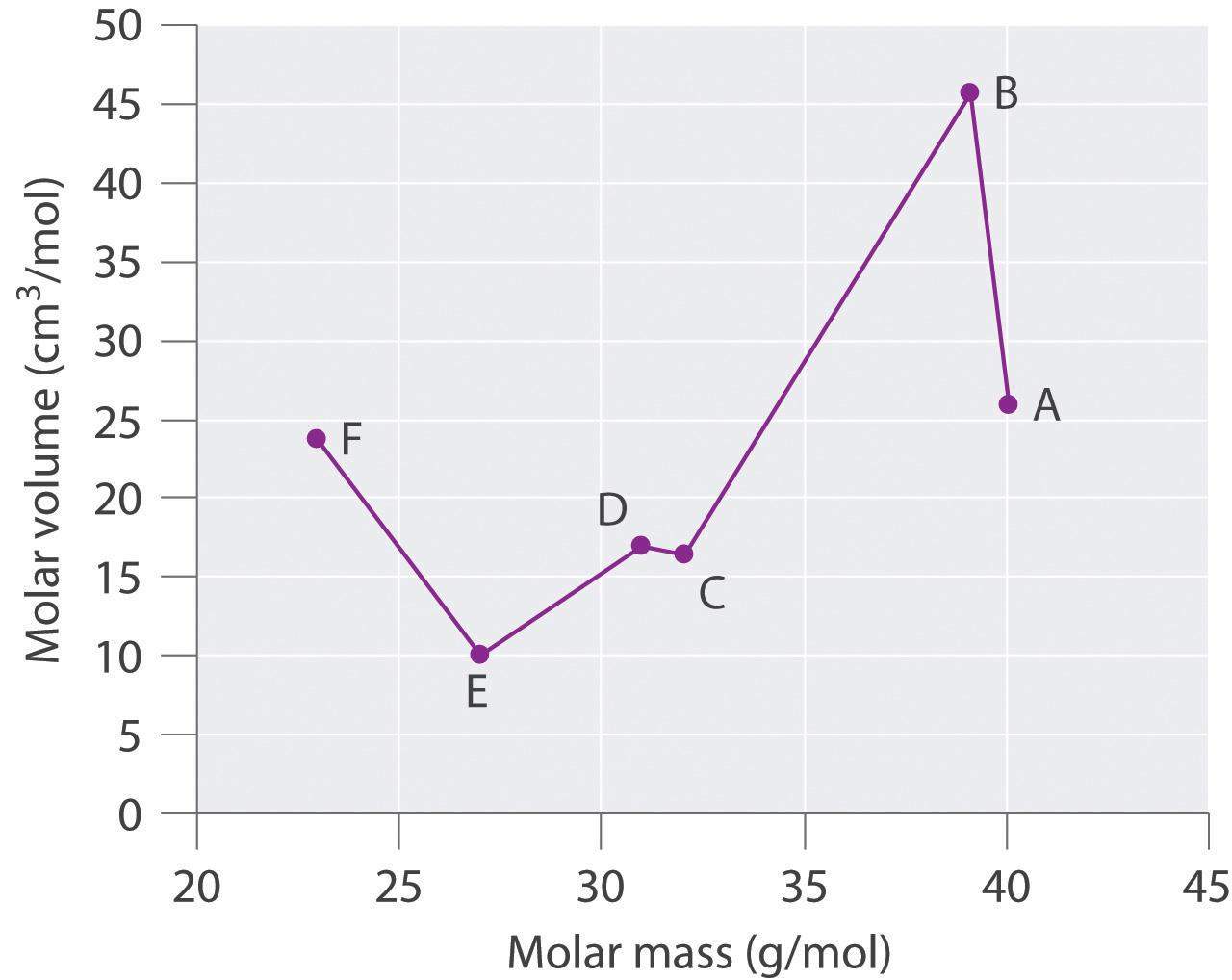
-
Meyer encontró que los metales alcalinos tenían los volúmenes molares más altos, y que los volúmenes molares disminuyeron de manera constante al aumentar la masa atómica, luego se nivelaron y finalmente volvieron a subir. Los elementos ubicados en la porción ascendente de una parcela de volumen molar versus masa molar fueron típicamente no metales. Si observamos la gráfica de los datos en la tabla, podemos identificar inmediatamente aquellos elementos con los mayores volúmenes molares (A, B, F) como metales ubicados en el lado izquierdo de la tabla periódica. El elemento con el menor volumen molar (E) es el aluminio. La gráfica muestra que los elementos posteriores (C, D) tienen volúmenes molares que son mayores que los de E, pero menores que los de A y B. Así, C y D tienen más probabilidades de ser no metales (que es el caso: C = azufre, D = fósforo).
7.2: Carga Nuclear Efectiva
Problemas conceptuales
-
¿Qué sucede con la energía de una órbita dada a medida que aumenta la carga nuclear Z de una especie? En un átomo multielectrón y para una carga nuclear dada, el eff Z experimentado por un electrón depende de su valor de l. ¿Por qué?
-
La densidad electrónica de un átomo particular se divide en dos regiones generales. Nombra estas dos regiones y describe lo que representa cada una.
-
A medida que aumenta el número cuántico principal, disminuye la diferencia de energía entre los sucesivos niveles de energía. ¿Por qué? ¿Qué pasaría con las configuraciones electrónicas de los metales de transición si no se produjera esta disminución?
-
Describir la relación entre blindaje electrónico y Z eff en los electrones más externos de un átomo. Predecir cómo la reactividad química se ve afectada por una disminución de la carga nuclear efectiva.
-
Si un átomo o ion dado tiene un solo electrón en cada una de las subcáscaras siguientes, ¿qué electrón es más fácil de eliminar?
- 2 s, 3 s
- 3 p, 4 d
- 2 p, 1 s
- 3 d, 4 s
7.3: Tamaños de átomos e iones
Problemas conceptuales
-
Los electrones de la cáscara de 1 s tienen una atracción electrostática más fuerte hacia el núcleo que los electrones en la capa de 2 s. Dar dos razones para ello.
-
Predice si Na o Cl tiene el shell 1 s 2 más estable y explica tu justificación.
-
Organizar K, F, Ba, Pb, B e I en orden de radio atómico decreciente.
-
Organizar Ag, Pt, Mg, C, Cu y Si en orden de aumentar el radio atómico.
-
Usando la tabla periódica, organice Li, Ga, Ba, Cl y Ni en orden de aumentar el radio atómico.
-
El elemento M es un metal que forma compuestos del tipo MX 2, MX 3 y MX 4, donde X es un halógeno. ¿Cuál es la tendencia esperada en el radio iónico de M en estos compuestos? Organizar estos compuestos en orden decreciente del radio iónico de M.
-
Los radios atómicos de Na y Cl son 190 y 79 pm, respectivamente, pero la distancia entre sodio y cloro en NaCl es de 282pm. Explique esta discrepancia.
-
¿Los efectos de blindaje en el radio atómico son más pronunciados en una fila o en un grupo? ¿Por qué?
-
¿Qué dos factores influyen en el tamaño de un ion en relación con el tamaño de su átomo padre? ¿Esperaría que el radio iónico de S2 − sea el mismo tanto en MG como en Na 2 S? ¿Por qué o por qué no?
-
Organizar Br −, Al 3 +, Sr 2 +, F −, O 2− y I − en orden de aumentar el radio iónico.
-
Organizar P 3−, N 3−, Cl −, In 3 + y S2 − en orden decreciente del radio iónico.
-
¿En qué se diferencia una serie isoelectrónica de una serie de iones con la misma carga? ¿Los cationes en magnesio, estroncio y sulfato de potasio forman una serie isoelectrónica? ¿Por qué o por qué no?
-
¿Qué series isoelectrónicas surgen del flúor, nitrógeno, magnesio y carbono? Organizar los iones de esta serie
- aumento de la carga nuclear.
- aumentando el tamaño.
-
¿Cuál sería la configuración de carga y electrones de un ion formado a partir de calcio que es isoelectrónico con
- un ion cloruro?
- Ar +?
Respuestas conceptuales
-
La cáscara de 1 s está más cerca del núcleo y por lo tanto experimenta una mayor atracción electrostática. Además, los electrones en la subcapa de 2 s están protegidos por la capa llena de 1 s 2, lo que disminuye aún más la atracción electrostática hacia el núcleo.
-
Ba > K > Pb > I > B > F
-
La suma de los radios atómicos calculados de átomos de sodio y cloro es de 253pm. El catión de sodio es significativamente menor que un átomo de sodio neutro (102 frente a 154pm), debido a la pérdida del electrón único en el orbital de 3 s. Por el contrario, el ion cloruro es mucho más grande que un átomo de cloro neutro (181 versus 99 pm), porque el electrón agregado da como resultado repulsiones electrones-electrón muy aumentadas dentro de la capa principal llena de n = 3. Así, la transferencia de un electrón del sodio al cloro disminuye el radio de sodio en aproximadamente 50%, pero hace que el radio de cloro casi se duplique. El efecto neto es que la distancia entre un ion sodio y un ion cloruro en NaCl es mayor que la suma de los radios atómicos de los átomos neutros.
Problemas numéricos
-
Trazar la carga iónica versus el radio iónico utilizando los siguientes datos para Mo: Mo 3 +, 69 pm; Mo 4 +, 65 pm; y Mo 5 +, 61 pm. Luego usa esta gráfica para predecir el radio iónico de Mo 6 +. ¿La tendencia observada es consistente con las tendencias generales discutidas en el capítulo? ¿Por qué o por qué no?
-
Las distancias internucleares para compuestos iónicos seleccionados se dan en la siguiente tabla.
-
Si el radio iónico de Li + es 76 pm, ¿cuál es el radio iónico de cada uno de los aniones?
LiF LiCl LiBr LiI Distancia (pm) 209 257 272 296
-
-
¿Cuál es el radio iónico de Na +?
NaF NaCl NaBr NaI Distancia (pm) 235 282 298 322 -
Organice las especies gaseosas Mg 2 +, P 3−, Br −, S 2−, F − y N 3− en orden de radio creciente y justifique sus decisiones.
7.4: Energía de ionización
Problemas conceptuales
-
Identifica cada afirmación como verdadera o falsa y explica tu razonamiento.
- Las energías de ionización aumentan con el radio atómico.
- Las energías de ionización disminuyen en un grupo.
- Las energías de ionización aumentan con un aumento en la magnitud de la afinidad electrónica.
- Las energías de ionización disminuyen diagonalmente a través de la tabla periódica de He a Cs.
- Las energías de ionización dependen de la configuración electrónica.
- Las energías de ionización disminuyen a lo largo de una fila.
-
A partir de configuraciones electrónicas, explicar por qué las primeras energías de ionización del grupo 16 elementos son menores que las del grupo 15 elementos, lo que es contrario a la tendencia general.
-
La primera a la tercera energías de ionización no varían mucho a través de los lantánidos. ¿Por qué? ¿Cómo cambia la carga nuclear efectiva que experimenta el electrón n s al ir de izquierda a derecha (con un número atómico creciente) en esta serie?
-
La mayoría de los metales de transición de la primera fila pueden formar al menos dos cationes estables, por ejemplo hierro (II) y hierro (III). En contraste, el escandio y el zinc forman cada uno solo un solo catión, los iones Sc 3+ y Zn 2+, respectivamente. Utilice la configuración electrónica de estos elementos para proporcionar una explicación.
-
De los elementos Nd, Al y Ar, ¿cuáles formarán fácilmente +3 iones? ¿Por qué?
-
Las energías orbitales pueden revertirse cuando un elemento está ionizado. De los iones B 3+, Ga 3+, Pr 3+, Cr 3+, y As 3+, ¿en qué esperarías que ocurriera esta inversión? Explica tu razonamiento.
-
Las tendencias periódicas en las afinidades electrónicas no son tan regulares como las tendencias periódicas en las energías de ionización, aunque los procesos son esencialmente lo contrario entre sí. ¿Por qué hay tantas más excepciones a las tendencias de afinidades electrónicas en comparación con las energías de ionización?
-
Los elementos que se encuentran en una línea diagonal inferior derecha a superior izquierda no pueden disponerse en orden de aumentar la electronegatividad de acuerdo a donde ocurran en la tabla periódica. ¿Por qué?
-
¿Por qué se forman los compuestos iónicos, si se requiere energía para formar cationes gaseosos?
-
¿Por qué se considera que la definición de electronegatividad de Pauling es algo limitada?
-
Con base en sus posiciones en la tabla periódica, organice Sb, O, P, Mo, K y H en orden de creciente electronegatividad.
-
Con base en sus posiciones en la tabla periódica, organice V, F, B, In, Na y S en orden decreciente de electronegatividad.
Respuestas conceptuales
5. Tanto Al como Nd formarán un catión con una carga +3. El aluminio está en el Grupo 13, y la pérdida de los tres electrones de valencia producirá el ion Al 3+ con una configuración de gas noble. El neodimio es un lantánido, y todos los lantánidos tienden a formar +3 iones porque los potenciales de ionización no varían mucho a lo largo de la fila, y se puede lograr una carga +3 con muchos oxidantes.
11. K < Mo ≈ Sb < P ≈ H < O
Problemas numéricos
-
La siguiente tabla da los valores de la primera y tercera energías de ionización para elementos seleccionados:
Número de electrones Elemento I 1 (E → E + + e −, kJ/mol) Elemento I 3 (E 2+ → E 3+ + e −, kJ/mol) 11 Na 495.9 Al 2744.8 12 Mg 737.8 Si 3231.6 13 Al 577.6 P 2914.1 14 Si 786.6 S 3357 15 P 1011.9 Cl 3822 16 S 999.6 Ar 3931 17 Cl 1251.2 K 4419.6 18 Ar 1520.6 Ca 4912.4 Trazar las energías de ionización versus el número de electrones. Explique por qué las pendientes de las parcelas I 1 e I 3 son diferentes, aunque las especies en cada fila de la tabla tengan las mismas configuraciones de electrones.
-
¿Esperaría que la tercera energía de ionización del hierro, correspondiente a la eliminación de un electrón de un ion Fe 2+ gaseoso, sea mayor o menor que la cuarta energía de ionización, correspondiente a la eliminación de un electrón de un ion Fe 3+ gaseoso? ¿Por qué? ¿Cómo se compararían estas energías de ionización con la primera energía de ionización del Ca?
-
¿Cuál esperarías que tuviera la mayor energía de primera ionización: Mg, Al o Si? Que esperarías que tuviera la tercera energía de ionización más alta. ¿Por qué?
-
Utilizar los valores de las primeras energías de ionización dados en la Figura 7.11 para construir gráficas de la primera energía de ionización versus número atómico para (a) boro a través del oxígeno en el segundo período; y (b) oxígeno a través del teluro en el grupo 16. ¿Qué parcela muestra más variación? Explicar la razón de la variación en las primeras energías de ionización para este grupo de elementos.
-
Organizar Ga, In y Zn en orden de aumentar las energías de primera ionización. ¿El orden sería el mismo para la segunda y tercera energías de ionización? Explica tu razonamiento.
-
Organizar cada conjunto de elementos en orden de magnitud creciente de afinidad electrónica.
- Pb, Bi y Te
- Na, K y Rb
- P, C y Ge
-
Organizar cada conjunto de elementos en orden de magnitud decreciente de afinidad electrónica.
- As, Bi y N
- O, F y Ar
- Cs, Ba y Rb
-
De las especies F, O −, Al 3+ y Li +, ¿cuál tiene la mayor afinidad electrónica? Explica tu razonamiento.
-
De las especies O −, N 2−, Hg 2+ y H +, ¿cuál tiene la mayor afinidad electrónica? ¿Cuál tiene la afinidad electrónica más baja? Justifica tus respuestas.
-
La electronegatividad de Mulliken del elemento A es 542 kJ/mol. Si la afinidad electrónica de A es −72 kJ/mol, ¿cuál es la primera energía de ionización del elemento A? Utilice los datos de la siguiente tabla como guía para decidir si A es un metal, un no metal o un semimetal. Si 1 g de A contiene 4.85 × 10 21 moléculas, ¿cuál es la identidad del elemento A?
Na Al Si S Cl EA (kJ/mol) −59.6 −41.8 −134.1 −200.4 −348.6 I (kJ/mol) 495.8 577.5 786.5 999.6 1251.2 -
Con base en sus configuraciones de electrones de valencia, clasifican los siguientes elementos como aislantes eléctricos, conductores eléctricos o sustancias con conductividad intermedia: S, Ba, Fe, Al, Te, Be, O, C, P, Sc, W, Na, B y Rb.
-
Utilizando los datos del Problema 10, ¿qué conclusiones puedes sacar con respecto a la relación entre la electronegatividad y las propiedades eléctricas? Estimar la electronegatividad aproximada de un elemento puro que es muy denso, lustroso y maleable.
-
De los elementos Al, Mg, O 2, Ti, I 2, y H 2, que, en su caso, ¿esperaría que fuera un buen reductor? Explica tu razonamiento.
-
De los elementos Zn, B, Li, Se, Co y Br 2, que de haberlos, ¿esperarías que fuera un buen oxidante? Explica tu razonamiento.
-
Determinar si cada especie es un buen oxidante, un buen reductor, o ninguno.
- Ba
- Mo
- Al
- Ni
- O 2
- Xe
-
Determinar si cada especie es un buen oxidante, un buen reductor, o ninguno.
- Ir
- Cs
- Be
- B
- N
- Po
- Ne
-
De las especies I 2, O −, Zn, Sn 2+ y K +, elige cuál esperarías que sea un buen oxidante. Entonces justifica tu respuesta.
- Con base en la configuración electrónica de valencia de los gases nobles, ¿esperaría que tuvieran afinidades electrónicas positivas o negativas? ¿Qué implica esto sobre sus estados de oxidación más probables? su reactividad?
Respuestas numéricas
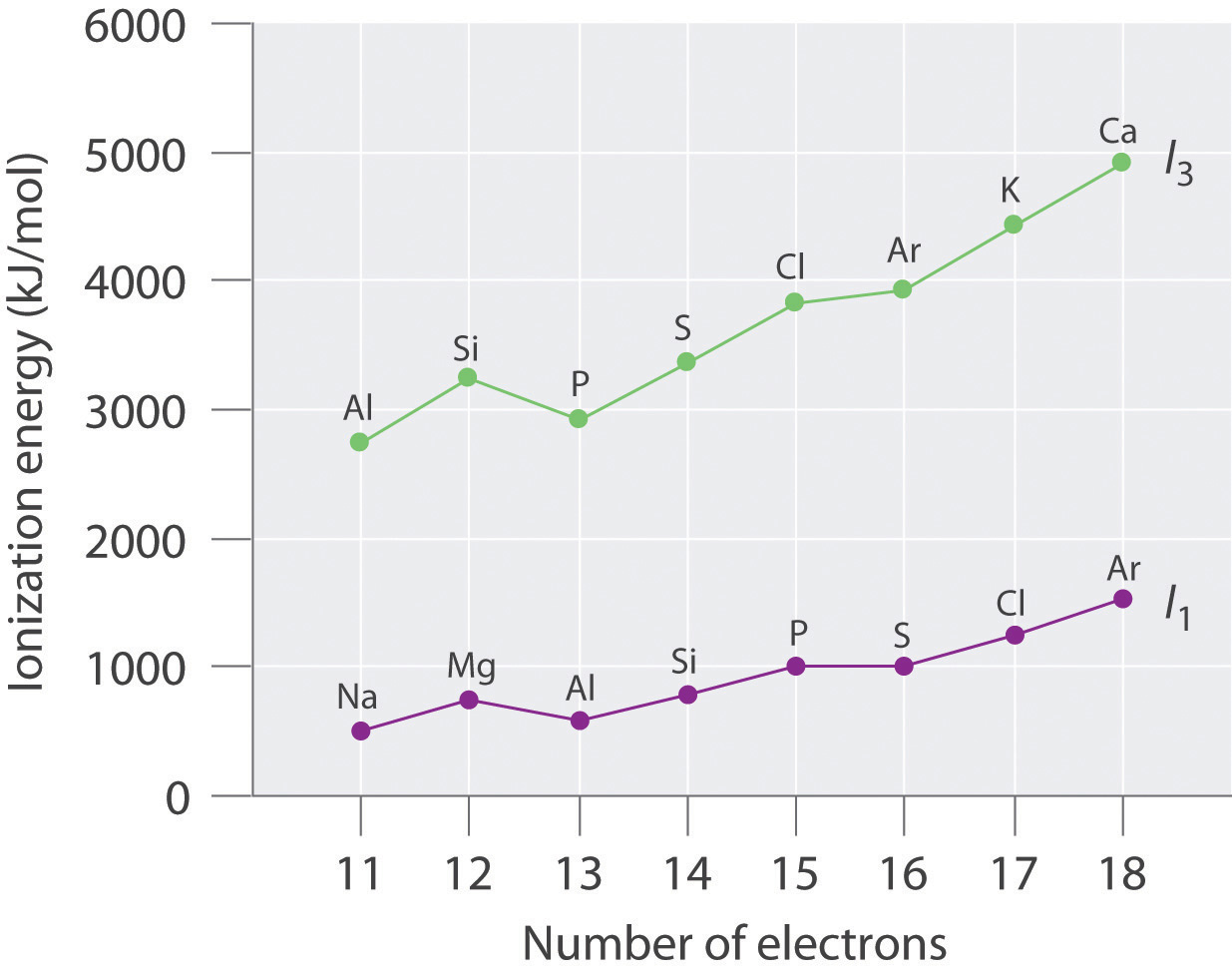
Las características generales de ambas gráficas son aproximadamente las mismas, con un pequeño pico a 12 electrones y una región esencialmente nivelada de 15 a 16 electrones. La pendiente de la gráfica I 3 es aproximadamente el doble de grande que la pendiente de la gráfica I 1, sin embargo, debido a que los valores de I 3 corresponden a eliminar un electrón de un ion con una carga +2 en lugar de un átomo neutro. La mayor carga aumenta el efecto del aumento constante de la carga nuclear efectiva a través de la fila.
-
-
Configuraciones de electrones: Mg, 1 s 2 2 s 2 2 p 6 3 s 2; Al, 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1; Si, 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2; Las primeras energías de ionización aumentan a través de la fila debido a un aumento constante de la carga nuclear efectiva; por lo tanto, Si tiene la energía de primera ionización más alta. La tercera energía de ionización corresponde a la eliminación de un electrón de 3 s para Al y Si, pero para Mg implica eliminar un electrón de 2 p de una capa interna llena; en consecuencia, la tercera energía de ionización del Mg es la más alta.
-
- Bi > As > N
- F > O >> Ar
- Rb > Cs > Ba
- Hg 2+ > H + > O − > N 2−; Hg 2+ tiene la carga positiva más alta más un conjunto de orbitales vacantes de energía relativamente baja (la subcapa de 6 p) para acomodar un electrón agregado, dándole la mayor afinidad electrónica; N 2− tiene un mayor carga negativa que O −, por lo que las repulsiones electrón-electrón provocarán que su afinidad electrónica sea incluso menor (más negativa) que la de O −.
-
-
aisladores: S, O, C (diamante), P; conductores: Ba, Fe, Al, C (grafito), Be, Sc, W, Na, Rb; Te y B son semimetales y semiconductores.
-
-
Mg, Al, Ti y H 2
-
-
- reductor
- ni
- reductor
- reductor
- oxidante
- ni
-
-
I 2 es el mejor oxidante, con una tendencia moderadamente fuerte a aceptar un electrón para formar el ion I −, con una configuración electrónica de cubierta cerrada. O − probablemente también sería un oxidante, con tendencia a añadir un electrón para formar sales que contienen el ion óxido, O 2−. Zn y Sn 2+ son todos reductores, mientras que K + no tiene tendencia a actuar como oxidante o reductor.

