3.5: Tipos de reacciones químicas
- Page ID
- 78361
- Identificar tipos fundamentales de reacciones químicas.
- Para predecir los tipos de reacciones que sufrirán las sustancias.
Las reacciones químicas que hemos descrito son solo un pequeño muestreo del número infinito de reacciones químicas posibles. ¿Cómo afrontan los químicos esta abrumadora diversidad? ¿Cómo predicen qué compuestos reaccionarán entre sí y qué productos se formarán? La clave del éxito es encontrar formas útiles de categorizar las reacciones. La familiaridad con algunos tipos básicos de reacciones te ayudará a predecir los productos que se forman cuando ciertos tipos de compuestos o elementos entran en contacto.
La mayoría de las reacciones químicas se pueden clasificar en uno o más de cinco tipos básicos: reacciones ácido-base Una reacción de la forma general ácido + base → sal. , reacciones de intercambio Una reacción química que tiene la forma general AB + C → AC + B o AB + CD → AD + CB. , reacciones de condensación Una reacción química que tiene la forma general A + B → AB. Las reacciones de condensación son el reverso de las reacciones de escisión. Algunas, pero no todas, las reacciones de condensación también son reacciones de oxidación-reducción. (y a la inversa, reacciones de escisión Una reacción química que tiene la forma general AB → A + B. Las reacciones de escisión son la inversa de las reacciones de condensación. ), y reacciones de oxidación-reducción Una reacción química que exhibe un cambio en los estados de oxidación de uno o más elementos en los reactivos que tiene la forma general oxidante + reductor → oxidante reducido + reductor oxidado. . Las formas generales de estos cinco tipos de reacciones se resumen en la Tabla\(\PageIndex{1}\), junto con ejemplos de cada una. Es importante señalar, sin embargo, que muchas reacciones se pueden asignar a más de una clasificación, como verá en nuestra discusión. El esquema de clasificación es sólo por conveniencia; la misma reacción se puede clasificar de diferentes maneras, dependiendo de cuál de sus características sea más importante. Las reacciones de oxidación-reducción, en las que hay una transferencia neta de electrones de un átomo a otro, y las reacciones de condensación se discuten en esta sección. Las reacciones ácido-base y un tipo de reacción de intercambio, la formación de una sal insoluble como el sulfato de bario cuando se mezclan soluciones de dos sales solubles, se discutirán en el Capítulo 8.
Tabla Tipos \(\PageIndex{1}\)Básicos de Reacciones Químicas
| Nombre de la reacción | Formulario General | Ejemplo (s) |
|---|---|---|
| oxidación-reducción (redox) | oxidante + reductor → oxidante reducido + reductor oxidado | C 7 H 16 (l) + 11O 2 (g) → 7CO 2 (g) + 8H 2 O (g) |
| ácido-base | ácido + base → sal | NH 3 (aq) + HNO 3 (aq) → NH 4 + (aq) + NO 3 − (aq) |
| intercambio | AB + C → AC + B | CH 3 Cl + OH − → CH 3 OH + Cl − |
| AB + CD → ANUNCIO + CB | BacL 2 (aq) + Na 2 SO 4 (aq) → BasO 4 (s) + 2NaCl (aq) | |
| condensación | A + B → AB | CO 2 (g) + H 2 O (l) → H 2 CO 3 (aq) |
| HBr + H 2 C=CH 2 → CH 3 CH 2 Br * | ||
| escote | AB → A + B | CaCo 3 (s) → CaO (s) + CO 2 (g) |
| CH 3 CH 2 Cl → H 2 C=CH 2 + HCl ** | ||
| * En cursos de química más avanzados aprenderás que esta reacción también se llama reacción de adición. | ||
| ** En cursos de química más avanzados aprenderás que esta reacción también se llama reacción de eliminación. | ||
Reacciones de oxidación-reducción
El término oxidación se refiere a la pérdida de uno o más electrones en una reacción química. Se dice que la sustancia que pierde electrones está oxidada. se utilizó primero para describir reacciones en las que los metales reaccionan con el oxígeno en el aire para producir óxidos metálicos. Cuando el hierro se expone al aire en presencia de agua, por ejemplo, el hierro se vuelve oxidado, un óxido de hierro. Cuando se expone al aire, el aluminio metálico desarrolla una capa continua, coherente y transparente de óxido de aluminio en su superficie. En ambos casos, el metal adquiere una carga positiva al transferir electrones a los átomos neutros de oxígeno de una molécula de oxígeno. Como resultado, los átomos de oxígeno adquieren una carga negativa y forman iones óxido (O 2−). Debido a que los metales han perdido electrones por oxígeno, se han oxidado; por lo tanto, la oxidación es la pérdida de electrones. Por el contrario, debido a que los átomos de oxígeno han ganado electrones, se han reducido, por lo que la reducción es la ganancia de electrones. Por cada oxidación, debe haber una reducción asociada.
Tenga en cuenta el patrón
Cualquier oxidación debe ir acompañada de una reducción y viceversa.
El término reducción se refiere a la ganancia de uno o más electrones en una reacción química. Se dice que se reduce la sustancia que gana electrones. se refirió a la disminución de masa observada cuando un óxido metálico se calentó con monóxido de carbono, reacción que fue ampliamente utilizada para extraer metales de sus minerales. Cuando el óxido de cobre sólido (I) se calienta con hidrógeno, por ejemplo, su masa disminuye debido a que la formación de cobre puro va acompañada de la pérdida de átomos de oxígeno como producto volátil (agua). La reacción es la siguiente:
\( Cu_{2}O \left ( s \right )+H_{2} \left ( g \right ) \rightarrow 2Cu \left ( s \right )+ H_{2}O \left ( g \right ) \)
Las reacciones de oxidación y reducción se definen ahora como reacciones que exhiben un cambio en los estados de oxidación de uno o más elementos en los reactivos, lo que sigue a la oxidación mnemónica es la reducción de pérdidas es ganancia, o plataforma petrolera. El estado de oxidación: La carga que tendría cada átomo en un compuesto si todos sus electrones enlazantes fueran transferidos al átomo con la mayor atracción para los electrones. de cada átomo en un compuesto es la carga que tendría un átomo si todos sus electrones enlazantes fueran transferidos al átomo con la mayor atracción para los electrones. A los átomos en su forma elemental, como O 2 o H 2, se les asigna un estado de oxidación de cero. Por ejemplo, la reacción del aluminio con oxígeno para producir óxido de aluminio es
\( 4Al \left ( s \right )+3O_{2} \left ( g \right ) \rightarrow 2Al_{2}O_{3} \left ( s \right ) \)
Cada átomo de oxígeno neutro gana dos electrones y se carga negativamente, formando un ion óxido; así, el oxígeno tiene un estado de oxidación de −2 en el producto y se ha reducido. Cada átomo de aluminio neutro pierde tres electrones para producir un ion aluminio con un estado de oxidación de +3 en el producto, por lo que el aluminio se ha oxidado. En la formación de Al 2 O 3, los electrones se transfieren de la siguiente manera (el superíndice 0 enfatiza el estado de oxidación de los elementos):
\( 4Al^{0} +3O_{2}^{0} \rightarrow 4Al^+6O^{2-} \)
La ecuación\(\PageIndex{1}\) y la ecuación\(\PageIndex{2}\) son ejemplos de reacciones de oxidación-reducción (redox). En las reacciones redox, hay una transferencia neta de electrones de un reactivo a otro. En cualquier reacción redox, el número total de electrones perdidos debe ser igual al total de electrones obtenidos para preservar la neutralidad eléctrica. En Ecuación\(\PageIndex{3}\), por ejemplo, el número total de electrones perdidos por el aluminio es igual al número total ganado por el oxígeno:
\ [\ begin {matriz}
electrones\; perdidos &=& 4\ cancel {Al\; átomos}\ veces\ dfrac {3\; e^ {-}\; perdido} {\ cancel {Al\; átomos}} &=12\; e^ {-}\; perdidos\\
& & &\\
electrones\; ganados &=& 6\ cancelar {O\; átomos}\ veces dfrac {2\; e^ {-}\; ganado} {\ cancel {O\; átomos}} &=12\; e^ {-}\; ganados
\ fin {matriz}\]
El mismo patrón se ve en todas las reacciones de oxidación-reducción: el número de electrones perdidos debe ser igual al número de electrones ganados.
Tenga en cuenta el patrón
En todas las reacciones de oxidación-reducción (redox), el número de electrones perdidos es igual al número de electrones ganados.
Asignación de estados de oxidación
Asignar estados de oxidación a los elementos en compuestos iónicos binarios es sencillo: los estados de oxidación de los elementos son idénticos a las cargas en los iones monoatómicos. En el capítulo 5 aprendiste a predecir las fórmulas de compuestos iónicos simples basados en el signo y la magnitud de la carga sobre los iones monoatómicos formados por los elementos neutros. Ejemplos de tales compuestos son cloruro de sodio (NaCl; Figura\(\PageIndex{1}\), óxido de magnesio (MgO) y cloruro de calcio (CaCl 2). En los compuestos covalentes, en contraste, los átomos comparten electrones. Los estados de oxidación en compuestos covalentes se pueden entender en términos de enlaces covalentes polares y electronegatividad. Los estados de oxidación asumen que los electrones se transfieren completamente. Si bien esto no es cierto, es casi cierto, y el modelo de estado de oxidación puede ayudarte a entender y predecir muchas reacciones. Por ejemplo, en el agua, el estado de oxidación del átomo de oxígeno es -2 y el de cada hidrógeno es +1. Ese es el modelo de estado de oxidación asume que los átomos de hidrógeno transfieren un electrón completamente al átomo de oxígeno. Sabemos que este no es el caso, sino que los electrones de los átomos de hidrógeno se encuentran más cerca del átomo de oxígeno. Un caso más extremo es el dióxido de carbono, donde los estados de oxidación de los átomos de oxígeno más electronegativos son -2 y el del átomo de carbono es +4. Nuevamente, la idea es que el modelo de estado de oxidación asuma la transferencia completa, y el modelo de enlace atómico nos dice que la transferencia es sólo parcial. Aún así, el modelo de estado de oxidación es útil como veremos
Figura \(\PageIndex{1}\)La reacción de un átomo de sodio neutro con un átomo de cloro neutro
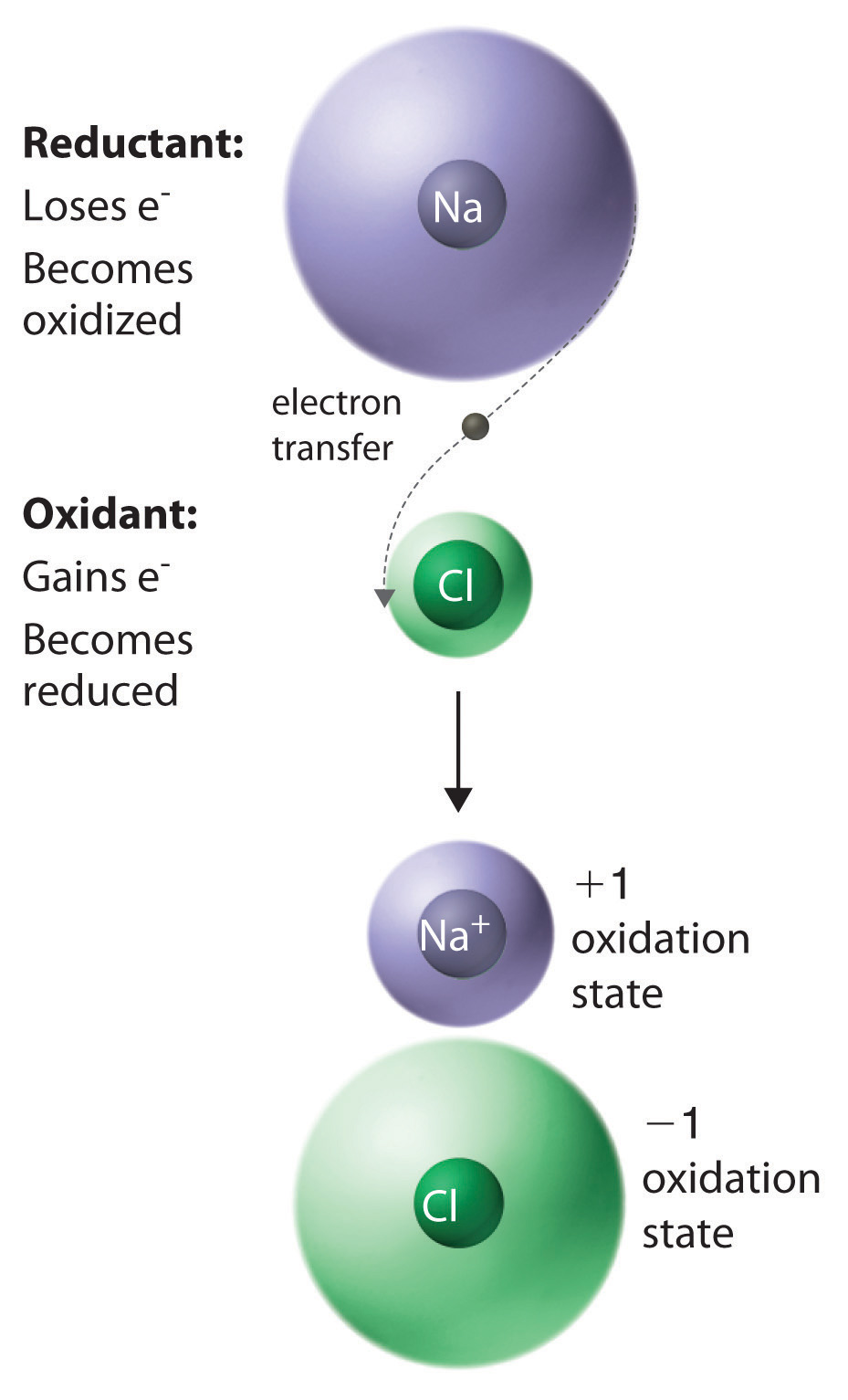
El resultado es la transferencia de un electrón del sodio al cloro, formando el compuesto iónico NaCl.
A continuación se presenta un conjunto de reglas para asignar estados de oxidación a átomos en compuestos químicos.
Reglas para Asignar Estados de Oxidación:
- El estado de oxidación de un átomo en cualquier elemento puro, ya sea monatómico, diatómico o poliatómico, es cero.
- El estado de oxidación de un ion monoatómico es el mismo que su carga, por ejemplo, Na + = +1, Cl − = −1.
- El estado de oxidación del flúor en los compuestos químicos es siempre −1. Otros halógenos suelen tener estados de oxidación de −1 también, excepto cuando se combinan con oxígeno u otros halógenos.
- Al hidrógeno se le asigna un estado de oxidación de +1 en sus compuestos con no metales y −1 en sus compuestos con metales.
- Al oxígeno se le asigna normalmente un estado de oxidación de −2 en los compuestos, con dos excepciones: en los compuestos que contienen enlaces oxígeno-flúor u oxígeno-oxígeno, el estado de oxidación del oxígeno está determinado por los estados de oxidación de los otros elementos presentes.
- La suma de los estados de oxidación de todos los átomos en una molécula neutra o ion debe ser igual a la carga sobre la molécula o ion.
En cualquier reacción química, se debe conservar la carga neta; es decir, en una reacción química, el número total de electrones es constante, al igual que el número total de átomos. Consistente con esto, la regla 1 establece que la suma de los estados de oxidación individuales de los átomos en una molécula o ion debe ser igual a la carga neta sobre esa molécula o ion. En NaCl, por ejemplo, Na tiene un estado de oxidación de +1 y Cl es −1. El cargo neto es cero, como debe ser para cualquier compuesto.
Se requiere la regla 3 porque el flúor atrae electrones con más fuerza que cualquier otro elemento, por razones que descubriste en el Capítulo 7. De ahí que el flúor proporcione una referencia para calcular los estados de oxidación de otros átomos en compuestos químicos. La Regla 4 refleja la diferencia en la química observada para los compuestos de hidrógeno con no metales (como el cloro) en contraposición a los compuestos de hidrógeno con metales (como el sodio). Por ejemplo, NaH contiene el ion H −, mientras que HCl forma iones H + y Cl − cuando se disuelve en agua. La regla 5 es necesaria porque el flúor tiene una mayor atracción por los electrones que el oxígeno; esta regla también evita violaciones a la regla 2. Entonces el estado de oxidación del oxígeno es +2 en DE 2 pero −½ en KO 2. Tenga en cuenta que un estado de oxidación de −½ para O en KO 2 es perfectamente aceptable. Ocasionalmente se encuentran estados de oxidación no integrales. Suelen deberse a la presencia de dos o más átomos del mismo elemento con diferentes estados de oxidación, por lo que el estado de oxidación “promedio” es una fracción. Al igual que con las estructuras de resonancia, esto es un fracaso del modelo.
La reducción del óxido de cobre (I) mostrada en la Ecuación\(\PageIndex{5}\) demuestra cómo aplicar estas reglas. La regla 1 establece que los átomos en su forma elemental tienen un estado de oxidación de cero, lo que aplica a H 2 y Cu. De la regla 4, el hidrógeno en H 2 O tiene un estado de oxidación de +1, y a partir de la regla 5, el oxígeno tanto en Cu 2 O como en H 2 O tiene un estado de oxidación de −2. La regla 6 establece que la suma de los estados de oxidación en una molécula o unidad de fórmula debe ser igual a la carga neta sobre ese compuesto. Esto significa que cada átomo de Cu en Cu 2 O debe tener una carga de +1:2 (+1) + (−2) = 0. Entonces los estados de oxidación son los siguientes:
\[ \overset{+1}{Cu_{2}}\underset{-2}{O}\left ( s \right )+\overset{0}{H_{2}}\rightarrow 2\overset{0}{Cu}\left ( s \right )+\overset{+1}{H_{2}}\underset{-2}{O\left ( g \right )} \]
La asignación de estados de oxidación nos permite ver que ha habido una transferencia neta de electrones del hidrógeno (0 → +1) al cobre (+1 → 0). Entonces esta es una reacción redox. Una vez más, el número de electrones perdidos es igual al número de electrones ganados, y hay una conservación neta de la carga:
\ [\ begin {matriz}
electrones\; perdidos &=& 2\ cancel {H\; átomos}\ veces\ dfrac {1\; e^ {-}\; perdido} {\ cancel {H\; átomos}} &=2\; e^ {-}\; perdidos\\
& & &\\
electrones\; ganados &=& 2\ cancel {Cu\; átomos}\ veces dfrac {1\; e^ {-}\; ganado} {\ cancel {Cu\; átomos }} &=2\; e^ {-}\; ganada
\ final {matriz}\]
Recuerde que los estados de oxidación son útiles para visualizar la transferencia de electrones en reacciones de oxidación-reducción, pero el estado de oxidación de un átomo y su carga real son los mismos solo para compuestos iónicos simples. Los estados de oxidación son una manera conveniente de asignar electrones a átomos, y son útiles para predecir los tipos de reacciones que sufren las sustancias.
Asignar estados de oxidación a todos los átomos en cada compuesto.
- hexafluoruro de azufre (SF 6)
- metanol (CH 3 OH)
- sulfato de amonio [(NH 4) 2 SO 4]
- magnetita (Fe 3 O 4)
- ácido etanoico (acético) (CH 3 CO 2 H)
Dado: fórmula molecular o empírica
Preguntado por: estados de oxidación
Estrategia:
Comience con átomos cuyos estados de oxidación se puedan determinar sin ambigüedades a partir de las reglas presentadas (como flúor, otros halógenos, oxígeno e iones monoatómicos). Después determinar los estados de oxidación de otros átomos presentes de acuerdo con la regla 1.
Solución:
- Sabemos por la regla 3 que el flúor siempre tiene un estado de oxidación de −1 en sus compuestos. Los seis átomos de flúor en el hexafluoruro de azufre dan una carga negativa total de −6. Debido a que la regla 1 requiere que la suma de los estados de oxidación de todos los átomos sea cero en una molécula neutra (aquí SF 6), el estado de oxidación del azufre debe ser +6: [(6 átomos F) (−1)] + [(1 átomo S) (+6)] = 0
- De acuerdo con las reglas 4 y 5, el hidrógeno y el oxígeno tienen estados de oxidación de +1 y −2, respectivamente. Debido a que el metanol no tiene carga neta, el carbono debe tener un estado de oxidación de −2: [(4 átomos de H) (+1)] + [(1 átomo de O) (−2)] + [(1 átomo de C) (−2)] = 0
- Nótese que (NH 4) 2 SO 4 es un compuesto iónico que consiste tanto en un catión poliatómico (NH 4 +) como por un anión poliatómico (SO 4 2−) (ver Cuadro 6.2.1). Asignamos estados de oxidación a los átomos en cada ion poliatómico por separado. Para NH 4 +, el hidrógeno tiene un estado de oxidación de +1 (regla 4), por lo que el nitrógeno debe tener un estado de oxidación de −3:
[(4 átomos de H) (+1)] + [(1 átomo de N) (−3)] = +1, la carga en el ion NH 4 +
Para SO 4 2−, el oxígeno tiene un estado de oxidación de −2 (regla 5), por lo que el azufre debe tener un estado de oxidación de +6:
[(4 átomos de O) (−2)] + [(1 átomo S) (+6)] = −2, la carga en el ion sulfato - El oxígeno tiene un estado de oxidación de −2 (regla 5), dando una carga global de −8 por unidad de fórmula. Esto debe ser equilibrado por la carga positiva en tres átomos de hierro, dando un estado de oxidación de +8/3 para el hierro:
Los estados de oxidación fraccional están permitidos porque los estados de oxidación son una forma algo arbitraria de hacer un seguimiento de los electrones. De hecho, se puede considerar que Fe 3 O 4 tiene dos iones Fe 3 + y un ion Fe 2 + por unidad de fórmula, dando una carga positiva neta de +8 por unidad de fórmula. Fe 3 O 4 es un mineral de hierro magnético comúnmente llamado magnetita. En la antigüedad, la magnetita era conocida como piedra magnética porque se podía utilizar para hacer brújulas primitivas que apuntaban hacia Polaris (la Estrella del Norte), que se llamaba la “estrella solar”.
- Inicialmente, asignamos estados de oxidación a los componentes de CH 3 CO 2 H de la misma manera que cualquier otro compuesto. El hidrógeno y el oxígeno tienen estados de oxidación de +1 y −2 (reglas 4 y 5, respectivamente), dando como resultado una carga total para hidrógeno y oxígeno de
[\[ (4 H atoms)(+1)] + [(2 O atoms)(−2)] = 0 \]
Por lo que el estado de oxidación del carbono también debe ser cero (regla 6). Este es, sin embargo, un estado de oxidación promedio para los dos átomos de carbono presentes. Debido a que cada átomo de carbono tiene un conjunto diferente de átomos unidos a él, es probable que tengan diferentes estados de oxidación. Para determinar los estados de oxidación de los átomos de carbono individuales, utilizamos las mismas reglas que antes pero con la suposición adicional de que los enlaces entre átomos del mismo elemento no afectan los estados de oxidación de esos átomos. El átomo de carbono del grupo metilo (-CH 3) está unido a tres átomos de hidrógeno y un átomo de carbono. Sabemos por la regla 4 que el hidrógeno tiene un estado de oxidación de +1, y acabamos de decir que el enlace carbono-carbono puede ignorarse al calcular el estado de oxidación del átomo de carbono. Para que el grupo metilo sea eléctricamente neutro, su átomo de carbono debe tener un estado de oxidación de −3. De manera similar, el átomo de carbono del grupo ácido carboxílico (-CO 2H) está unido a un átomo de carbono y dos átomos de oxígeno. Ignorando nuevamente el átomo de carbono unido, asignamos estados de oxidación de −2 y +1 a los átomos de oxígeno e hidrógeno, respectivamente, conduciendo a una carga neta de
[(2 átomos de O) (−2)] + [(1 átomo de H) (+1)] = −3Para obtener un grupo ácido carboxílico eléctricamente neutro, la carga sobre este carbono debe ser +3. Los estados de oxidación de los átomos individuales en el ácido acético son así
\[ \underset{-3}{C} \overset{+1}{H_{3}}\overset{+3}{C}\underset{-2}{O_{2}} \overset{+1}{H} \]Así, la suma de los estados de oxidación de los dos átomos de carbono es efectivamente cero.
Asignar estados de oxidación a todos los átomos en cada compuesto.
- fluoruro de bario (BaF 2)
- formaldehído (CH 2 O)
- dicromato de potasio (K 2 Cr 2 O 7)
- óxido de cesio (CSo 2)
- etanol (CH 3 CH 2 OH)
- Contestar
-
- Ba, +2; F, −1
- C, 0; H, +1; O, −2
- K, +1; Cr, +6; O, −2
- Cs, +1; O, −½
- C, −3; H, +1; C, −1; H, +1; O, −2; H, +1
Oxidantes y Reductores
Los compuestos que son capaces de aceptar electrones, como O 2 o F 2, se denominan oxidantes (o agentes oxidantes) Un compuesto que es capaz de aceptar electrones; así se reduce. porque pueden oxidar otros compuestos. En el proceso de aceptación de electrones, se reduce un oxidante. Los compuestos que son capaces de donar electrones, como el sodio metálico o el ciclohexano (C 6 H 12), se denominan reductores (o agentes reductores) Un compuesto que es capaz de donar electrones; así se oxida. porque pueden provocar la reducción de otro compuesto. En el proceso de donación de electrones, se oxida un reductor. Estas relaciones se resumen en la Ecuación 7.5.7:
\[ oxidant + reductant → oxidation−reduction \]
\[ \underset{gains\; e^{-}}{\overset{(is\; reduced)}{O_{2}}}\left ( g \right )+ \underset{loses\; e^{-}}{\overset{(is\; oxidized)}{4Na}}\left ( s \right )\rightarrow \underset{redox\; reaction}{2Na_{2}O} \tag{7.5.7} \]
Algunos oxidantes tienen una mayor capacidad que otros para eliminar electrones de otros compuestos. Los oxidantes pueden variar desde muy potentes, capaces de oxidar la mayoría de los compuestos con los que entran en contacto, hasta bastante débiles. Tanto F 2 como Cl 2 son oxidantes potentes: por ejemplo, F 2 oxidará H 2 O en una reacción vigorosa y potencialmente explosiva. En contraste, S 8 es un oxidante bastante débil, y O 2 cae en algún punto intermedio. Por el contrario, los reductores varían en su tendencia a donar electrones a otros compuestos. Los reductores también pueden variar desde muy potentes, capaces de ceder electrones hasta casi cualquier cosa, hasta débiles. Los metales alcalinos son potentes reductores, por lo que deben mantenerse alejados del oxígeno atmosférico para evitar una reacción redox potencialmente peligrosa.
Una reacción de combustión Una reacción de oxidación-reducción en la que se encuentra el oxidante. O 2, introducido por primera vez en la Sección 7.2 es una reacción de oxidación-reducción en la que el oxidante es O 2. Un ejemplo de una reacción de combustión es la quema de una vela, que se muestra en la Figura 7.3.3. Consideremos, por ejemplo, la combustión del ciclohexano, un hidrocarburo típico, en exceso de oxígeno. La ecuación química equilibrada para la reacción, con el estado de oxidación mostrado para cada átomo, es la siguiente:
\[ \underset{-2}{C_{6}}\overset{+1}{H_{12}}+ \overset{0}{O_{2}}\rightarrow \overset{+4}{C}\underset{-2}{O_{2}}+\overset{+1}{6H_{2}}\underset{-2}{O} \tag{7.5.8} \]
Si comparamos el estado de oxidación de cada elemento en los productos y los reactivos, vemos que el hidrógeno es el único elemento cuyo estado de oxidación no cambia; permanece +1. El carbono, sin embargo, tiene un estado de oxidación de −2 en ciclohexano y +4 en CO 2; es decir, cada átomo de carbono cambia su estado de oxidación en seis electrones durante la reacción. El oxígeno tiene un estado de oxidación de 0 en los reactivos, pero gana electrones para tener un estado de oxidación de −2 en CO 2 y H 2 O. Debido a que el carbono se ha oxidado, el ciclohexano es el reductor; debido a que el oxígeno se ha reducido, es el oxidante. Por lo tanto, todas las reacciones de combustión son reacciones de oxidación-reducción.
Reacciones de condensación
La reacción del bromo con etileno para dar 1,2-dibromoetano, que se utiliza en la agricultura para matar nematodos en el suelo, es la siguiente:
\[ {C_2}{H_4}\left( g \right) + B{r_2}\left( g \right){\text{ }} \to BrC{H_2}C{H_2}Br\left( g \right) \tag{7.5.9} \]
De acuerdo con el Cuadro 7.1.1, esta es una reacción de condensación porque tiene la forma general A + B → AB. Esta reacción, sin embargo, también puede verse como una reacción de oxidación-reducción, en la que los electrones se transfieren del carbono (−2 → −1) al bromo (0 → −1). Otro ejemplo de una reacción de condensación es la utilizada para la síntesis industrial de amoníaco:
\[3{H_2}\left( g \right) + {N_2}\left( g \right){\text{ }} \to 2N{H_3}\left( g \right) \tag{7.5.10} \]
Aunque esta reacción también tiene la forma general de reacción de condensación, el hidrógeno se ha oxidado (0 → +1) y el nitrógeno se ha reducido (0 → −3), por lo que también se puede clasificar como una reacción de oxidación-reducción.
No todas las reacciones de condensación son reacciones redox. La reacción de una amina con un ácido carboxílico, por ejemplo, es una variante de una reacción de condensación (A + B → A′B′ + C): dos fragmentos grandes se condensan para formar una sola molécula, y se elimina una molécula mucho más pequeña, como H 2 O. En esta reacción, el -OH del grupo ácido carboxílico y -H del grupo amina se eliminan como H2O, y la reacción forma un enlace amida (también llamado enlace peptídico) que une los dos fragmentos. Los enlaces amida son la unidad estructural esencial que une los bloques de construcción de proteínas y muchos polímeros entre sí. El nylon, por ejemplo, se produce a partir de una reacción de condensación (Figura 7.5.2).
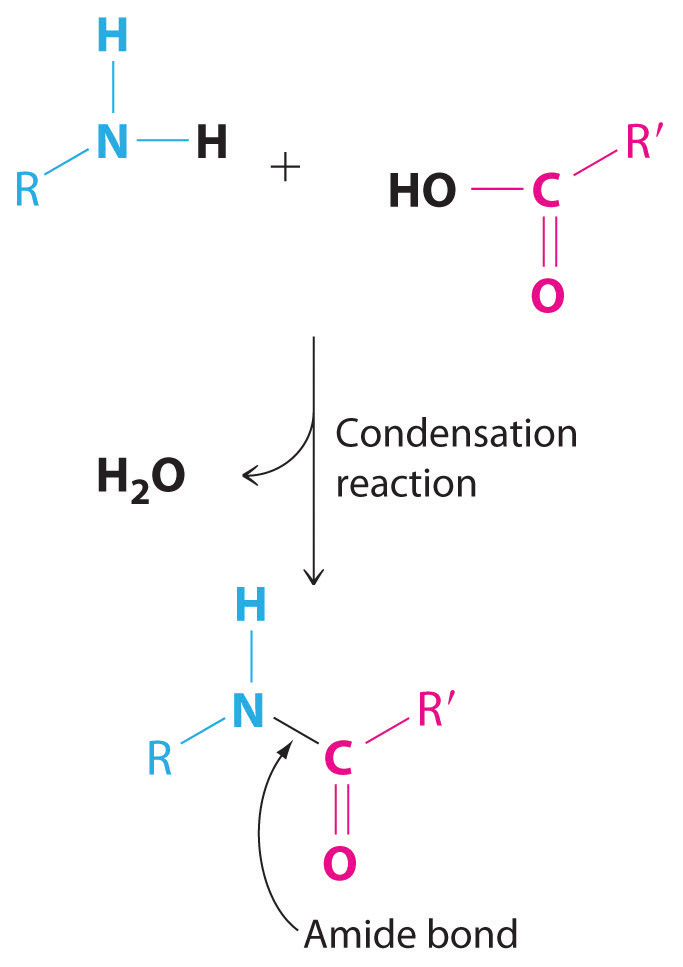
Enganes amida. La reacción de una amina con un ácido carboxílico procede eliminando agua y formando un nuevo enlace C—N (amida).
Figura 7.5.2 La producción de nylon

Las siguientes reacciones tienen importantes aplicaciones industriales. Usando Table\(\PageIndex{1}\), clasifique cada reacción como una reacción de oxidación-reducción, una reacción ácido-base, una reacción de intercambio, una reacción de condensación o una reacción de escisión. Para cada reacción redox, identificar el oxidante y el reductor y especificar qué átomos se oxidan o reducen. (No olvide que algunas reacciones se pueden colocar en más de una categoría.)
- C 2 H 4 (g) + Cl 2 (g) → ClCH 2 CH 2 Cl (g)
- AgnO 3 (ac) + NaCl (ac) → AgCl (s) + NaNO 3 (aq)
- CaCo 3 (s) → CaO (s) + CO 2 (g)
- Ca 5 (PO 4) 3 (OH) (s) + 7H 3 PO 4 (aq) + 4H 2 O (l) → 5Ca (H 2 PO 4) 2 ·H 2 O (s)
- Pb (s) + PbO 2 (s) + 2H 2 SO 4 (aq) → 2PbSO 4 (s) + 2H 2 O (l)
Dado: ecuación química equilibrada
Preguntado por: clasificación de reacción química
Estrategia:
A Determine la forma general de la ecuación haciendo referencia a la Tabla\(\PageIndex{1}\) y luego clasifique la reacción.
B Para las reacciones redox, asigne estados de oxidación a cada átomo presente en los reactivos y los productos. Si el estado de oxidación de uno o más átomos cambia, entonces la reacción es una reacción redox. Si no, la reacción debe ser uno de los otros tipos de reacción enumerados en la Tabla\(\PageIndex{1}\)
Solución
- A Esta reacción se utiliza para preparar 1,2-dicloroetano, uno de los 25 principales químicos industriales Tiene la forma general A + B → AB, la cual es típica de una reacción de condensación. B Debido a que las reacciones pueden encajar en más de una categoría, necesitamos mirar los estados de oxidación de los átomos:
\[ \underset{-2}{C_{2}}\overset{+1}{H_{4}}+ \overset{0}{Cl_{2}}\rightarrow \underset{-1}{Cl}\underset{-1}{C}\overset{+1}{H_{2}}\underset{-1}{Cl} \notag \]
Los estados de oxidación muestran que el cloro se reduce de 0 a −1 y el carbono se oxida de −2 a −1, por lo que esta es una reacción redox así como una reacción de condensación. El etileno es el reductor, y el cloro es el oxidante.
- A Esta reacción se utiliza para preparar cloruro de plata para hacer película fotográfica. La ecuación química tiene la forma general AB + CD → AD + CB, por lo que se clasifica como una reacción de intercambio. B Los estados de oxidación de los átomos son los siguientes
\[ \overset{+1}{Ag}\overset{+5}{N}\underset{-2}{O_{3}}+\overset{+1}{Na}\underset{-1}{Cl}\rightarrow \overset{+1}{Ag}\underset{-1}{Cl}+ \overset{+1}{Na}\overset{+5}{N}\underset{-2}{O_{3}} \notag \]
No hay cambio en los estados de oxidación, por lo que esta no es una reacción redox.
AgCl (s) precipita cuando se mezclan soluciones de AgnO 3 (ac) y NaCl (ac). NaNO 3 (aq) está en solución como iones Na + y NO 3 −.
- A Esta reacción se utiliza para preparar cal (CaO) a partir de piedra caliza (CaO 3) y tiene la forma general AB → A + B. La forma general de la ecuación química indica que puede clasificarse como una reacción de escisión, la inversa de una reacción de condensación. B Los estados de oxidación de los átomos son los siguientes:
\[ \overset{+2}{Ca}\overset{+4}{C}\underset{-2}{O_{3}}\rightarrow \overset{+2}{Ca}\underset{-2}{O_{2}}+ \overset{+4}{C}\underset{-2}{O_{2}} \notag \] >
Debido a que los estados de oxidación de todos los átomos son los mismos en los productos y en el reactivo, esta no es una reacción redox.
- A Esta reacción se utiliza para preparar “súper triple fosfato” en fertilizante. Uno de los reactivos es el ácido fosfórico, que transfiere un protón (H +) a los iones fosfato e hidróxido de la hidroxiapatita [Ca 5 (PO 4) 3 (OH)] para formar H 2 PO 4 − y H 2 O, respectivamente. Se trata de una reacción ácido-base, en la que H 3 PO 4 es el ácido (donante H +) y Ca 5 (PO 4) 3 (OH) es la base (aceptor H +).
B Para determinar si también es una reacción redox, asignamos estados de oxidación a los átomos:
\[ \overset{+2}{Ca_{5}}\left ( \overset{+5}{P}\underset{-2}{O_{4}} \right )_{3}\left ( \underset{-2}{O}\overset{+1}{H} \right )+\overset{+1}{7H_{3}}\overset{+5}{P}\underset{-2}{O_{4}}\rightarrow \overset{+2}{5Ca}\left ( \overset{+1}{H_{2}}\overset{+5}{P}\underset{-2}{O_{4}} \right )_{2}\cdot \overset{+1}{H_{2}}\underset{-2}{O} \notag \]Debido a que no hay cambio en el estado de oxidación, esta no es una reacción redox.
- A Esta reacción ocurre en una batería convencional de automóvil cada vez que se arranca el motor. Un ácido (H 2 SO 4) está presente y transfiere protones al oxígeno en PbO 2 para formar agua durante la reacción. Por lo tanto, la reacción puede describirse como una reacción ácido-base.
B Los estados de oxidación son los siguientes:
\[ \overset{0}{Pb}+\overset{+4}{Pb}\underset{-2}{O_{2}}+\overset{+1}{2H_{2}}\overset{+6}{S}\underset{-2}{O_{4}}\rightarrow \overset{+4}{2Pb}\overset{+6}{S}\underset{-2}{O_{4}}+\overset{+1}{2H_{2}}\underset{-2}{O} \notag \]El estado de oxidación del plomo cambia de 0 en Pb y +4 en PbO 2 (ambos reactivos) a +2 en PbSO 4. Esta también es una reacción redox, en la que el plomo elemental es el reductor, y PbO 2 es el oxidante. ¿Cuál es la descripción correcta? Ambos.
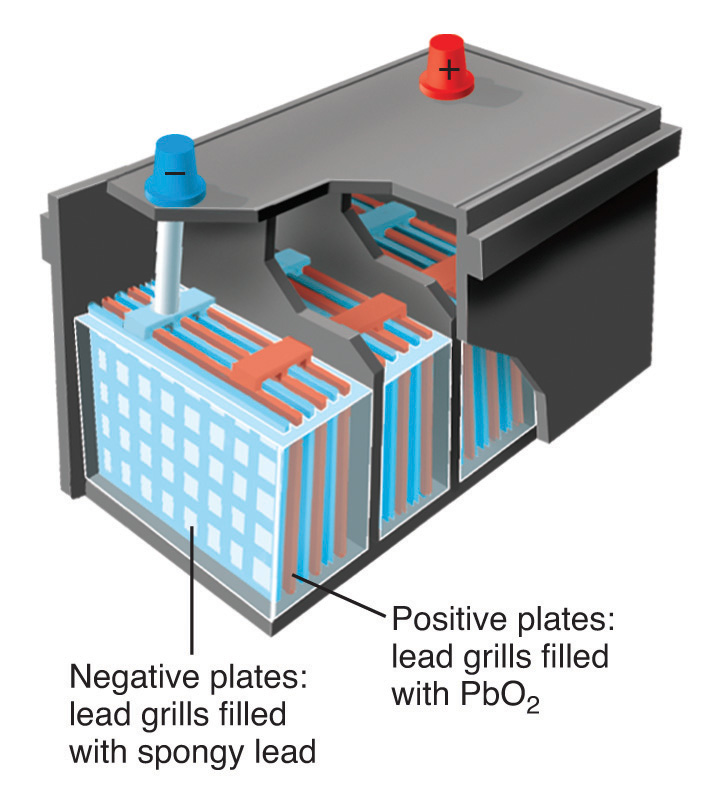
Dibujo esquemático de una batería de automóvil de 12 voltios. Se muestran las ubicaciones de los reactivos (plomo metálico en forma esponjosa con gran área de superficie) y PbO 2. El producto (PbSO 4) se forma como un sólido blanco entre las placas.
Usando la Tabla 7.5.1, clasifique cada reacción como una reacción de oxidación-reducción, una reacción ácido-base, una reacción de intercambio, una reacción de condensación o una reacción de escisión. Para cada reacción redox, identificar el oxidante y el reductor y especificar qué átomos se oxidan o reducen.
- Al (s) + OH − (aq) + 3H 2 O (l) → 3/2H 2 (g) + [Al (OH) 4] − (aq)
- TiCl 4 (l) + 2Mg (l) → Ti (s) + 2MgCl 2 (l)
- MgCl 2 (ac) + Na 2 CO 3 (ac) → MgCO 3 (s) + 2NaCl (ac)
- CO (g) + Cl 2 (g) → Cl 2 CO (l)
- H 2 SO 4 (l) + 2NH 3 (g) → (NH 4) 2 SO 4 (s)
- Contestar
-
- Reacción redox; reductor es Al, oxidante es H 2 O; Al se oxida, H se reduce. Esta es la reacción que ocurre cuando se usa Drano para limpiar un desagüe obstruido.
- Reacción redox; reductor es Mg, oxidante es TiCl 4; Mg se oxida, Ti se reduce.
- Reacción de intercambio. Esta reacción es la responsable de la escala que se desarrolla en las cafeteras en áreas que tienen agua dura.
- Tanto una reacción de condensación como una reacción redox; el reductor es CO, el oxidante es Cl 2; el C se oxida, el Cl se reduce. El producto de esta reacción es el fosgeno, un gas altamente tóxico utilizado como arma química en la Primera Guerra Mundial. El fosgeno ahora se utiliza para preparar poliuretanos, los cuales se utilizan en espumas para ropa de cama y muebles y en una variedad de recubrimientos.
- Reacción ácido-base.
Catalizadores
Muchas reacciones químicas, incluyendo algunas de las discutidas anteriormente, ocurren más rápidamente en presencia de un catalizador Una sustancia que aumenta la velocidad de una reacción química sin sufrir un cambio químico neto en sí mismo. , que es una sustancia que participa en una reacción y hace que ocurra con mayor rapidez pero que puede recuperarse sin cambios al final de una reacción y reutilizarse. Debido a que los catalizadores no están involucrados en la estequiometría de una reacción, generalmente se muestran por encima de la flecha en una ecuación química neta. Los procesos químicos en la industria dependen en gran medida del uso de catalizadores, que generalmente se agregan a una mezcla de reacción en cantidades traza, y la mayoría de las reacciones biológicas no tienen lugar sin un catalizador biológico o enzima Catalizadores que ocurren naturalmente en organismos vivos y catalizan reacciones biológicas. . Ejemplos de reacciones catalizadas en la industria son el uso del platino en el craqueo y reformado del petróleo, la reacción de SO 2 y O 2 en presencia de V 2 O 5 para producir SO 3 en la síntesis industrial de ácido sulfúrico, y el uso de ácido sulfúrico. ácido en la síntesis de compuestos como acetato de etilo y procaína. No sólo los catalizadores incrementan en gran medida las velocidades de reacción, sino que en algunos casos como en la refinación de petróleo, también controlan qué productos se forman. La aceleración de una reacción por un catalizador se llama catálisis La aceleración de una reacción química por un catalizador. .
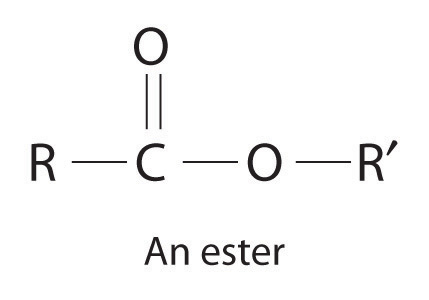

Un catalizador heterogéneo. Esta gran gasa circular, tejida a partir de alambre de rodio-platino, es un catalizador heterogéneo en la producción comercial de ácido nítrico por la oxidación del amoníaco.
Los catalizadores pueden clasificarse como homogéneos o heterogéneos. Un catalizador homogéneo Catalizador que se dispersa uniformemente por toda la mezcla reaccionante para formar una solución. se dispersa uniformemente por toda la mezcla reaccionante para formar una solución. El ácido sulfúrico, por ejemplo, es un catalizador homogéneo utilizado en la síntesis de ésteres como la procaína (Ejemplo 13). Un éster tiene una estructura similar a la de un ácido carboxílico, en el que el átomo de hidrógeno unido al oxígeno ha sido reemplazado por un grupo R. Son responsables de las fragancias de muchas frutas, flores y perfumes. Otros ejemplos de catalizadores homogéneos son las enzimas que permiten que nuestros cuerpos funcionen. En contraste, un catalizador heterogéneo Un catalizador que se encuentra en un estado físico diferente al de los reactivos. está en un estado físico diferente al de los reactivos. Por razones económicas, la mayoría de los procesos industriales utilizan catalizadores heterogéneos en forma de sólidos que se agregan a las soluciones de los reactivos. Debido a que tales catalizadores a menudo contienen metales preciosos caros como el platino o el paladio, tiene sentido formularlos como sólidos que pueden separarse fácilmente de la mezcla líquida o gaseosa de reactante-producto y recuperarse. Ejemplos de catalizadores heterogéneos son los óxidos de hierro utilizados en la síntesis industrial del amoníaco y los convertidores catalíticos que se encuentran en prácticamente todos los automóviles modernos, que contienen metales preciosos como paladio y rodio. La catálisis se discutirá con más detalle cuando discutamos las tasas de reacción, en el segundo semestre pero se encontrará con frecuencia el término a lo largo del texto.
Resumen
Las reacciones químicas pueden clasificarse como una reacción cid-base, una reacción de intercambio, una reacción de condensación y su inversa, una reacción de escisión y una reacción de oxidación-reducción (o redox). Para realizar un seguimiento de los electrones en las reacciones químicas, los estados de oxidación se asignan a los átomos en los compuestos. El estado de oxidación es la carga que tendría un átomo si todos sus electrones enlazantes fueran transferidos completamente al átomo que tiene la mayor atracción por los electrones. En una reacción de oxidación-reducción, un átomo debe perder electrones y otro debe ganar electrones. La oxidación es la pérdida de electrones, y se dice que se oxida un elemento cuyo estado de oxidación aumenta. La reducción es la ganancia de electrones, y se dice que se reduce un elemento cuyo estado de oxidación disminuye. Los oxidantes son compuestos que son capaces de aceptar electrones de otros compuestos, por lo que se reducen durante una reacción de oxidación-reducción. En contraste, los reductores son compuestos que son capaces de donar electrones a otros compuestos, por lo que se oxidan durante una reacción de oxidación-reducción. Una reacción de combustión es una reacción redox en la que el oxidante es O 2 (g). Un enlace amida se forma a partir de la reacción de condensación entre un ácido carboxílico y una amina; es la unidad estructural esencial de proteínas y muchos polímeros. Un catalizador es una sustancia que aumenta la velocidad de una reacción química sin sufrir un cambio químico neto en sí mismo. Un catalizador biológico se llama enzima. La catálisis es una aceleración en la velocidad de una reacción causada por la presencia de una sustancia que no aparece en la ecuación química. Un catalizador homogéneo se dispersa uniformemente en una solución de los reactivos, mientras que un catalizador heterogéneo está presente como una fase diferente, generalmente un sólido.
Llave para llevar
- Las reacciones químicas pueden clasificarse como ácido-base, intercambio, condensación, escisión y oxidación-reducción (redox).
Problemas conceptuales
-
¿Qué es una reacción de combustión? ¿Cómo puede distinguirse de una reacción de intercambio?
-
¿Qué dos productos se forman en la combustión de un compuesto orgánico que contiene solo carbono, hidrógeno y oxígeno? ¿Es posible formar solo estos dos productos a partir de una reacción que no es una reacción de combustión? Explica tu respuesta.
-
¿Qué factores determinan si una reacción puede clasificarse como reacción redox?
-
Nombrar tres características de una reacción redox equilibrada.
-
¿Un oxidante acepta electrones o los dona?
-
¿El estado de oxidación de un reductor se vuelve más positivo o más negativo durante una reacción redox?
-
Se sabe que el nitrógeno, el hidrógeno y el amoníaco han existido en la tierra primordial, sin embargo, las mezclas de nitrógeno e hidrógeno no suelen reaccionar para dar amoníaco. ¿Qué fenómeno natural tendría suficiente energía para iniciar una reacción entre estos dos gases primordiales?
-
Los catalizadores no se agregan a las reacciones en cantidades estequiométricas. ¿Por qué?
-
Indica si cada uno de los siguientes utiliza un catalizador homogéneo o un catalizador heterogéneo.
- El metal platino se utiliza en el convertidor catalítico de un automóvil.
- El nitrógeno es convertido biológicamente en amoníaco por una enzima.
- El monóxido de carbono y el hidrógeno se combinan para formar metano y agua con un catalizador de níquel.
- Un compuesto de rodio disuelto se utiliza como catalizador para la conversión de un alqueno en un alcano.
-
Indica si cada uno de los siguientes utiliza un catalizador homogéneo o un catalizador heterogéneo.
- Los pellets de ZSM-5, un mineral que contiene aluminio y silicio, se utilizan para catalizar la conversión de metanol a gasolina.
- La conversión de glucosa en ácido carboxílico ocurre con catálisis por la enzima glucosa oxidasa.
- El rodio metálico se utiliza para la conversión de monóxido de carbono y agua en dióxido de carbono e hidrógeno.
-
Complete la siguiente tabla para describir algunas diferencias clave entre catálisis homogénea y heterogénea.
Homogéneo heterogéneo número de fases facilidad de separación del producto facilidad de recuperación del catalizador -
Para aumentar la velocidad de una reacción, un científico decidió utilizar un catalizador. Inesperadamente, el científico descubrió que el catalizador disminuyó el rendimiento del producto deseado, en lugar de aumentarlo. ¿Qué pudo haber pasado?
Contestar
-
Homogéneo heterogéneo número de fases monofásico al menos dos fases facilidad de separación del producto difícil fácil facilidad de recuperación del catalizador difícil fácil
Problemas numéricos
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 2 (Sección 7.7) antes de proceder a los Problemas Numéricos.
-
Clasificar cada reacción química según los tipos enumerados en la Tabla 7.5.1
- 12FeCl 2 (s) + 3O 2 (g) → 8FeCl 3 (s) + 2Fe 2 O 3 (s)
- CaCl 2 (aq) + K 2 SO 4 (aq) → CaCl 4 (s) + 2KCl (aq)
- HCl (ac) + NaOH (ac) → NaCl (ac) + H 2 O (l)
- Br 2 (l) + C 2 H 4 (g) → BrCh 2 CH 2 Br (l)
-
Clasificar cada reacción química según los tipos enumerados en la Tabla 7.5.1
- 4FeO (s) + O 2 (g) → 2Fe 2 O 3 (s)
- Ca 3 (PO 4) 2 (s) + 3H 2 SO 4 (aq) → 3Caso 4 (s) + 2H 3 PO 4 (aq)
- HNO 3 (aq) + KOH (aq) → KNO 3 (aq) + H 2 O (l)
- etano (g) + oxígeno (g) → dióxido de carbono (g) + agua (g)
-
Asignar estados de oxidación a los átomos en cada compuesto o ion.
- (NH 4) 2 S
- el ion fosfato
- [AlF 6] 3−
- CU
- HCO 3 −
- NH 4 +
- H 2 SO 4
- ácido fórmico
- n-butanol
-
Asignar estados de oxidación a los átomos en cada compuesto o ion.
- ClO 2
- HO 2 −
- bicarbonato de sodio
- MnO
- PCl 5
- [Mg (H 2 O) 6] 2+
- N 2 O 4
- ácido butanoico
- metanol
-
Equilibrar esta ecuación química:
NaHCO 3 (aq) + H 2 SO 4 (aq) → Na 2 SO 4 (aq) + CO 2 (g) + H 2 O (l)¿Qué tipo de reacción es esta? Justifica tu respuesta.
-
Asignar estados de oxidación a los átomos en cada compuesto.
- nitrato de hierro (III)
- Al 2 O 3
- sulfato de potasio
- Cr 2 O 3
- perclorato de sodio
- Cu 2 S
- hidrazina (N 2 H 4)
- NO 2
- n-pentanol
-
Asignar estados de oxidación a los átomos en cada compuesto.
- carbonato de calcio
- NaCl
- CO 2
- dicromato de potasio
- KmNo 4
- óxido férrico
- Cu (OH) 2
- Na 2 SO 4
- n-hexanol
-
Para cada reacción redox, determinar las identidades del oxidante, el reductor, las especies oxidadas y las especies reducidas.
- H 2 (g) + I 2 (s) → 2HI (g)
- 2Na (s) + 2H 2 O (l) → 2NaOH (ac) + H 2 (g)
- 2F 2 (g) + 2NaOH (aq) → DE 2 (g) + 2NaF (aq) + H 2 O (l)
-
Para cada reacción redox, determinar las identidades del oxidante, el reductor, las especies oxidadas y las especies reducidas.
- 2Na (s) + Cl 2 (g) → 2NaCl (s)
- SiCl 4 (l) + 2Mg (s) → 2MgCl 2 (s) + Si (s)
- 2H 2 O 2 (aq) → 2H 2 O (l) + O 2 (g)
-
Equilibrar cada ecuación química. Luego identificar el oxidante, el reductor, las especies oxidadas y las especies reducidas. (Δ indica que la reacción requiere calentamiento.)
- H 2 O (g) + CO (g) → CO 2 (g) + H 2 (g)
- la reacción de óxido de aluminio, carbono y gas cloro a 900ºC para producir cloruro de aluminio y monóxido de carbono
-
Equilibrar cada ecuación química. Luego identificar el oxidante, el reductor, las especies oxidadas y las especies reducidas. (Δ indica que la reacción requiere calentamiento.)
- la reacción de agua y carbono a 800ºC para producir hidrógeno y monóxido de carbono
- Mn (s) + S 8 (s) + CaO (s) → CaS (s) + MnO (s)
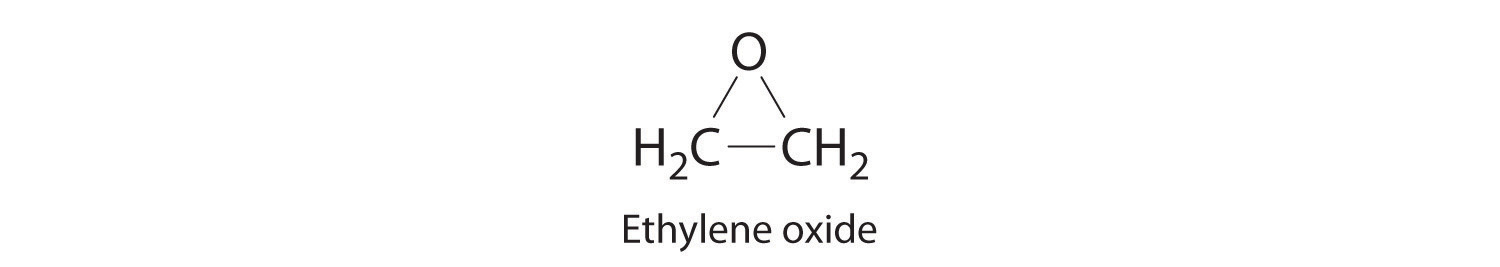
- la reacción de etileno y oxígeno a temperatura elevada en presencia de un catalizador de plata para producir óxido de etileno
- ZnS (s) + H 2 SO 4 (aq) + O 2 (g) → ZnSO 4 (aq) + S 8 (s) + H 2 O (l)
-
La plata se empaña con sulfuro de hidrógeno, un contaminante atmosférico, para formar una fina capa de sulfuro de plata oscura (Ag 2 S) junto con gas hidrógeno.
- Escribe una ecuación química equilibrada para esta reacción.
- ¿Qué especies se han oxidado y cuáles se han reducido?
- Suponiendo que 2.2 g de Ag se hayan convertido en sulfuro de plata, construya una tabla que muestre la reacción en términos del número de átomos en los reactivos y productos, los moles de reactivos y productos, los gramos de reactivos y productos, y las moléculas de reactivos y productos.
-
La siguiente reacción se utiliza en la industria del papel y la pulpa:
Na 2 SO 4 (aq) + C (s) + NaOH (aq) → Na 2 CO 3 (aq) + Na 2 S (aq) + H 2 O (l)- Equilibrar la ecuación química.
- Identificar el oxidante y el reductor.
- ¿Cuánto carbono se necesita para convertir 2.8 kg de sulfato de sodio en sulfuro de sodio?
- Si el rendimiento de la reacción fuera solo 78%, ¿cuántos kilogramos de carbonato de sodio se producirían a partir de 2.80 kg de sulfato de sodio?
- Si en la reacción se utilizaran 240 g de carbono y 2.80 kg de sulfato de sodio, ¿cuál sería el reactivo limitante (suponiendo un exceso de hidróxido de sodio)?
-
A continuación se muestra la reacción de A2 (azul) con B 2 (amarillo). La mezcla de reacción inicial se muestra a la izquierda y la mezcla después de que la reacción se haya completado se muestra a la derecha.
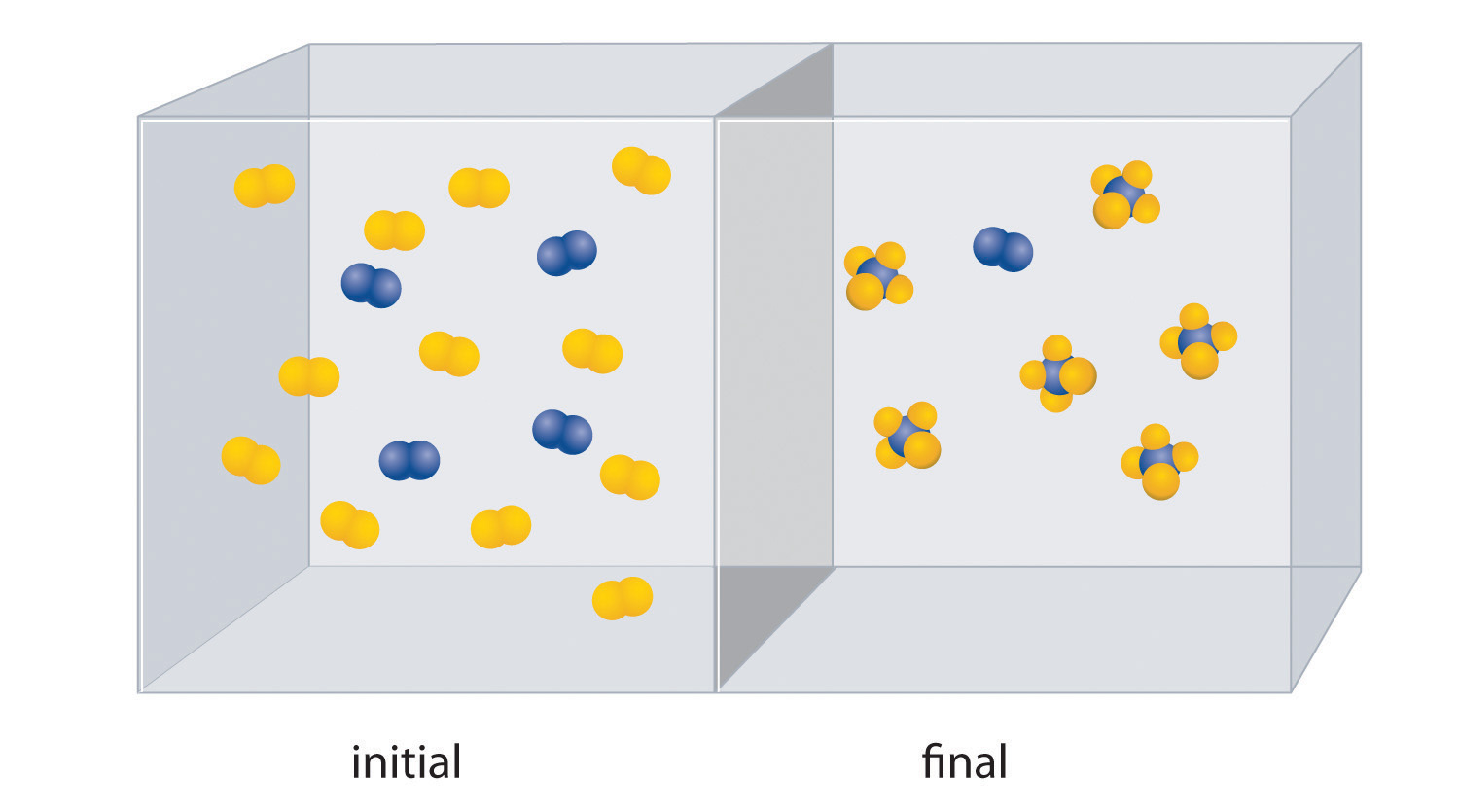
- Escribe una ecuación química equilibrada para la reacción.
- ¿Cuál es el reactivo limitante en la mezcla de reacción inicial?
- ¿Cuántos moles del producto AB 4 se podría obtener de una mezcla de 0.020 mol A 2 y 0.060 mol B 2?
-
A continuación se muestra la reacción de X 4 (naranja) con Y 2 (negro). La mezcla de reacción inicial se muestra a la izquierda y la mezcla después de que la reacción se haya completado se muestra a la derecha.
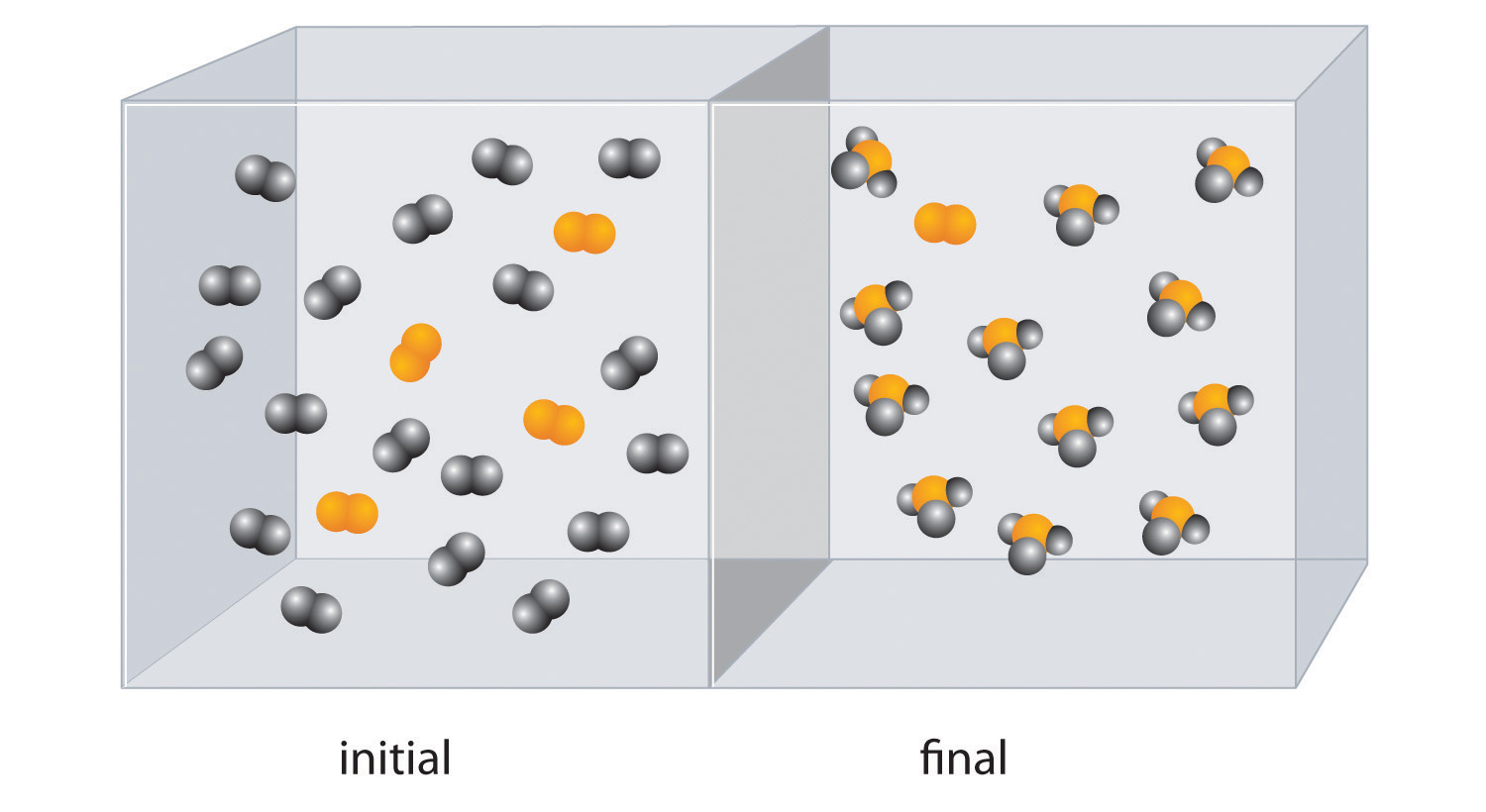
- Escribe una ecuación química equilibrada para la reacción.
- ¿Cuál es el reactivo limitante en la mezcla de reacción inicial?
- ¿Cuántos moles del producto XY 3 podrías obtener de una mezcla de 0.100 mol X 4 y 0.300 mol Y 2?
-
El butirato de metilo, un sabor artificial de manzana utilizado en la industria alimentaria, se produce mediante la reacción del ácido butanoico con metanol en presencia de un catalizador ácido (H +):
\[ CH_{3}CH_{2}CH_{2}COOH\left ( l \right )+ CH_{3}OH\left ( l \right ) \overset{H^{+}}{\rightarrow} CH_{3}CH_{2}CH_{2}CO_{2}CH_{3}\left ( l \right )+H_{2}O\left ( l \right ) \]
- Dados 7.8 g de ácido butanoico, ¿cuántos gramos de butirato de metilo se sintetizarían, asumiendo un rendimiento del 100%?
- La reacción produjo 5.5 g de butirato de metilo. ¿Cuál fue el porcentaje de rendimiento?
- ¿El catalizador utilizado en esta reacción es heterogéneo u homogéneo?
-
En presencia de un catalizador de platino, hidrógeno y bromo reaccionan a temperaturas elevadas (300°C) para formar bromuro de hidrógeno (el calor se indica por Δ):
\[ H_{2\left ( g \right )}+Br_{2}\left ( l \right ) \xrightarrow[\Delta ]{Pt}2HBr\left ( g \right ) \]
Teniendo en cuenta lo siguiente, calcular la masa de bromuro de hidrógeno producido:
- 8.23 × 10 22 moléculas de H 2
- 6.1 × 10 3 mol de H 2
- 1.3 × 10 5 g de H 2
- ¿El catalizador utilizado en esta reacción es heterogéneo u homogéneo?
RESPUESTAS
-
- reacción redox
- intercambio
- ácido-base
- condensación
-
- S, −2; N, −3; H, +1
- P, +5; O, −2
- F, −1; Al, +3
- S, −2; Cu, +2
- H, +1; O, −2; C, +4
- H, +1; N, −3
- H, +1; O, −2; S, +6
- H, +1, O, −2; C, +2
- butanol:
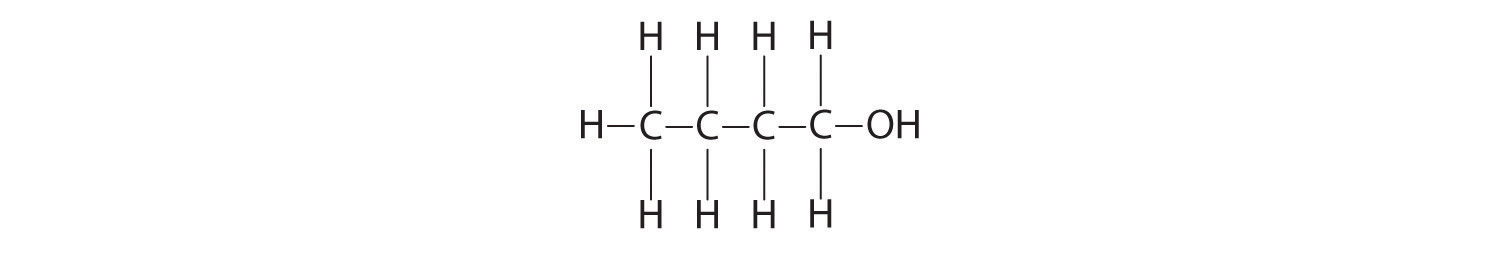
O, −2; H, +1
De izquierda a derecha: C, −3—2—2—1
-
2NaHCO 3 (ac) + H 2 SO 4 (ac) → Na 2 SO 4 (ac) + 2CO 2 (g) + 2H 2 O (l) reacción ácido-base
-
- Ca, +2; O, −2; C, +4
- Na, +1; Cl, −1
- O, −2; C, +4
- K, +1; O, −2; Cr, +6
- K, +1; O, −2; Mn, +7
- O, −2; Fe, +3
- O, −2; H, +1; Cu, +2
- O, −2; S, +6
- Hexanol
O, −2; H, +1
De izquierda a derecha: C: −3, −2, −2, −2, −2, −1
-
- El Na es el reductor y se oxida. Cl 2 es el oxidante y se reduce.
- El Mg es el reductor y se oxida. El Si es el oxidante y se reduce.
- H 2 O 2 es tanto el oxidante como el reductor. Una molécula se oxida y una molécula se reduce.
-
- H 2 O (g) + C (s) → H 2 (g) + CO (g)
C es el reductor y se oxida. H 2 O es el oxidante y se reduce.
- 8Mn (s) + S 8 (s) + 8CaO (s) → 8CaS (s) + 8MnO (s)
El Mn es el reductor y se oxida. El S 8 es el oxidante y se reduce.
- 2C 2 H 4 (g) + O 2 (g) → 2C 2 H 4 O (g)
El etileno es el reductor y se oxida. O 2 es el oxidante y se reduce.
- 8ZnS (s) + 8H 2 SO 4 (aq) + 4O 2 (g) → 8ZnSO 4 (aq) + S 8 (s) + 8H 2 O (l)
El sulfuro en ZnS es el reductor y se oxida. O 2 es el oxidante y se reduce.
- H 2 O (g) + C (s) → H 2 (g) + CO (g)
-
- Na 2 SO 4 + 2C + 4NaOH → 2Na 2 CO 3 + Na 2 S + 2H 2 O
- El ion sulfato es el oxidante, y el reductor es carbono.
- 470 g
- 3300 g
- carbono
-
- 22.1 g
- 9.9 × 10 5 g
- 1.0 × 10 7 g
- heterogéneo
Colaboradores
- Anonymous
Modificado por Joshua Halpern


