3.4: Relaciones de masas en ecuaciones químicas
- Page ID
- 78367
- Calcular las cantidades de compuestos producidos o consumidos en una reacción química.
Una ecuación química equilibrada da la identidad de los reactivos y los productos, así como el número exacto de moléculas o moles de cada uno que se consumen o producen. La estequiometría es un término colectivo para las relaciones cuantitativas entre las masas, el número de moles y el número de partículas (átomos, moléculas e iones) de los reactivos y los productos en una ecuación química equilibrada. Una cantidad estequiométrica es la cantidad de producto o reactivo especificada por los coeficientes en una ecuación química equilibrada. En la Sección 7.3, por ejemplo, aprendió a expresar la estequiometría de la reacción para el volcán dicromato de amonio en términos de los átomos, iones o moléculas involucradas y los números de moles, gramos y unidades de fórmula de cada uno (reconociendo, por ejemplo, que 1 mol de dicromato de amonio produce 4 mol de agua). En esta sección se describe cómo utilizar la estequiometría de una reacción para responder preguntas como las siguientes: ¿Cuánto oxígeno se necesita para asegurar la combustión completa de una cantidad dada de isooctano? (Esta información es crucial para el diseño de motores automotrices no contaminantes y eficientes). ¿Cuántos gramos de oro puro se pueden obtener de una tonelada de mineral de oro de baja calidad? (La respuesta determina si vale la pena extraer el yacimiento de mineral). Si una planta industrial debe producir un cierto número de toneladas de ácido sulfúrico por semana, ¿cuánto azufre elemental debe llegar por ferrocarril cada semana?
Todas estas preguntas pueden ser respondidas utilizando los conceptos de las masas molar y molar y fórmula, junto con los coeficientes en la ecuación química equilibrada apropiada.
Problemas de estequiometría
Cuando realizamos una reacción ya sea en un entorno industrial o en un laboratorio, es más fácil trabajar con masas de sustancias que con el número de moléculas o moles. El método general para convertir de la masa de cualquier reactivo o producto a la masa de cualquier otro reactivo o producto usando una ecuación química equilibrada se describe en la Figura\(\PageIndex{1}\) y se describe en el siguiente texto.
Pasos en la conversión entre masas de reactivo y producto
- Convertir la masa de una sustancia (sustancia A) al número de moles correspondiente utilizando su masa molar.
- A partir de la ecuación química equilibrada, obtener el número de moles de otra sustancia (B) a partir del número de moles de sustancia A utilizando la proporción molar apropiada (la relación de sus coeficientes).
- Convertir el número de moles de sustancia B a masa usando su masa molar. Es importante recordar que algunas especies están en exceso en virtud de las condiciones de reacción. Por ejemplo, si una sustancia reacciona con el oxígeno en el aire, entonces el oxígeno está en un exceso obvio (pero no declarado).
Convertir cantidades de sustancias en moles —y viceversa— es la clave de todos los problemas estequiométricos, ya sea que las cantidades se den en unidades de masa (gramos o kilogramos), peso (libras o toneladas) o volumen (litros o galones).
Figura \(\PageIndex{1}\)A Diagrama de flujo para cálculos estequiométricos que involucran sustancias puras
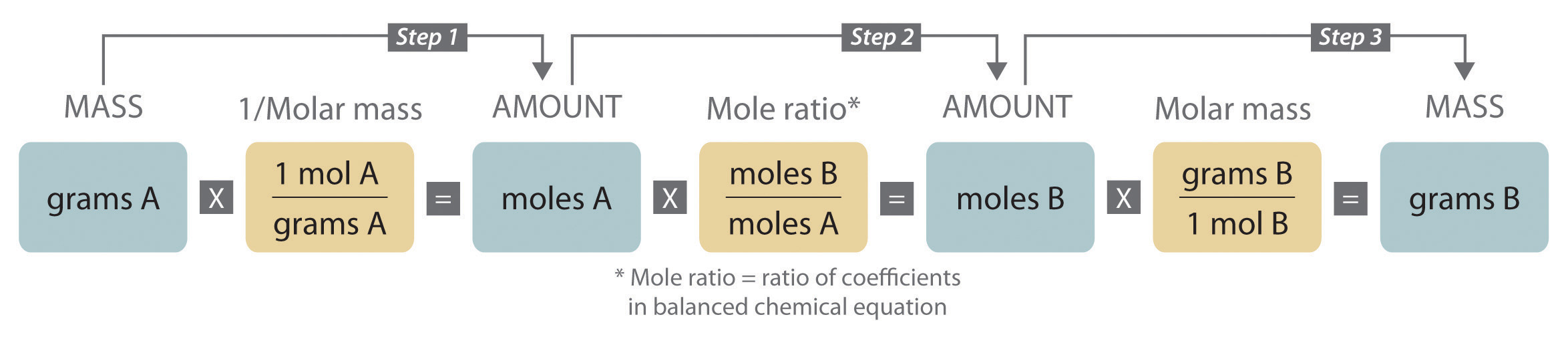
Las masas molares de los reactivos y los productos se utilizan como factores de conversión para que se pueda calcular la masa del producto a partir de la masa del reactivo y viceversa.
Para ilustrar este procedimiento, volvamos a la combustión de la glucosa. Vimos antes que la glucosa reacciona con el oxígeno para producir dióxido de carbono y agua:
\[{C_6}{H_{12}}{O_6}\left( s \right) + 6{O_2}\left( g \right){\text{ }} \to 6C{O_2}\left( g \right) + 6{H_2}O\left( l \right) \]
Justo antes de un examen de química, suponga que un amigo te recuerda que la glucosa es el principal combustible que usa el cerebro humano. Por lo tanto, decides comerte una barra de caramelo para asegurarte de que tu cerebro no se quede sin energía durante el examen (aunque no haya evidencia directa de que el consumo de barras de caramelo mejore el rendimiento en los exámenes de química). Si una barra de caramelo típica de 2 oz contiene el equivalente a 45.3 g de glucosa y la glucosa se convierte completamente en dióxido de carbono durante el examen, ¿cuántos gramos de dióxido de carbono producirá y exhalará a la sala de examen?
El paso inicial para resolver un problema de este tipo debe ser escribir la ecuación química equilibrada para la reacción. La inspección de la Eq\(\PageIndex{1}\) muestra que está balanceada tal como está escrita, por lo que podemos proceder a la estrategia esbozada en la Figura\(\PageIndex{1}\), adaptándola de la siguiente manera:
- Utilizar la masa molar de glucosa (a un decimal, 180.2 g/mol) para determinar el número de moles de glucosa en la barra de caramelo: \( moles\; glucose=45.3\cancel{g\; glucose}\times \dfrac{1\; mol\; glucose}{180.2\; \cancel{g\; glucose}}=0.251\; mol\; glucose \notag \)
- De acuerdo con la ecuación química equilibrada, se producen 6 moles de CO 2 por mol de glucosa; la relación molar de CO 2 a glucosa es por lo tanto de 6:1. Si dividimos el número de moles de CO2 por su coeficiente estequiométrico 6 y el número de moles de glucosa por su coeficiente estequiométrico de uno las proporciones, que pueden denominarse equivalentes de reacción, son iguales. (Paso 2a) Lo usaremos a continuación para demostrar otro método para resolver problemas estequiométricos de todo tipo
\( \dfrac{moles\; CO_{2}}{6\; mol\; CO_{2}} =\dfrac{moles\; glucose}{1\; mol\; glucose} \notag \)
El número de moles de CO 2 producidos es así
\ (\ begin {matriz}
moles CO_ {2} & = & mol\; glucosa\;\ veces\ dfrac {6\; mol\; mol\; CO_ {2}} {1\; mol\; glucosa}\\
&
& & = & 0.251\;\ cancel {mol\; glucosa}\ veces\ dfrac {6\; mol\; CO_ {2}} {1\;\ cancel {mol\; glucosa}}\\
& &\\
& = & 1.51\; mol\; CO_ {2}
\ final {matriz}\ noetiqueta\)
3. Utilizar la masa molar de CO 2 (44.010 g/mol) para calcular la masa de CO 2 correspondiente a 1.51 mol de CO 2:
\( mass\; of\; CO_{2}=1.51\; \cancel{mol\; CO_{2}}\times \dfrac{44.010\; g\; CO_{2}}{1\; \cancel{mol\; CO_{2}}}=66.5\; g\; CO_{2} \notag \)
4 Podemos resumir estas operaciones de la siguiente manera:
\ (\ begin {matriz}
45.3\; g\; glucosa &\ veces\ dfrac {1\; mol\; glucosa} {180.2\; g\; glucosa} &\ veces\ dfrac {6\; mol\; CO_ {2}} {1\; mol\; glucosa} &\ veces\ dfrac {44.010\; g\; CO_ {2}} {1\; mol\; CO_ {2}} &=66,4\; g\; CO_ {2}\\
& paso\; 1 & paso\; 2 & paso\; 3 &
\ end {matriz}\ noetiqueta\)
Las discrepancias entre los dos valores se atribuyen a errores de redondeo resultantes del uso de cálculos paso a paso en los pasos 1—3. (Para más información sobre redondeo y dígitos significativos. (Ver Habilidades Esenciales 1 en la Sección 1.10) En el Capítulo 9, descubrirás que esta cantidad de dióxido de carbono gaseoso ocupa un volumen enorme, más de 33 L. Podríamos usar métodos similares para calcular la cantidad de oxígeno consumido o la cantidad de agua producida.
Solo usamos la ecuación química balanceada para calcular la masa de producto que se forma a partir de una cierta cantidad de reactivo. También podemos usar la ecuación química equilibrada para determinar las masas de reactivos que son necesarias para formar una cierta cantidad de producto o, como se muestra en el Ejemplo 11, la masa de un reactivo que se requiere para consumir una masa dada de otro reactivo.
Hay otra forma de tratar este tipo de problemas que es más fácil de llevar a cabo. Comienza escribiendo la ecuación química balanceada y luego dibujando una tabla con cinco filas y tantas columnas como reactantes y productos haya y escribiendo en la Masa del reactivo dado
| C 6 H 12 O 6 (s) | + 6 O 2 (g) | → 6 C O 2 (g) | + 6 H 2 O (l) | |
| Masa (g) | 45.3 | |||
| Peso molecular (g/mol) | ||||
| Moles | ||||
| Coeficientes estequiométricos | ||||
| Equivalentes estequiométricos |
Luego simplemente rellenamos los coeficientes estequiométricos y los pesos moleculares de los reactivos y los productos que nos interesan
| C 6 H 12 O 6 (s) | + 6 O 2 (g) | → 6 C O 2 (g) | + 6 H 2 O (l) | |
| Masa (g) | 45.3 | |||
| Peso molecular (g/mol) | 180.2 | |||
| Moles | ||||
Coeficientes estequiométricos |
1 | 6 | ||
Equivalentes estequiométricos |
Luego divide la masa de la glucosa por el peso molecular para encontrar el número de moles de glucosa. En el siguiente paso divide el número de moles por el coeficiente estequiométrico para encontrar los equivalentes estequiométricos (esto es lo mismo que el paso 2a anterior. La regla es dividir bajando la mesa. Divides la Masa por el Peso Molecular para encontrar el número de Moles, divides el número de Moles por los Coeficientes Estequiométricos para encontrar el número de Equivalentes Estequiométricos
| C 6 H 12 O 6 (s) | + 6 O 2 (g) | → 6 C O 2 (g) | + 6 H 2 O (l) | |
| Masa (g) | 45.3 | |||
| Peso molecular (g/mol) | 180.2 | |||
| Moles | 0.251 | |||
Coeficientes estequiométricos |
1 | 6 | ||
Equivalentes estequiométricos |
0.251 |
Para cada uno de los productos y reactivos, los Equivalentes Estequiométricos serán los mismos (son equivalentes, simplemente copian a través).
| C 6 H 12 O 6 (s) | + 6 O 2 (g) | → 6 C O 2 (g) | + 6 H 2 O (l) | |
| Masa (g) | 45.3 | 66.4 | ||
| Peso molecular (g/mol) | 180.2 | 44.01 | ||
| Moles | 0.251 | 1.51 | ||
Coeficientes estequiométricos |
1 | 6 | ||
Equivalentes estequiométricos |
0.251 | 0.251 |
Ahora multiplicar subiendo. Multiplique los Equivalentes Estequiométricos por el Coe Estequiométrico competente para encontrar el número de Moles de CO 2 y luego multiplicar el número de Moles de CO2 por el Peso Molecular de CO2 para encontrar la Masa de CO2 producida en la reacción. Una inspección cercana de ambos métodos demostrará que son equivalentes. La mesa tiene la ventaja de que es un ejercicio de “llenar los espacios”, y prácticamente automático. De hecho podrías escribir fácilmente una hoja de cálculo Excel para hacerlo. El método de la tabla tiene ventajas si queremos responder a preguntas como cuánta agua se producirá o cuánto oxígeno se consumirá. También es más simple para problemas de reactivos limitantes más complicados.
Como ejemplo, ahora podemos averiguar cuánto oxígeno se consume y cuánta agua producirá este reacti encendido. Simplemente use el mismo método que para el CO2.
| C 6 H 12 O 6 (s) | + 6 O 2 (g) | → 6 C O 2 (g) | + 6 H 2 O (l) | |
| Masa (g) | 45.3 | 48.32 | 66.4 | 27.2 |
| Peso molecular (g/mol) | 180.2 | 32.00 | 44.01 | 18.02 |
| Moles | 0.251 | 1.51 | 1.51 | 1.51 |
Coeficientes estequiométricos |
1 | 6 | 6 | 6 |
Equivalentes estequiométricos |
0.251 | 0.251 | 0.251 | 0.251 |
Observe que todos los Equivalentes Estequiométricos son iguales y que multiplicamos los Equivalentes Estequiométricos por los Coeficientes Estequiométricos para encontrar el número de Moles, y el número de Moles por el Peso Molecular para encontrar la Masa.
La combustión de hidrógeno con oxígeno para producir agua gaseosa es extremadamente vigorosa, produciendo una de las llamas más calientes conocidas. Debido a que se libera tanta energía para una masa dada de hidrógeno u oxígeno, esta reacción se utilizó para alimentar los transbordadores espaciales de la NASA (Administración Nacional de Aeronáutica y del Espacio), que recientemente han sido retirados del servicio. Los ingenieros de la NASA calcularon la cantidad exacta de cada reactivo necesario para el vuelo para asegurarse de que los transbordadores no llevaran el exceso de combustible a la órbita. Calcule cuántas toneladas de hidrógeno necesitaba transportar un transbordador espacial por cada 1.00 tn de oxígeno (1 tn = 2000 lb).

El transbordador espacial estadounidense Discovery durante el despegue. El cilindro grande en el medio contiene el oxígeno y el hidrógeno que alimentaron el motor principal del transbordador.
Dado: reactivos, productos y masa de un reactivo
Preguntado por: masa de otro reactivo
Estrategia:
A Escribe la ecuación química equilibrada para la reacción.
B Convertir la masa de oxígeno en moles. A partir de la relación molar en la ecuación química equilibrada, determinar el número de moles de hidrógeno requeridos. Después convertir los moles de hidrógeno a la masa equivalente en toneladas.
Solución
Utilizamos la misma estrategia general para resolver cálculos estequiométricos que en el ejemplo anterior. Debido a que la cantidad de oxígeno se da en toneladas en lugar de gramos, sin embargo, también necesitamos convertir toneladas en unidades de masa en gramos. Se necesita otra conversión al final para reportar la respuesta final en toneladas.
A Primero usamos la información dada para escribir una ecuación química equilibrada. Debido a que conocemos la identidad tanto de los reactivos como del producto, podemos escribir la reacción de la siguiente manera:
\[{H_2}\left( g \right) + {O_2}\left( g \right){\text{ }} \to {H_2}O\left( g \right) \notag \]
Esta ecuación no está equilibrada porque hay dos átomos de oxígeno en el lado izquierdo y sólo uno en el derecho. Al asignar un coeficiente de 2 tanto a H 2 O como a H 2 se obtiene la ecuación química equilibrada:
\[2{H_2}\left( g \right) + {O_2}\left( g \right){\text{ }} \to 2{H_2}O\left( g \right) \notag \]
Así, 2 moles de H2 reaccionan con 1 mol de O2 para producir 2 moles de H 2 O.
B Para convertir toneladas de oxígeno en unidades de masa en gramos, multiplicamos por los factores de conversión apropiados:
\( mass\; of\; O_{2}=1.0\; \cancel{tn} \times \dfrac{2000\; \cancel{lb}}{\cancel{tn}}\times \dfrac{4453.6\; g}{\cancel{lb}}= 9.07\times 10^{5}\; g\; O_{2} \notag \)
Usando la masa molar de O 2 (32.00 g/mol a cuatro cifras significativas) podemos calcular el número de moles de O 2 contenidos en esta masa de O 2
\( mol\; O_{2}=9.07\times 10^{5}\; \cancel{g\; O_{2}} \times \dfrac{1\; mol\; O_{2}}{32.00\; \cancel{g\; O_{2}}}= 2.83\times 10^{4}\; mol\; O_{2} \notag \)
- Ahora usa los coeficientes en la ecuación química balanceada para obtener el número de moles de H 2 necesarios para reaccionar con este número de moles de O 2:
- La masa molar de H 2 (2.016 g/mol) nos permite calcular la masa correspondiente de H 2:
Finalmente, convierta la masa de H 2 a las unidades deseadas (toneladas) utilizando los factores de conversión apropiados:
El transbordador espacial tuvo que ser diseñado para transportar 0.126 tn de H 2 por cada 1.00 tn de O 2. A pesar de que se necesitan 2 moles de H 2 para reaccionar con cada mol de O 2, la masa molar de H2 es tanto menor que la de O 2 que solo se necesita una masa relativamente pequeña de H2 en comparación con la masa de O2.
Los alquimistas produjeron mercurio elemental tostando el mineral cinabrio (HG) que contiene mercurio en el aire:
\[HgS\left( s \right) + {O_2}\left( g \right){\text{ }} \to {\text{ }}Hg\left( l \right) + S{O_2}\left( g \right) \notag \]
La volatilidad y toxicidad del mercurio hacen de este un procedimiento peligroso, lo que probablemente acortó la vida útil de muchos alquimistas. Dados 100 g de cinabrio, ¿cuánto mercurio elemental se puede producir a partir de esta reacción?
- Contestar
-
86.2 g
Reactivos limitantes
En todos los ejemplos discutidos hasta ahora, se asumió que los reactivos estaban presentes en cantidades estequiométricas. En consecuencia, ninguno de los reactivos quedó al final de la reacción. Esto suele ser deseable, como en el caso de un transbordador espacial, donde el exceso de oxígeno o hidrógeno no solo era carga extra para ser arrastrada a órbita sino también un peligro de explosión. Más a menudo, sin embargo, los reactivos están presentes en relaciones molares que no son las mismas que la relación de los coeficientes en la ecuación química equilibrada. En consecuencia, uno o más de ellos no se agotarán por completo sino que quedarán cuando se complete la reacción. En esta situación, la cantidad de producto que se puede obtener está limitada por la cantidad de solo uno de los reactivos. El reactivo que restringe la cantidad de producto obtenido se denomina reactivo limitante. El reactivo que queda después de que una reacción ha llegado a su finalización está en exceso.
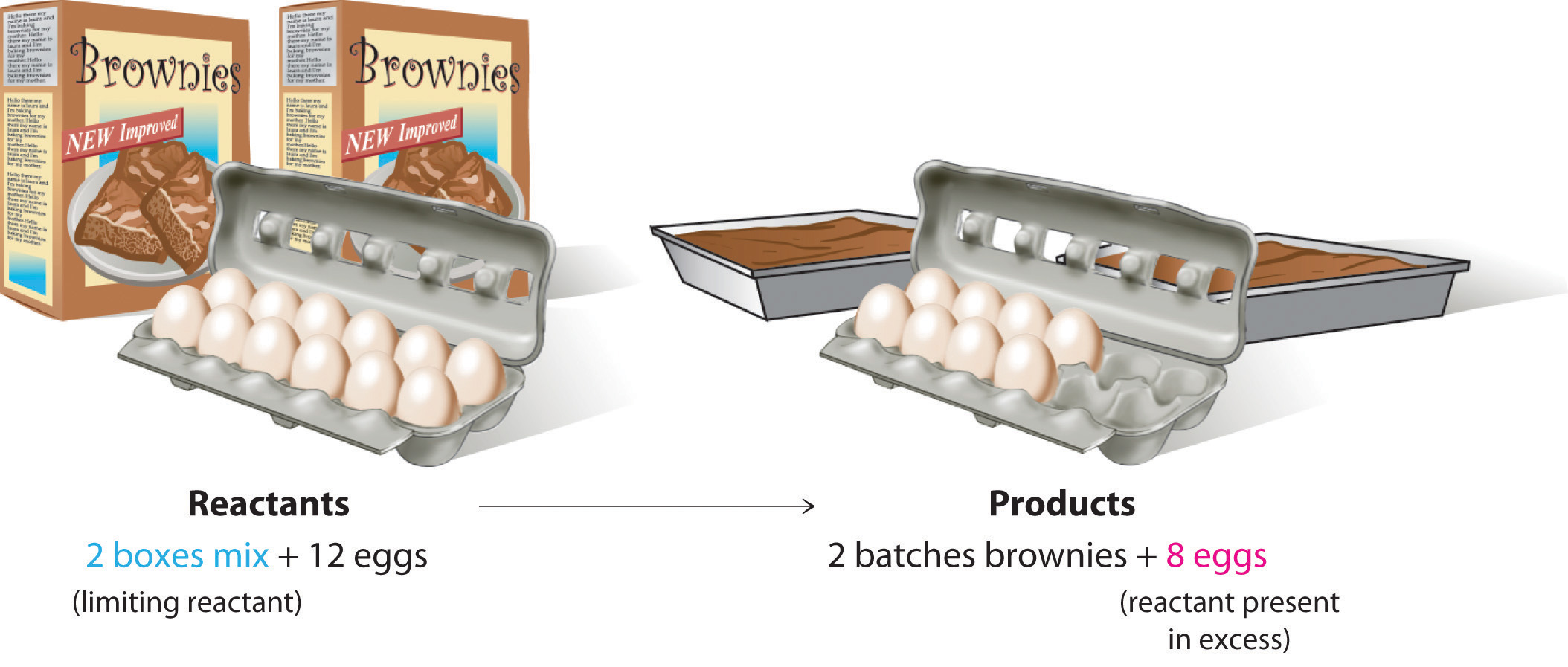
Para estar seguro de que entiendes estos conceptos, primero consideremos un ejemplo no químico. Asume que has invitado a algunos amigos a cenar y quieres hornear brownies de postre. Encuentras dos cajas de mezcla de brownie en tu despensa y ves que cada paquete requiere dos huevos. La ecuación equilibrada para la preparación de brownie es así
\[1{\text{ }}box{\text{ }}mix + 2{\text{ }}eggs{\text{ }} \to {\text{ }}1{\text{ }}batch{\text{ }}brownies \]
Si tienes una docena de huevos, ¿qué ingrediente determinará el número de lotes de brownies que puedes preparar? Debido a que cada caja de mezcla de brownie requiere dos huevos y tienes dos cajas, necesitas cuatro huevos. Doce huevos son ocho huevos más de los que necesitas. Si bien la proporción de huevos a cajas en la Eq\(\PageIndex{2}\) es de 2:1, la proporción en su posesión es de 6:1. De ahí que los huevos sean el ingrediente (reactante) presente en exceso, y la mezcla de brownie es el reactivo limitante (Figura \(\PageIndex{2}\)). Aunque tuvieras un refrigerador lleno de huevos, solo podrías hacer dos lotes de brownies.
Figura\(\PageIndex{2}\) El concepto de un reactivo limitante en la preparación de brownies
Pasemos ahora a un ejemplo químico de un reactivo limitante: la producción de titanio puro. Este metal es bastante ligero (45% más ligero que el acero y solo 60% más pesado que el aluminio) y tiene una gran resistencia mecánica (tan fuerte como el acero y dos veces más fuerte que el aluminio). Debido a que también es altamente resistente a la corrosión y puede soportar temperaturas extremas, el titanio tiene muchas aplicaciones en la industria aeroespacial. El titanio también se utiliza en implantes médicos y carcasas de computadoras portátiles porque es ligero y resistente a la corrosión. Si bien el titanio es el noveno elemento más común en la corteza terrestre, es relativamente difícil de extraer de sus minerales. En el primer paso del proceso de extracción, los minerales de óxido que contienen titanio reaccionan con carbono sólido y gas cloro para formar tetracloruro de titanio (TiCl 4) y dióxido de carbono. El tetracloruro de titanio se convierte entonces en titanio metálico por reacción con magnesio metálico a alta temperatura:
\[TiC{l_4}\left( g \right) + 2Mg\left( l \right){\text{ }} \to {\text{ }}Ti\left( s \right) + 2MgC{l_2}\left( l \right) \]
Debido a que los minerales de titanio, el carbono y el cloro son bastante económicos, el alto precio del titanio (alrededor de $100 por kilogramo) se debe en gran parte al alto costo del metal magnesio. Bajo estas circunstancias económicamente uno querría maximizar el uso del magnesio asegurándose de que no quedaba ninguno durante la producción de titanio metálico. Si sobrara un poquito del cloruro de titanio (IV) eso no sería tan alargante.
Uso médico del titanio. Aquí hay un ejemplo de su uso exitoso en implantes de reemplazo articular.
Supongamos que tiene 1.00 kg de tetracloruro de titanio y 200 g de metal de magnesio. ¿Cuánto metal titanio se puede producir de acuerdo a la Ecuación \(\PageIndex{3}\)? Resolver este tipo de problemas requiere que lleves a cabo los siguientes pasos:
- Determinar el número de moles de cada reactivo.
- Comparar la relación molar de los reactivos con la relación en la ecuación química equilibrada para determinar qué reactivo es limitante.
- Calcular el número de moles de producto que se pueden obtener del reactivo limitante.
- Convertir el número de moles de producto en masa de producto.
- Para determinar el número de moles de reactivos presentes, se debe calcular o buscar sus masas molares: 189.679 g/mol para tetracloruro de titanio y 24.305 g/mol para magnesio. El número de moles de cada uno se calcula de la siguiente manera:
\ [\ begin {matriz}
moles TiCl_ {4} &=\ dfrac {masa\; TiCl_ {4}} {molar\; masa\; TiCl_ {4}}\\
&\
&=1000\;\ cancel {g\; TiCl_ {4}}\ times\ dfrac {1\; mol\; TiCl_ _ {4}} {189.679\;\ cancel {g\; TiCl_ {4}}} =5.272\; mol\; TiCl_ {4}\\
&\
moles Mg &=\ dfrac {masa\; Mg} {molar\; masa\; Mg}\\
&\
&=200\;\ cancelar {g\; Mg}\ veces\ frac {1\; mol\; Mg} {24.305\;\ cancelar {g\; Mg} ==8.23\; mol\; Mg
\ final {matriz}\ noetiqueta \] - Tienes más moles de magnesio que de tetracloruro de titanio, pero la proporción es solo
\[\dfrac{mol\; Mg}{mol\; TiCl_{4}} = \dfrac{8.23\; mol}{5.272\; mol} = 1.56 \notag \]
Porque la relación de los coeficientes en la ecuación química equilibrada es
\[\dfrac{2\; mol\; Mg}{1 mol\; TiCl_{4}} = 2 \notag \]no tienes suficiente magnesio para reaccionar con todo el tetracloruro de titanio. Si este punto no está claro a partir de la relación molar, se debe calcular el número de moles de un reactivo que se requiere para la reacción completa del otro reactivo. Por ejemplo, tienes 8.23 mol de Mg, por lo que necesitas (8.23 ÷ 2) = 4.12 mol de TiCl 4 para completar la reacción. Debido a que tienes 5.272 mol de TiCl 4, el tetracloruro de titanio está presente en exceso. Por el contrario, 5.272 mol de TiCl 4 requiere 2 × 5.272 = 10.54 mol de Mg, pero solo tienes 8.23 mol. Entonces el magnesio es el reactivo limitante.
- Debido a que el magnesio es el reactivo limitante, el número de moles de magnesio determina el número de moles de titanio que se pueden formar:
\( moles\; Ti = 8.23\; \cancel{mol\; Mg}\times \dfrac{1\; mol Ti}{2\; \cancel{mol\; Mg}}=4.12\; mol\; Ti \notag \)
De esta manera solo se pueden formar 4.12 moles de Ti.
- Para calcular la masa de titanio metálico que puedes obtener, multiplica el número de moles de titanio por la masa molar de titanio (47.867 g/mol): \[ moles\; Ti=mass\; Ti\times molar\; mass\; Ti=4.12\; \cancel{mol\; Ti}\times \frac{47.867\; g\; Ti}{1\; mol\; Ti}=197\; g\; Ti \notag \]
Aquí hay una manera simple y confiable de identificar el reactivo limitante en cualquier problema de este tipo:
- Calcular el número de moles de cada reactivo presente: 5.272 mol de TiCl 4 y 8.23 mol de Mg.
- Divide el número real de moles de cada reactivo por su coeficiente estequiométrico en la ecuación química equilibrada:
\ [\ begin {matrix}
TiCl_ {4}:\ dfrac {5.272\; mol\ left (real\ right)} {1\; mol\;\ left (stoich\ right)} =5.272 & M g:\dfrac {8.23\; mol\ left (real\ right)} {2\; mol\;\ izquierda (stoich\ derecha)} =4.12
\ final {matriz}\ noetiqueta\] - El reactivo con la relación molar más pequeña es limitante. El magnesio, con una relación molar estequiométrica calculada de 4.12, es el reactivo limitante.
| TiCL 4 (s) | + 2Mg (s) | → 2MgCl 2 (s) | + Ti (s) | |
| Masa (g) | 1000 | 200 | ||
| Peso molecular (g/mol) | 189.67 | 24.31 | ||
| Moles | 5.27 | 8.23 | ||
Coeficientes estequiométricos |
1 | 2 | ||
Equivalentes estequiométricos |
5.27 | 4.11 |
Debido a que el número de Equivalentes Estequiométricos para el Mg es menor, es el reactivo limitante. Ahora simplemente realizamos el cálculo de Tabla para Ti (s) para encontrar la masa de Ti producida. De igual manera se pudo calcular la masa de MgCl 2 (s) producida o incluso la cantidad de TiCl 4 (s) que se consumió en la reacción. Recuerden que dividimos bajando por la mesa y multiplicamos subiendo.
| TiCL 4 (s) | + 2Mg (s) | → 2MgCl 2 (s) | + Ti (s) | |
| Masa (g) | 1000 | 200 | 196.9 | |
| Peso molecular (g/mol) | 189.67 | 24.31 | 47.87 | |
| Moles | 5.27 | 8.23 | 4.11 | |
Coeficientes estequiométricos |
1 | 2 | 1 | |
Equivalentes estequiométricos |
5.27 | 4.11 | 4.11 |
Como aprendiste en el Capítulo 1, la densidad es la masa por unidad de volumen de una sustancia. Si se nos da la densidad de una sustancia, podemos utilizarla en cálculos estequiométricos que involucren reactivos líquidos y/o productos, como demuestra el Ejemplo 12.
El acetato de etilo (CH 3 CO 2 C 2 H 5) es el disolvente en muchos quitaesmalte de uñas y se utiliza para descafeinar granos de café y hojas de té. Se prepara haciendo reaccionar etanol (C 2 H 5 OH) con ácido acético (CH 3 CO 2 H); el otro producto es agua. Se utiliza una pequeña cantidad de ácido sulfúrico para acelerar la reacción, pero el ácido sulfúrico no se consume y no aparece en la ecuación química equilibrada. Dados 10.0 mL cada uno de ácido acético y etanol, ¿cuántos gramos de acetato de etilo se pueden preparar a partir de esta reacción? Las densidades de ácido acético y etanol son 1.0492 g/mL y 0.7893 g/mL, respectivamente.
Dado: reactivos, productos y volúmenes y densidades de reactivos
Preguntado por: masa de producto
Estrategia:
A Equilibrar la ecuación química para la reacción.
B Utilice las densidades dadas para convertir de volumen a masa. Luego use cada masa molar para convertir de masa a moles.
C Usando relaciones molares, determinar qué sustancia es el reactivo limitante. Después de identificar el reactivo limitante, use relaciones molares basadas en el número de moles de reactivo limitante para determinar el número de moles de producto.
D Convertir de moles de producto a masa de producto.
Solución
A Siempre comenzamos por escribir la ecuación química equilibrada para la reacción:
\[{C_2}{H_5}OH\left( l \right) + C{H_3}C{O_2}H(aq){\text{ }} \to C{H_3}C{O_2}{C_2}{H_5}(aq) + {H_2}O\left( l \right) \notag \]
B Necesitamos calcular el número de moles de etanol y ácido acético que están presentes en 10.0 mL de cada uno. Recordemos del Capítulo 1 "que la densidad de una sustancia es la masa dividida por el volumen:
\[ density=\dfrac{mass}{volume} \notag \]
Al reorganizar esta expresión se obtiene mass = (densidad) (volumen). Podemos sustituir la masa por el producto de la densidad y el volumen para calcular el número de moles de cada sustancia en 10.0 mL (recuerde, 1 mL = 1 cm 3):
\ (\ comienzan {matriz}
moles\; C_ {2} H_ {5} OH &= &\ dfrac {masa\; C_ {2} H_ {5} OH} {molar\; masa\; C_ {2} H_ {5} OH}\\
&\
&=&\ dfrac {volumen\; C_ {2} H_ {5} OH\ veces densidad\; C_ {2} H_ {5} OH} {molar\; masa\; C_ {2} H_ {5} OH}\\
&\
&= &100.0\;\ cancel {mL\; C_ {2} H_ {5} OH}\ veces\ dfrac {0.789\;\ cancel {g\; C_ {2} H_ {5} OH}} {1\;\ cancel {mL\; C_ {2} H_ {5} OH}}\ dfrac {1\; mol\; mL\; C_ {2}} H_ {5} OH} {46.07\;\ cancel {g\; C_ {2} H_ {5} OH}}\\
&\\
&=& 0.171\; mol\; C_ {2} H_ {5} OH
\ end {matriz}\ noetiqueta\)
y
\ [\ begin {matriz}
moles\; CH_ {3} CO_ {2} H &= &\ dfrac {masa\; CH_ {3} CO_ {2} H} {molar\; masa\; CH_ {3} CO_ {2} H}\\
&\
&=&\ dfrac {volumen\; CH_ {3} CO_ {2} H\ veces densidad\; CH_ {3} CO_ {2} H} {molar\; masa\; CH_ {3} CO_ {2} H}\\
&\
&=&10.0\;\ cancel {mL\; CH_ {3} CO_ {2} H}\ veces\ dfrac {1.0492\;\ cancel {g\; CH_ {3} CO_ {2} H}} {1\;\ cancel {mL\; CH_ {3} CO_ {2} H}}\ dfrac {1\; mol\; mL\; CH_ {3} CO_ {2} H} {60.05\;\ cancel {g\; CH_ {3} CO_ {2} H}}\\
&\\
&=& 0.175\; mol\; CH_ {3} CO_ {2} H
\ final {matriz}\ notag\]
C El número de moles de ácido acético excede el número de moles de etanol. Debido a que ambos reactivos tienen coeficientes de 1 en la ecuación química equilibrada, la relación molar es 1:1. Tenemos 0.171 mol de etanol y 0.175 mol de ácido acético, por lo que el etanol es el reactivo limitante y el ácido acético está en exceso. El coeficiente en la ecuación química equilibrada para el producto (acetato de etilo) también es 1, por lo que la relación molar de etanol y acetato de etilo también es 1:1. Esto significa que dado 0.171 mol de etanol, la cantidad de acetato de etilo producido también debe ser 0.171 mol:
\ [\ comenzar {matriz}
moles\; etilo\; acetato &= &mol\; etanol\ veces\ dfrac {1\; mol\; etilo\; acetato} {1\; mol\; etanol}\\
&\\
&=& 0.171\; cancelar {mol\; etanol}\ veces\ dfrac {1\; mol\; etil\; acetato} {1\;\ cancelar {mol\;\; etanol}}\\
&\\
&=& 0.171\; mol\; CH_ {3} CO_ {2} C_ {2} H_ {5}
\ final {matriz}\ notag\]
D El paso final es determinar la masa de acetato de etilo que se puede formar, lo cual hacemos multiplicando el número de moles por la masa molar:
\ [\ comenzar {matriz}
masa\; de\; etilo\; acetato &= &mol\; etilo\; acetato\ veces molar\; masa\; etilo\; acetato\\
&\
&=& 0.171\;\ cancelar {mol\; CH_ {3} CO_ {2} C_ {2} H_ {5}}\ veces\ dfrac {88.1\; g\; CH_ {3} CO_ {2} C_ {2} H_ {5}} {1\;\ cancelar {mol\; CH_ {3} CO_ {2} C_ {2} H_ {5}}}\\
&\\
&=& 15.1\; g\; CH_ {3} CO_ {2} C_ {2} H_ {5}
\ end {matriz}\ notag\]
Así, en esta reacción se pueden preparar 15.1 g de acetato de etilo. Si es necesario, podría usar la densidad del acetato de etilo (0.9003 g/cm 3) para determinar el volumen de acetato de etilo que podría producirse:
\ [\ begin {matriz}
volumen\; de\; etil\; acetato &= & 15.1\; g\; CH_ {3} CO_ {2} C_ {2} H_ {5}\ veces\ dfrac {1\; mL CH_ {3} CO_ {2} C_ {2} H_ {5}} {0.9003\;\ cancel {g\; CH_ {3} CO_ {2} C_ {2} H_ {5}}}\\
& & &\
&=& 16.8\; mL\; CH_ {3} CO_ {2} C_ {2} H_ {5}
\ end { matriz}\ noetiqueta\]
En condiciones apropiadas, la reacción de fósforo elemental y azufre elemental produce el compuesto P 4 S 10. ¿Cuánto P 4 S 10 se puede preparar a partir de 10.0 g de P 4 y 30.0 g de S 8?
- Contestar
-
35.9 g
Rendimiento porcentual
Se ha aprendido que cuando los reactivos no están presentes en cantidades estequiométricas, el reactivo limitante determina la cantidad máxima de producto que se puede formar a partir de los reactivos. La cantidad de producto calculada de esta manera es el rendimiento teórico, que es la cantidad máxima de producto que se puede formar a partir de los reactivos en una reacción química, que teóricamente es la cantidad de producto que se obtendría si la reacción ocurriera perfectamente y el método de purificar el producto fueron 100% eficientes. La cantidad que obtendría si la reacción ocurriera perfectamente y su método de purificación del producto fueran 100% eficientes.
En realidad, casi siempre se obtiene menos producto del que teóricamente es posible debido a pérdidas mecánicas (como derrames), procedimientos de separación que no son 100% eficientes, reacciones competitivas que forman productos no deseados y reacciones que simplemente no van hasta su finalización, resultando así en una mezcla de productos y reactivos. Esta última posibilidad es una ocurrencia común, a la que llamamos equilibrio químico. Esto no es un equilibrio estático donde dos personas están de pie sosteniendo tres bolas, sino una situación en la que la velocidad de reacción hacia adelante se equilibra con la velocidad de reacción inversa. Se podría pensar en esto como malabaristas lanzando las bolas de un lado a otro. Entonces el rendimiento real (la masa medida de los productos obtenidos realmente de una reacción). El rendimiento real es casi siempre menor que el rendimiento teórico. , la masa medida de los productos obtenidos de una reacción, es casi siempre menor que el rendimiento teórico (a menudo mucho menor). El porcentaje de rendimiento (la relación entre el rendimiento real de una reacción y el rendimiento teórico multiplicado por 100 para dar un porcentaje) de una reacción es la relación entre el rendimiento real y el rendimiento teórico, multiplicado por 100 para dar un porcentaje:
\[ percent\; yield=\dfrac{actual yield\left ( g \right )}{theoretical\; yield\left ( g \right )} \times 100 \]
El método utilizado para calcular el rendimiento porcentual de una reacción se ilustra en el Ejemplo 13.
La procaína es un componente clave de la novocaína, un anestésico local inyectable utilizado en trabajos dentales y cirugía menor. La procaína se puede preparar en presencia de H 2 SO 4 (indicado arriba de la flecha) mediante la reacción
\ [\ begin {matriz}
C_ {7} H_ {7} NO_ {2} &+C_ {6} H_ {15} NO &\ xrightarrow {H_ {2} SO_ {4}} & C_ {13} H_ {20} N_ {2} O_ {2} & +H_ {2} O\\
^ {p-aminobencónico\; ácido} & ^ {2-dietilaminoetanol} & & ^ {procaína} &
\ end {matriz}\ notag\]
Si realizamos esta reacción usando 10.0 g de ácido p-aminbenzoico y 10.0 g de 2-dietilaminoetanol, y aislamos 15.7 g de procaína, ¿cuál fue el porcentaje de rendimiento?
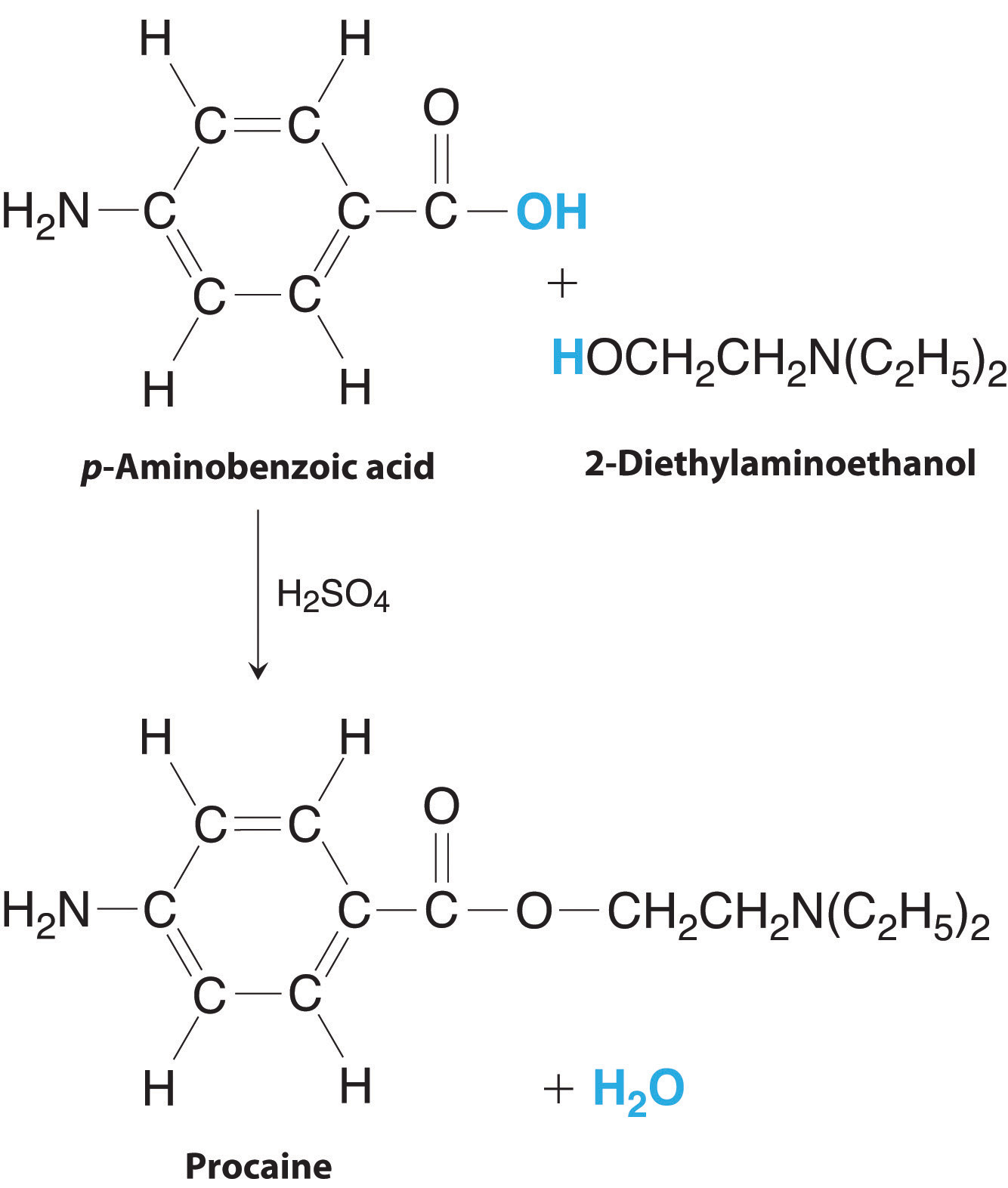
La preparación de procaína. Una reacción de ácido p-aminbenzoico con 2-dietilaminoetanol produce procaína y agua.
Dado: masas de reactivos y producto
Preguntado por: rendimiento porcentual
Estrategia:
A Escribe la ecuación química balanceada.
B Convertir de masa de reactivos y producto a moles usando masas molares y luego usar relaciones molares para determinar cuál es el reactivo limitante. Con base en el número de moles del reactivo limitante, utilice relaciones molares para determinar el rendimiento teórico.
C Calcular el rendimiento porcentual dividiendo el rendimiento real por el rendimiento teórico y multiplicando por 100.
Solución
A A partir de las fórmulas dadas para los reactivos y los productos, vemos que la ecuación química se equilibra como está escrita. Según la ecuación, 1 mol de cada reactivo se combina para dar 1 mol de producto más 1 mol de agua.
B Para determinar qué reactivo es limitante, necesitamos conocer sus masas molares, las cuales se calculan a partir de sus fórmulas estructurales: ácido p-aminbenzoico (C 7 H 7 NO 2), 137,14 g/mol; 2-dietilaminoetanol (C 6 H 15 NO), 117,19 g/mol. Así, la reacción utilizó los siguientes números de moles de reactivos:
\ [\ begin {matriz}
moles\; p-aminbenzoico\; ácido & = & 10.0\;\ cancel {g}\ dfrac {1\; mol} {137.14\;\ cancel {g}} & = & 0.0729\; mol\; p-ABA\
& & &\\
moles\; 2-dietilaminoetanol & = & 10.0\;\ cancel {g}\ dfrac {1\; mol} {117,19\;\ cancel {g}} & = & 0.0853\; mol\; 2-DAE
\ final {matriz}\ noetiqueta\]
La reacción requiere una relación molar 1:1 de los dos reactivos, por lo que el ácido p-aminbenzoico es el reactivo limitante. Con base en los coeficientes de la ecuación química equilibrada, 1 mol de ácido p-aminbenzoico produce 1 mol de procaína. Por lo tanto, solo podemos obtener un máximo de 0.0729 mol de procaína. Para calcular la masa correspondiente de procaína, utilizamos su fórmula estructural (C 13 H 20 N 2 O 2) para calcular su masa molar, que es 236.31 g/mol.
\[ theoretical\; yield\; of\; procaine= 0.0729\; \cancel{mol}\times \frac{236.31\; g}{1\; \cancel{mol}}=17.2\; g \notag \]
C El rendimiento real fue de sólo 15.7 g de procaína, por lo que el rendimiento porcentual fue
\[ percent\; yield= \dfrac{15.7\; g}{17.2\; g}\times 100=91.3\% \notag \]
(Si el producto fuera puro y seco, este rendimiento indicaría que tenemos muy buena técnica de laboratorio!)
El plomo fue uno de los primeros metales que se aisló en forma pura. Ocurre como depósitos concentrados de un mineral distintivo llamado galena (PbS), que se convierte fácilmente en óxido de plomo (PbO) con un rendimiento del 100% al tostar en aire a través de la siguiente reacción:
\[2PbS\left( s \right) + 3{O_2}\left( g \right){\text{ }} \to 2PbO\left( s \right) + 2S{O_2}\left( g \right) \notag \]
El PbO resultante se convierte luego en el metal puro por reacción con carbón vegetal. Debido a que el plomo tiene un punto de fusión tan bajo (327°C), se queda sin la mezcla de mineral y carbón como un líquido que se recolecta fácilmente. La reacción para la conversión de óxido de plomo en plomo puro es la siguiente:
\[PbO\left( s \right) + C\left( s \right){\text{ }} \to Pb\left( l \right) + CO\left( g \right) \notag \]
Si se calientan 93.3 kg de PbO con exceso de carbón vegetal y se obtienen 77.3 kg de plomo puro, ¿cuál es el rendimiento porcentual?
Galena cristalina (a) y una muestra de plomo (b). El plomo puro es lo suficientemente suave como para ser moldeado fácilmente con un martillo, a diferencia del mineral quebradizo galena, el principal mineral de plomo.
- Contestar
-
89.2%
El porcentaje de rendimiento puede variar de 0% a 100%. En el laboratorio, un estudiante obtendrá ocasionalmente un rendimiento que parece ser superior al 100%. Esto suele ocurrir cuando el producto es impuro o se humedece con un disolvente como el agua. Si no es así, entonces el alumno debió haber cometido un error al pesar ya sea los reactivos o los productos. ¡La ley de conservación de masas se aplica incluso a experimentos de laboratorio de química de pregrado! Un rendimiento del 100% significa que todo funcionó a la perfección, y obtuviste todo el producto que se pudo haber producido. Cualquiera que haya intentado hacer algo tan sencillo como llenar un salero o agregar aceite al motor de un automóvil sin derramarse sabe lo poco probable que es un rendimiento del 100%. En el otro extremo, un rendimiento del 0% significa que no se obtuvo ningún producto. Un rendimiento porcentual de 80% — 90% generalmente se considera de bueno a excelente; un rendimiento de 50% es justo. En parte debido a los problemas y costos de eliminación de residuos, las instalaciones de producción industrial enfrentan presiones considerables para optimizar los rendimientos de los productos y hacerlos lo más cercanos al 100% como sea posible.
Resumen
La estequiometría de una reacción describe las cantidades relativas de reactivos y productos en una ecuación química equilibrada. Una cantidad estequiométrica de un reactivo es la cantidad necesaria para reaccionar completamente con el (los) otro (s) reactivo (s). Si una cantidad de un reactivo permanece sin consumir después de que se haya producido la reacción completa, está en exceso. El reactivo que se consume primero y limita la cantidad de producto (s) que se puede obtener es el reactivo limitante. Para identificar el reactivo limitante, calcular el número de moles de cada reactivo presente y comparar esta relación con la relación molar de los reactivos en la ecuación química equilibrada. La cantidad máxima de producto (s) que se puede obtener en una reacción a partir de una cantidad dada de reactivo (s) es el rendimiento teórico de la reacción. El rendimiento real es la cantidad de producto (s) realmente obtenido en la reacción; no puede exceder el rendimiento teórico. El rendimiento porcentual de una reacción es la relación entre el rendimiento real y el rendimiento teórico, expresado como porcentaje.
Llave para llevar
- La estequiometría de una ecuación química equilibrada identifica la cantidad máxima de producto que se puede obtener.
Problemas conceptuales
-
Los ingenieros utilizan la conservación de la masa, llamada “balance de masa”, para determinar la cantidad de producto que se puede obtener de una reacción química. El balance de masas supone que la masa total de los reactivos es igual a la masa total de los productos. ¿Es esta una práctica químicamente válida? Explica tu respuesta.
-
Dada la ecuación 2H 2 (g) + O 2 (g) → 2H 2 O (g), ¿es correcto decir que 10 g de hidrógeno reaccionarán con 10 g de oxígeno para producir 20 g de vapor de agua?
-
¿Qué significa decir que una reacción es estequiométrica?
-
Cuando se quema azufre en el aire para producir dióxido de azufre, ¿cuál es el reactivo limitante? Explica tu respuesta.
-
¿Es posible que el rendimiento porcentual sea mayor que el rendimiento teórico? Justifica tu respuesta.
Problemas numéricos
Por favor, asegúrese de estar familiarizado con los temas tratados en Habilidades Esenciales 2 (Sección 7.7) antes de proceder a los Problemas Numéricos.
-
¿Cuál es la masa de fórmula de cada especie?
- cloruro de amonio
- cianuro de sodio
- hidróxido de magnesio
- fosfato de calcio
- carbonato de litio
- ion de sulfito de hidrógeno
-
¿Cuál es la masa molecular o fórmula de cada compuesto?
- permanganato de potasio
- sulfato de sodio
- cianuro de hidrógeno
- tiocianato de potasio
- oxalato de amonio
- acetato de litio
-
¿Cuántos lunares hay en cada uno de los siguientes?
- 10.76 g de Si
- 8.6 g de Pb
- 2.49 g de Mg
- 0.94 g de La
- 2.68 g de gas cloro
- 0.089 g de As
-
¿Cuántos lunares hay en cada uno de los siguientes?
- 8.6 g de CO 2
- 2.7 g de CaO
- 0.89 g de KCl
- 4.3 g de SrBr 2
- 2.5 g de NaOH
- 1.87 g de Ca (OH) 2
-
Convertir los siguientes en moles y milimoles.
- 1.68 g de Ba (OH) 2
- 0.792 g de H 3 PO 4
- 3.21 g de K 2 S
- 0.8692 g de Cu (NO 3) 2
- 10.648 g de Ba 3 (PO 4) 2
- 5.79 g de (NH 4) 2 SO 4
- 1.32 g de Pb (C 2 H 3 O 2) 2
- 4.29 g de CaCl 2·6H 2 O
-
Convertir los siguientes en moles y milimoles.
- 0.089 g de nitrato de plata
- 1.62 g de cloruro de aluminio
- 2.37 g de carbonato de calcio
- 1.004 g de sulfuro de hierro (II)
- 2.12 g de pentóxido de dinitrógeno
- 2.68 g de nitrato de plomo (II)
- 3.02 g de fosfato amónico
- 5.852 g de ácido sulfúrico
- 4.735 g de dicromato de potasio
-
¿Cuál es la masa de cada sustancia en gramos y miligramos?
- 5.68 mol de Ag
- 2.49 mol de Sn
- 0.0873 mol de Os
- 1.74 mol de Si
- 0.379 mol de H 2
- 1.009 mol de Zr
-
¿Cuál es la masa de cada sustancia en gramos y miligramos?
- 2.080 mol de CH 3 OH
- 0.288 mol de P 4
- 3.89 mol de ZnCl 2
- 1.800 mol de Fe (CO) 5
- 0.798 mol de S 8
- 4.01 mol de NaOH
-
¿Cuál es la masa de cada compuesto en kilogramos?
- 6.38 mol de P 4 O 10
- 2.26 mol de Ba (OH) 2
- 4.35 mol de K 3 PO 4
- 2.03 mol de Ni (ClO 3) 2
- 1.47 mol de NH 4 NO 3
- 0.445 mol de Co (NO 3) 3
-
¿Cuántos átomos están contenidos en cada uno?
- 2.32 mol de Bi
- 0.066 mol de V
- 0.267 mol de Ru
- 4.87 mol de C
- 2.74 g de I 2
- 1.96 g de Cs
- 7.78 g de O 2
-
Convierte cada número de átomos en miligramos.
- 5.89 × 10 22 átomos de Pt
- 2.899 × 10 átomos de 21 Hg
- 4.826 × 10 22 átomos de cloro
-
Escriba una ecuación química equilibrada para cada reacción y luego determine qué reactivo está en exceso.
- 2.46 g de bario (s) más 3.89 g de bromo (l) en agua para dar bromuro de bario
- 1.44 g de bromo (l) más 2.42 g de yoduro (s) de potasio en agua para dar bromuro de potasio y yodo
- 1.852 g de Zn metal más 3.62 g de ácido sulfúrico en agua para dar sulfato de zinc y gas hidrógeno
- 0.147 g de hierro metálico reacciona con 0.924 g de acetato de plata en agua para dar acetato de hierro (II) y metal plata
- 3.142 g de fosfato amónico reaccionan con 1.648 g de hidróxido de bario en agua para dar hidróxido amónico y fosfato de bario
-
En las condiciones adecuadas, el amoníaco y el oxígeno reaccionarán para formar monóxido de dinitrógeno (óxido nitroso, también llamado gas de la risa) y agua. Escribe una ecuación química equilibrada para esta reacción. Determinar qué reactivo está en exceso para cada combinación de reactivos.
- 24.6 g de amoníaco y 21.4 g de oxígeno
- 3.8 mol de amoniaco y 84.2 g de oxígeno
- 3.6 × 10 24 moléculas de amoníaco y 318 g de oxígeno
- 2.1 mol de amoniaco y 36.4 g de oxígeno
-
Cuando una pieza de zinc metálico se coloca en ácido clorhídrico acuoso, se produce cloruro de zinc y se desprende gas hidrógeno. Escribe una ecuación química equilibrada para esta reacción. Determinar qué reactivo está en exceso para cada combinación de reactivos.
- 12.5 g de HCl y 7.3 g de Zn
- 6.2 mol de HCl y 100 g de Zn
- 2.1 × 10 23 moléculas de Zn y 26.0 g de HCl
- 3.1 mol de Zn y 97,4 g de HCl
-
Determinar la masa de cada reactivo necesaria para dar la cantidad indicada de producto. Asegúrese de que las ecuaciones químicas estén equilibradas.
- NaI (ac) + Cl 2 (g) → NaCl (ac) + I 2 (s); 1.0 mol de NaCl
- NaCl (ac) + H 2 SO 4 (ac) → HCl (g) + Na 2 SO 4 (ac); 0.50 mol de HCl
- NO 2 (g) + H 2 O (l) → HNO 2 (aq) + HNO 3 (aq); 1.5 mol de HNO 3
-
Determinar la masa de cada reactivo necesaria para dar la cantidad indicada de producto. Asegúrese de que las ecuaciones químicas estén equilibradas.
- AgnO 3 (aq) + CaCl 2 (s) → AgCl (s) + Ca (NO 3) 2 (aq); 1.25 mol de AgCl
- Pb (s) + PbO 2 (s) + H 2 SO 4 (aq) → PbSO 4 (s) + H 2 O (l); 3.8 g de PbSO 4
- H 3 PO 4 (aq) + MgCO 3 (s) → Mg 3 (PO 4) 2 (s) + CO 2 (g) + H 2 O (l); 6.41 g de Mg 3 (PO 4) 2
-
Determinar el porcentaje de rendimiento de cada reacción. Asegúrese de que las ecuaciones químicas estén equilibradas. Supongamos que cualesquiera reactivos para los que no se den cantidades están en exceso. (El símbolo Δ indica que los reactivos están calentados.)
- Para KClO 3 (s) → KCl (s) + O 2 (g) ,2.14 g de KClO 3 produce 0.67 g de O 2
- Cu (s) + H 2 SO 4 (aq) → CuSO 4 (aq) + SO 2 (g) + H 2 O (l); 4.00 g de cobre da 1.2 g de dióxido de azufre
- AgC 2 H 3 O 2 (aq) + Na 3 PO 4 (aq) → Ag 3 PO 4 (s) + NaC 2 H 3 O 2 (aq); 5.298 g de acetato de plata producen 1.583 g de fosfato de plata
-
Cada etapa de una reacción de cuatro etapas tiene un rendimiento del 95%. ¿Cuál es el porcentaje de rendimiento para la reacción general?
-
Una reacción de tres etapas rinde 87% para la primera etapa, 94% para la segunda y 55% para la tercera. ¿Cuál es el porcentaje de rendimiento de la reacción general?
-
Dar una expresión general relacionando el rendimiento teórico (en gramos) de producto que se puede obtener a partir de x gramos de B, asumiendo que ni A ni B son limitantes.
\[A + 3B \to 2C \notag \]
-
Bajo ciertas condiciones, la reacción del hidrógeno con monóxido de carbono puede producir metanol.
- Escribe una ecuación química equilibrada para esta reacción.
- Calcular el porcentaje de rendimiento si se producen exactamente 200 g de metanol a partir exactamente de 300 g de monóxido de carbono.
-
El dióxido de cloro es un agente blanqueador utilizado en la industria del papel. Se puede preparar mediante la siguiente reacción:
\[NaCl{O_2}\left( s \right) + C{l_2}\left( g \right){\text{ }} \to Cl{O_2}(aq) + NaCl(aq) \notag \]
- ¿Qué masa de cloro se necesita para la reacción completa de 30.5 g de NaClO 2?
- Dar una ecuación general para la conversión de x gramos de clorito de sodio en dióxido de cloro.
-
La reacción del gas propano (CH 3 CH 2 CH 3) con gas cloro (Cl 2) produce dos productos de monocloruro: CH 3 CH 2 CH 2 Cl y CH 3 CHClCH 3. El primero se obtiene con un rendimiento de 43% y el segundo con un rendimiento de 57%.
- Si usas 2.78 g de gas propano, ¿cuánto gas cloro necesitarías para que la reacción llegue a su fin?
- ¿Cuántos gramos de cada producto teóricamente podrían obtenerse de la reacción a partir de 2.78 g de propano?
- Utilice el porcentaje de rendimiento real para calcular cuántos gramos de cada producto se obtendrían realmente.
-
El protactinio (Pa), un metal altamente tóxico, es uno de los elementos más raros y caros. La siguiente reacción es un método para preparar metal protactinio bajo condiciones relativamente extremas:
\[ 2PaI_{5}\left ( s \right )\overset{\Delta }{\rightarrow}2Pa\left ( s \right )+5I_{2}\left ( s \right ) \notag \]
- Dado 15.8 mg de reactivo, ¿cuántos miligramos de protactinio podrían sintetizarse?
- Si se obtuvieron 3.4 mg de Pa, ¿cuál fue el rendimiento porcentual de esta reacción?
- Si obtuviste 3.4 mg de Pa y el rendimiento porcentual fue de 78.6%, ¿cuántos gramos de PAi 5 se utilizaron en la preparación?
-
La anilina (C 6 H 5 NH 2) se puede producir a partir de clorobenceno (C 6 H 5 Cl) a través de la siguiente reacción:
\[{C_6}{H_5}Cl\left( l \right) + 2N{H_3}\left( g \right){\text{ }} \to {C_6}{H_5}N{H_2}\left( l \right) + N{H_4}Cl\left( s \right) \notag \]
Supongamos que 20.0 g de clorobenceno a 92% de pureza se mezcla con 8.30 g de amoníaco.
- ¿Cuál es el reactivo limitante?
- ¿Qué reactivo está presente en exceso?
- ¿Cuál es el rendimiento teórico del cloruro amónico en gramos?
- Si se recuperaron 4.78 g de NH 4 Cl, ¿cuál fue el rendimiento porcentual?
- Derivar una expresión general para el rendimiento teórico de cloruro amónico en términos de gramos de reactivo clorobenceno, si el amoníaco está presente en exceso.
-
Se agrega una cantidad estequiométrica de gas cloro a una solución acuosa de NaBr para producir una solución acuosa de cloruro de sodio y bromo líquido. Escribe la ecuación química para esta reacción. Asumir entonces un rendimiento del 89% y calcular la masa de cloro dado lo siguiente:
- 9.36 × 10 24 unidades de fórmula de NaCl
- 8.5 × 10 4 mol de Br 2
- 3.7 × 10 8 g de NaCl
RESPUESTAS
-
- 53.941 amu
- 49.0072 amu
- 58.3197 amu
- 310.177 amu
- 73.891 amu
- 81.071 amu
-
- 0.3831 mol Si
- 4.2 × 10 −2 mol Pb
- 0.102 mol Mg
- 6.8 × 10 −3 mol La
- 3.78 × 10 −2 mol Cl 2
- 1.2 × 10 −3 mol As
-
- 9.80 × 10 −3 mol o 9.80 mmol Ba (OH) 2
- 8.08 × 10 −3 mol o 8.08 mmol H 3 PO 4
- 2.91 × 10 −2 mol o 29.1 mmol K 2 S
- 4.634 × 10 −3 mol o 4.634 mmol Cu (NO 3) 2
- 1.769 × 10 −2 mol 17.69 mmol Ba 3 (PO 4) 2
- 4.38 × 10 −2 mol o 43.8 mmol (NH 4) 2 SO 4
- 4.06 × 10 −3 mol o 4.06 mmol Pb (C 2 H 3 O 2) 2
- 1.96 × 10 −2 mol o 19.6 mmol CaCl 2 · 6H 2 O
-
- 613 g o 6.13 × 10 5 mg Ag
- 296 g ó 2.96 × 10 5 mg Sn
- 16.6 g o 1.66 × 10 4 mg Os
- 48.9 g o 4.89 × 10 4 mg Si
- 0.764 g o 764 mg H 2
- 92.05 g o 9.205 × 10 4 mg Zr
-
- 1.81 kg P 4 O 10
- 0.387 kg Ba (OH) 2
- 0.923 kg K 3 PO 4
- 0.458 kg Ni (ClO 3) 2
- 0.118 kg (NH 4) NO 3
- 0.109 kg Co (NO 3) 3
-
- 1.91 × 10 4 mg Pt
- 965.6 mg Hg
- 2841 mg Cl
-
La ecuación química equilibrada para esta reacción es
2NH 3 + 2O 2 → N 2 O + 3H 2 O- NH 3
- NH 3
- O 2
- NH 3
-
- 150 g de NaI y 35 g de Cl 2
- 29 g NaCl y 25 g H 2 SO 4
- 140 g NO 2 y 27 g H 2 O
-
- 80%
- 30%
- 35.7%
-
45%.
-
- CO + 2H 2 → CH 3 OH
- 58.28%
-
- 2.24 g Cl 2
- 4.95 g
- 2.13 g CH 3 CH 2 CH 2 Cl más 2.82 g CH 3 CHClCH 3
-
- clorobenceno
- amoníaco
- 8.74 g de cloruro amónico.
- 55%


