4.8: La química de la lluvia ácida
- Page ID
- 78439
- Comprender la química de la lluvia ácida.
Las reacciones ácido-base pueden tener un fuerte impacto ambiental. Por ejemplo, un aumento dramático en la acidez de la lluvia y la nieve en los últimos 150 años está disolviendo las superficies de mármol y piedra caliza, acelerando la corrosión de los objetos metálicos y disminuyendo el pH de las aguas naturales. Este problema ambiental se llama lluvia ácida Precipitación que es dramáticamente más ácida debido a las actividades humanas. y tiene consecuencias significativas para todos los organismos vivos. Comprender la lluvia ácida requiere comprender las reacciones ácido-base en solución acuosa.
El término lluvia ácida en realidad es algo engañoso porque incluso el agua de lluvia pura recolectada en áreas alejadas de la civilización es ligeramente ácida (pH ≈ 5.6) debido al dióxido de carbono disuelto, que reacciona con el agua para dar ácido carbónico, un ácido débil:
\( C{O_2}\left( g \right) + {H_2}O\left( l \right){\text{ }} \rightleftharpoons {\text{ }}{H_2}C{O_3}\left( {aq} \right){\text{ }} \rightleftharpoons {\text{ }}{H^ + }\left( {aq} \right) + HC{O_3}^ - \left( {aq} \right) \tag{8.8.1} \)
Al químico inglés Robert Angus Smith generalmente se le atribuye haber acuñado la frase lluvia ácida en 1872 para describir el aumento de la acidez de la lluvia en centros industriales británicos (como Manchester), lo que aparentemente fue causado por los excesos desenfrenados de la Revolución Industrial temprana, aunque aún no se entendía la conexión. En ese momento, no había una buena manera de medir las concentraciones de iones hidrógeno, por lo que es difícil conocer el pH real de la lluvia observada por Smith. Los valores típicos de pH para la lluvia en los Estados Unidos continentales ahora oscilan entre 4 y 4.5, con valores tan bajos como 2.0 reportados para áreas como Los Ángeles. Recordemos de la Figura 4.8.1 que la lluvia con un pH de 2 es comparable en acidez al jugo de limón, e incluso la lluvia “normal” ahora es tan ácida como el jugo de tomate o el café negro.
¿Cuál es la fuente del aumento de la acidez en la lluvia y la nieve? El análisis químico muestra la presencia de grandes cantidades de iones sulfato (SO 4 2−) y nitrato (NO 3 −), y una amplia variedad de evidencias indican que una fracción significativa de estas especies provienen de óxidos de nitrógeno y azufre producidos durante la combustión de combustibles fósiles. A las altas temperaturas que se encuentran tanto en los motores de combustión interna como en las descargas de rayos, el nitrógeno molecular y el oxígeno molecular reaccionan para dar óxido nítrico:
\[ {N_2}\left( g \right) + {O_2}\left( g \right){\text{ }} \to {\text{ }}2NO\left( g \right)\ \]
El óxido nítrico luego reacciona rápidamente con el exceso de oxígeno para dar dióxido de nitrógeno, el compuesto responsable del color marrón del smog:
\[ 2NO\left( g \right) + {O_2}\left( g \right){\text{ }} \to {\text{ }}2N{O_2}\left( g \right) \]
Cuando el dióxido de nitrógeno se disuelve en agua, forma una mezcla 1:1 de ácido nitroso y ácido nítrico:
\[ 2N{O_2}\left( g \right) + {H_2}O\left( l \right){\text{ }} \to {\text{ }}HN{O_2}\left( {aq} \right) + HN{O_3}\left( {aq} \right)\]
Debido a que el oxígeno molecular eventualmente oxida el ácido nitroso a ácido nítrico, la reacción general es
\[ 2{N_2}\left( g \right) + 5{O_2}\left( g \right) + 2{H_2}O\left( l \right){\rm{ }} \to 4HN{O_3}(aq) \]
Grandes cantidades de dióxido de azufre siempre han sido liberadas a la atmósfera por fuentes naturales, como volcanes, incendios forestales y la descomposición microbiana de materiales orgánicos, pero durante la mayor parte de la historia registrada de la Tierra, el ciclo natural del azufre de la atmósfera a los océanos y rocas mantuvo la acidez de la lluvia y nieve en jaque. Desafortunadamente, la quema de combustibles fósiles parece haber volcado la balanza. Muchos carbones contienen tanto como 5% — 6% de pirita (FeS 2) en masa, y los fuelóleos contienen típicamente al menos 0.5% de azufre en masa. Desde mediados del siglo XIX, estos combustibles se han quemado a gran escala para abastecer las necesidades energéticas de nuestra sociedad industrial moderna, liberando decenas de millones de toneladas de SO 2 adicionales a la atmósfera anualmente. Además, la tostación de minerales de sulfuro para obtener metales como el zinc y el cobre produce grandes cantidades de SO 2 a través de reacciones como
\[ 2ZnS\left( s \right) + 3{O_2}\left( g \right){\rm{ }} \to 2ZnO\left( s \right) + 2S{O_2}\left( g \right) \]
Independientemente de la fuente, el SO 2 se disuelve en agua de lluvia para dar ácido sulfuroso (Ecuación 8.8.7), que finalmente es oxidado por el oxígeno a ácido sulfúrico (Ecuación 8.8.8):
\[S{O_2}\left( g \right) + {H_2}O\left( l \right){\rm{ }} \to {H_2}S{O_3}(aq) \]
\[2{H_2}S{O_3}(aq) + {O_2}\left( g \right){\rm{ }} \to 2{H_2}S{O_4}(aq) \]
Las preocupaciones sobre los efectos nocivos de la lluvia ácida han llevado a una fuerte presión sobre la industria para minimizar la liberación de SO 2 y NO. Por ejemplo, las centrales eléctricas que queman carbón ahora utilizan “depuradores” SO 2, que atrapan SO 2 por su reacción con cal (CaO) para producir sulfito de calcio dihidratado (CaO 3 ·2H 2 O; Figura\(\PageIndex{1}\)).
Figura Diagrama\(\PageIndex{1}\) esquemático de un sistema de depurador húmedo
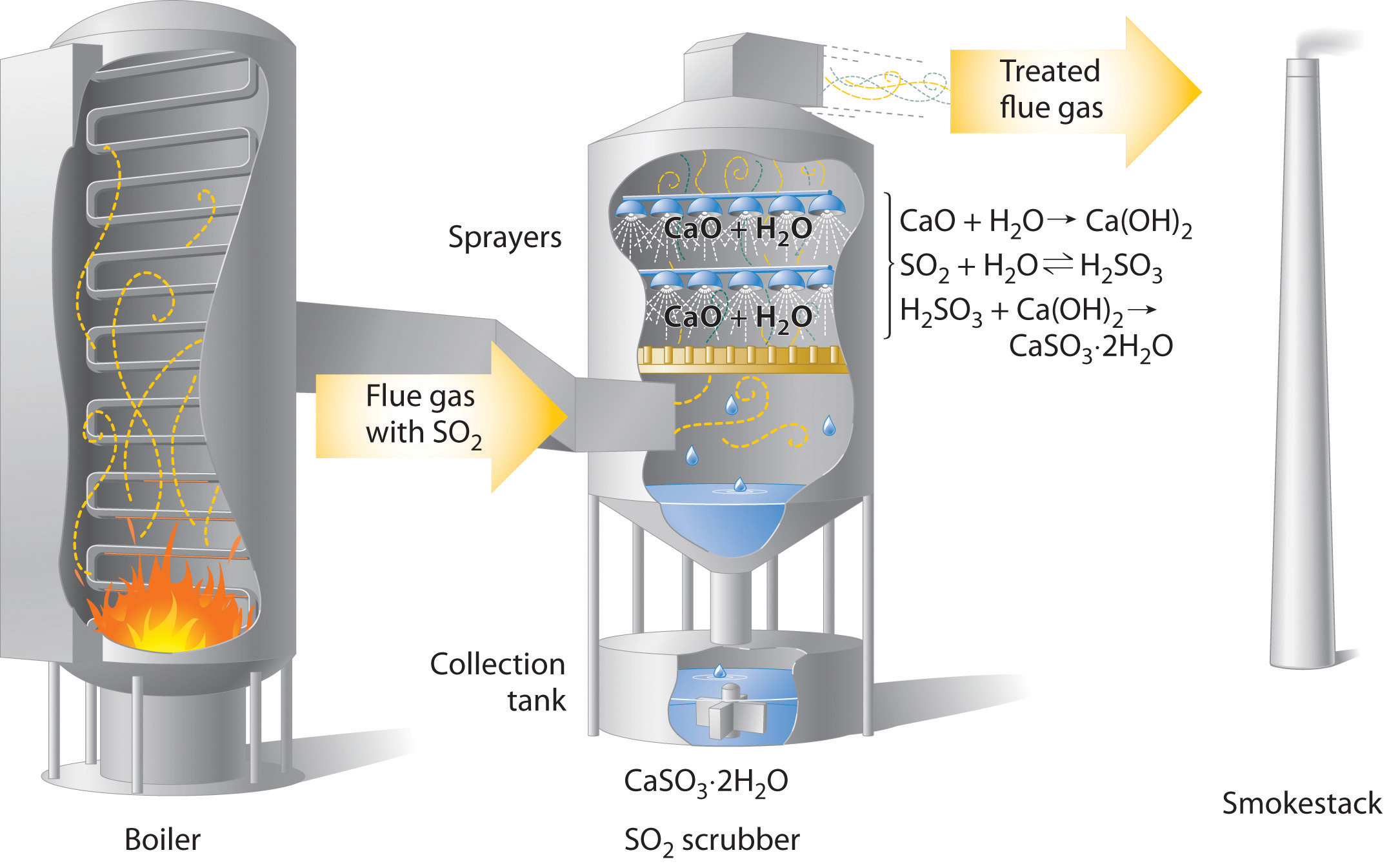
En las centrales eléctricas que queman carbón, el SO 2 puede ser removido (“depurado”) de los gases de escape por su reacción con una cal (CaO) y agua pulverizada para producir sulfito de calcio dihidratado (CaO 3 ·2H 2 O). Eliminar SO 2 de los gases evita su conversión a SO 3 y posterior reacción con agua de lluvia (lluvia ácida). Los sistemas de depuración ahora se utilizan comúnmente para minimizar los efectos ambientales de la combustión de combustibles fósiles a gran escala.
El daño que causa la lluvia ácida a los edificios y esculturas de piedra caliza y mármol se debe a una reacción clásica de base ácida. El mármol y la piedra caliza consisten en carbonato de calcio (CaCo 3), una sal derivada del ácido débil H 2 CO 3. Como vimos en la Sección 4.7 la reacción de un ácido fuerte con una sal de un ácido débil va a su finalización. Así podemos escribir la reacción de piedra caliza o mármol con ácido sulfúrico diluido de la siguiente manera:
\[CaC{O_3}\left( s \right) + {H_2}S{O_4}(aq){\rm{ }} \to CaS{O_4}\left( s \right) + {H_2}O\left( l \right) + C{O_2}\left( g \right) \]
Debido a que el CaSO 4 es escasamente soluble en agua, el resultado neto de esta reacción es disolver el mármol o la piedra caliza. El Lincoln Memorial en Washington, DC, que fue construido en 1922, ya muestra daños significativos por la lluvia ácida, y muchos objetos más antiguos están exhibiendo daños aún mayores (Figura\(\PageIndex{2}\)). Los objetos metálicos también pueden sufrir daños por la lluvia ácida a través de reacciones de oxidación-reducción, que se discuten en la Sección 8.9.
Figura Daños de lluvia\(\PageIndex{2}\) ácida a una estatua de George Washington

Tanto el mármol como la piedra caliza consisten en CaCo 3, que reacciona con la lluvia ácida en una reacción ácido-base para producir CaSO 4. Debido a que el CaSO 4 es algo soluble en agua, puede resultar un daño significativo a la estructura.
Los efectos biológicos de la lluvia ácida son más complejos. Como se indica en la Figura\(\PageIndex{2}\), los fluidos biológicos, como la sangre, tienen un pH de 7—8. Organismos como los peces pueden mantener su pH interno en agua que tiene un pH en el rango de 6.5—8.5. Sin embargo, si el pH externo es demasiado bajo, muchos organismos acuáticos ya no pueden mantener su pH interno, por lo que mueren. Un pH de 4 o menos es fatal para prácticamente todos los peces, la mayoría de los animales invertebrados y muchos microorganismos. Como resultado de la lluvia ácida, el pH de algunos lagos en Europa y Estados Unidos ha caído por debajo de 4. Encuestas recientes sugieren que hasta 6% de los lagos en las montañas Adirondack en el norte del estado de Nueva York y 4% de los lagos en Suecia y Noruega están esencialmente muertos y no contienen peces. Ninguna ubicación contiene grandes concentraciones de industria, pero Nueva York se encuentra a favor del viento del Medio Oeste industrial, y Escandinavia está a favor del viento de las regiones más industrializadas de Europa occidental. Ambas regiones parecen haber soportado la peor parte de la contaminación producida por sus vecinos a favor del viento. Una posible manera de contrarrestar los efectos de la lluvia ácida en lagos aislados es agregando grandes cantidades de piedra caliza finamente molida, que neutraliza el ácido a través de la reacción.
Una segunda forma importante en la que la lluvia ácida puede causar daños biológicos es menos directa. Los árboles y muchas otras plantas son sensibles a la presencia de aluminio y otros metales en las aguas subterráneas. En circunstancias normales, el hidróxido de aluminio [Al (OH) 3], que está presente en algunos suelos, es insoluble. Sin embargo, a valores de pH más bajos, Al (OH) 3 se disuelve a través de la siguiente reacción:
\[Al{\left( {OH} \right)_3}\left( s \right) + 3{H^ + }(aq){\rm{ }} \to A{l^3}^ + (aq) + 3{H_2}O\left( l \right) \]
El resultado es un aumento de los niveles de iones Al 3 + en las aguas subterráneas. Debido a que el ion Al 3 + es tóxico para las plantas, las altas concentraciones pueden afectar el crecimiento de las plantas. La lluvia ácida también puede debilitar tanto las hojas y raíces de las plantas que las plantas son incapaces de soportar otras tensiones. La combinación de los dos efectos puede causar daños significativos a los bosques establecidos, como la Selva Negra en Alemania y los bosques del noreste de Estados Unidos y Canadá y otros países (Figura\(\PageIndex{3}\)).
Figura Daños por lluvia\(\PageIndex{3}\) ácida a un bosque en la República Checa

Los árboles y muchas otras plantas son sensibles al aluminio y otros metales en las aguas subterráneas. La lluvia ácida aumenta la concentración de Al 3 + en las aguas subterráneas, afectando de manera adversa el crecimiento de las plantas. Grandes secciones de bosques establecidos han sido severamente dañados.


