8.11: Representaciones moleculares
- Page ID
- 78148
- Revisar las diferencias entre enlace covalente e iónico.
Los átomos en todas las sustancias que contienen más de un átomo se mantienen unidos por interacciones electrostáticas Una interacción entre partículas cargadas eléctricamente como protones y electrones. —interacciones entre partículas cargadas eléctricamente como protones y electrones. Atracción electrostática Una interacción electrostática entre especies con carga opuesta (positiva y negativa) que resulta en una fuerza que hace que se muevan una hacia la otra. entre especies con carga opuesta (positiva y negativa) resulta en una fuerza que hace que se muevan una hacia la otra, como la atracción entre polos opuestos de dos imanes. En contraste, la repulsión electrostática Una interacción electrostática entre dos especies que tienen la misma carga (ambas positivas o ambas negativas) que resulta en una fuerza que hace que se repelan entre sí. entre dos especies con la misma carga (ya sea ambas positivas o ambas negativas) resulta en una fuerza que hace que se repelan entre sí, al igual que lo hacen los mismos polos de dos imanes. Los átomos forman compuestos químicos cuando las interacciones electrostáticas atractivas entre ellos son más fuertes que las interacciones repulsivas. Colectivamente, nos referimos a las interacciones atractivas entre los átomos como enlaces químicos Una interacción atractiva entre átomos que los mantiene unidos en compuestos. .
Los enlaces químicos generalmente se dividen en dos tipos fundamentalmente diferentes: iónicos y covalentes. En realidad, sin embargo, los enlaces en la mayoría de las sustancias no son puramente iónicos ni puramente covalentes, sino que están más cerca de uno de estos extremos. Si bien los enlaces puramente iónicos y puramente covalentes representan casos extremos que rara vez se encuentran en nada menos sustancias muy simples, una breve discusión de estos dos extremos nos ayuda a entender por qué las sustancias que tienen diferentes tipos de enlaces químicos tienen propiedades muy diferentes. Compuestos iónicos Un compuesto que consiste en iones cargados positivamente (cationes) e iones cargados negativamente (aniones) mantenidos unidos por fuertes fuerzas electrostáticas. consisten en iones cargados positiva y negativamente unidos por fuertes fuerzas electrostáticas, mientras que los compuestos covalentes Un compuesto que consiste en moléculas discretas. generalmente consisten en moléculas Un grupo de átomos en el que uno o más pares de electrones se comparten entre átomos unidos. , que son grupos de átomos en los que uno o más pares de electrones se comparten entre átomos unidos. En un enlace covalente La atracción electrostática entre los núcleos cargados positivamente de los átomos unidos y los electrones cargados negativamente que comparten. , los átomos se mantienen unidos por la atracción electrostática entre los núcleos cargados positivamente de los átomos unidos y los electrones cargados negativamente que comparten. Comenzamos nuestra revisión de estructuras y fórmulas describiendo compuestos covalentes.
Tenga en cuenta el patrón
Los compuestos iónicos consisten en iones de cargas opuestas mantenidas unidas por fuertes fuerzas electrostáticas, mientras que los pares de electrones se comparten entre átomos unidos en compuestos covalentes.
Moléculas y Compuestos Covalentes
Así como un átomo es la unidad más simple que tiene las propiedades químicas fundamentales de un elemento, una molécula es la unidad más simple que tiene las propiedades químicas fundamentales de un compuesto covalente. Algunos elementos puros existen como moléculas covalentes. El hidrógeno, el nitrógeno, el oxígeno y los halógenos ocurren naturalmente como las moléculas diatómicas (“dos átomos”) H 2, N 2, O 2, F 2, Cl 2, Br 2 e I 2 (parte (a) en la Figura 5.8.1). De igual manera, algunos elementos puros son Moléculas poliatómicas que contienen más de dos átomos. (“muchos átomos”), como fósforo elemental y azufre, que se presentan como P 4 y S 8 (parte (b) en la Figura 5.8.1).
Cada compuesto covalente está representado por una fórmula molecular A representación de un compuesto covalente que consiste en el símbolo atómico para cada elemento componente (en un orden prescrito) acompañado de un subíndice que indica el número de átomos de ese elemento en la molécula. El subíndice se escribe sólo si el número es mayor que 1. , que da el símbolo atómico para cada elemento componente, en un orden prescrito, acompañado de un subíndice que indica el número de átomos de ese elemento en la molécula. El subíndice se escribe sólo si el número de átomos es mayor que 1. Por ejemplo, el agua, con dos átomos de hidrógeno y un átomo de oxígeno por molécula, se escribe como H 2 O. De manera similar, el dióxido de carbono, que contiene un átomo de carbono y dos átomos de oxígeno en cada molécula, se escribe como CO 2.
Figura 5.8.1 Elementos que existen como moléculas covalentes
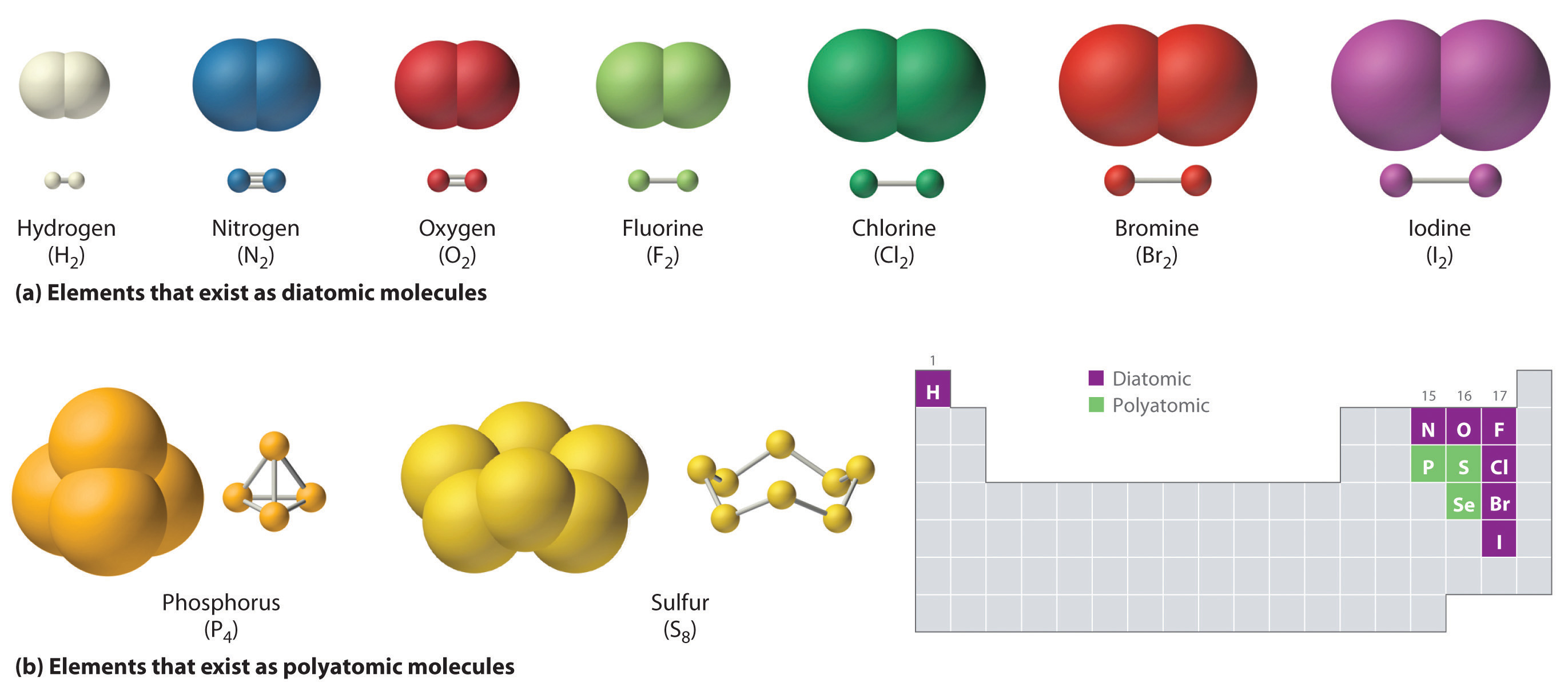
(a) Existen varios elementos de forma natural como moléculas diatómicas, en las que dos átomos (E) están unidos por uno o más enlaces covalentes para formar una molécula con la fórmula general E2. (b) Algunos elementos existen naturalmente como moléculas poliatómicas, las cuales contienen más de dos átomos. Por ejemplo, el fósforo existe como tetraedros P 4 —poliedros regulares con cuatro lados triangulares— con un átomo de fósforo en cada vértice. El azufre elemental consiste en un anillo arrugado de ocho átomos de azufre conectados por enlaces simples. El selenio no se muestra debido a la complejidad de su estructura.
Los compuestos covalentes que contienen predominantemente carbono e hidrógeno se denominan compuestos orgánicos Un compuesto covalente que contiene predominantemente carbono e hidrógeno. . Una convención para representar las fórmulas de compuestos orgánicos es escribir primero carbono, seguido de hidrógeno y luego cualquier otro elemento en orden alfabético (e.g., CH 4 O es alcohol metílico, un combustible). Otra convención representa mejor la estructura molecular como una fórmula estructural, como, por ejemplo, escribir la fórmula para el alcohol metílico ASCh 3 OH, donde CH 3 es el grupo metilo y OH el hidroxilo. Los compuestos que consisten principalmente en elementos distintos del carbono y el hidrógeno se denominan compuestos inorgánicos Un compuesto iónico o covalente que consiste principalmente en elementos distintos del carbono y el hidrógeno. ; incluyen tanto compuestos covalentes como iónicos. En los compuestos inorgánicos, los elementos componentes se listan comenzando con el más lejano a la izquierda en la tabla periódica, tal como vemos en CO 2 o SF 6. Los del mismo grupo se listan comenzando con el elemento inferior y trabajando arriba, como en ClF. Por convención, sin embargo, cuando un compuesto inorgánico contiene tanto hidrógeno como un elemento de los grupos 13-15, el hidrógeno generalmente se enumera en último lugar en la fórmula. Ejemplos son amoníaco (NH 3) y silano (SiH 4). Compuestos como el agua, cuyas composiciones se establecieron mucho antes de que se adoptara esta convención, siempre se escriben primero con hidrógeno: El agua siempre se escribe como H 2 O, no OH 2. Las convenciones para los ácidos inorgánicos, como el ácido clorhídrico (HCl) y el ácido sulfúrico (H 2 SO 4), se describen en la Sección 8.6.
Tenga en cuenta el patrón
Para compuestos orgánicos: escriba primero C, luego H, y luego los demás elementos en orden alfabético. Para los compuestos inorgánicos moleculares: comience con el elemento en el extremo izquierdo de la tabla periódica; enumere los elementos en el mismo grupo comenzando con el elemento inferior y elaborando.
Ejemplo 1
Escribe la fórmula molecular de cada compuesto.
- El compuesto de fósforo-azufre que es responsable de la ignición del llamado strike anywhere matches tiene 4 átomos de fósforo y 3 átomos de azufre por molécula.
- El alcohol etílico, el alcohol de las bebidas alcohólicas, tiene 1 átomo de oxígeno, 2 átomos de carbono y 6 átomos de hidrógeno por molécula.
- El freón-11, una vez ampliamente utilizado en los aires acondicionados de automóviles e implicado en daños a la capa de ozono, tiene 1 átomo de carbono, 3 átomos de cloro y 1 átomo de flúor por molécula.
Dado: identidad de elementos presentes y número de átomos de cada
Preguntado por: fórmula molecular
Estrategia:
A Identificar el símbolo de cada elemento de la molécula. Luego identificar la sustancia como un compuesto orgánico o un compuesto inorgánico.
B Si la sustancia es un compuesto orgánico, organice los elementos en orden comenzando con carbono e hidrógeno y luego enumere los demás elementos alfabéticamente. Si se trata de un compuesto inorgánico, enumere los elementos comenzando por el que queda más lejos en la tabla periódica. Listar elementos en el mismo grupo comenzando por el elemento inferior y trabajando hasta.
C A partir de la información dada, agregue un subíndice para cada tipo de átomo para escribir la fórmula molecular.
Solución:
- A La molécula tiene 4 átomos de fósforo y 3 átomos de azufre. Debido a que el compuesto no contiene principalmente carbono e hidrógeno, es inorgánico. B El fósforo está en el grupo 15, y el azufre está en el grupo 16. Debido a que el fósforo está a la izquierda del azufre, se escribe primero. C Escribir el número de cada tipo de átomo como subíndice derecho da P 4 S 3 como la fórmula molecular.
- Un alcohol etílico contiene predominantemente carbono e hidrógeno, por lo que es un compuesto orgánico. B La fórmula para un compuesto orgánico se escribe con el número de átomos de carbono primero, el número de átomos de hidrógeno siguiente, y los demás átomos en orden alfabético: CHO. C Agregar subíndices da la fórmula molecular C 2 H 6 O. Para transmitir más información estructural podríamos escribir esto como C 2 H 5 OH. Dibuja la estructura de Lewis usando esta información
- Un Freón-11 contiene carbono, cloro y flúor. Se puede ver como un compuesto inorgánico o un compuesto orgánico (en el que el flúor ha reemplazado al hidrógeno). Por lo tanto, la fórmula para Freón-11 se puede escribir usando cualquiera de las dos convenciones.
B De acuerdo con la convención para compuestos inorgánicos, el carbono se escribe primero porque queda más lejos en la tabla periódica. El flúor y el cloro están en el mismo grupo, por lo que se listan comenzando con el elemento inferior y trabajando hasta: CClF. La adición de subíndices da la fórmula molecular CCl 3 F.
C Obtenemos la misma fórmula para Freón-11 usando la convención para compuestos orgánicos. El número de átomos de carbono se escribe primero, seguido del número de átomos de hidrógeno (cero) y luego los demás elementos en orden alfabético, dando también CCl 3 F.
Ejercicio
Escriba la fórmula molecular para cada compuesto.
- El óxido nitroso, también llamado “gas de la risa”, tiene 2 átomos de nitrógeno y 1 átomo de oxígeno por molécula. El óxido nitroso se utiliza como anestésico suave para cirugías menores y como propelente en latas de crema batida.
- La sacarosa, también conocida como azúcar de caña, tiene 12 átomos de carbono, 11 átomos de oxígeno y 22 átomos de hidrógeno.
- El hexafluoruro de azufre, un gas utilizado para presurizar pelotas de tenis “sin presurizar” y como refrigerante en reactores nucleares, tiene 6 átomos de flúor y 1 átomo de azufre por molécula.
Responder
- N 2 O
- C 12 H 22 O 11
- SF 6
Representaciones de estructuras moleculares
Las fórmulas moleculares dan solo la composición elemental de las moléculas. En contraste, las fórmulas estructurales Una representación de una molécula que muestra qué átomos están unidos entre sí y, en algunos casos, la disposición aproximada de los átomos en el espacio. muestran qué átomos están unidos entre sí y, en algunos casos, la disposición aproximada de los átomos en el espacio. Estas son las estructuras de Lewis de las que aprendimos. Conocer la fórmula estructural de un compuesto permite a los químicos crear un modelo tridimensional, que proporciona información sobre cómo se comportará ese compuesto física y químicamente.
La fórmula estructural para H 2 se puede dibujar como H-H y la de I 2 como I-I, donde la línea indica un solo par de electrones compartidos, un enlace sencillo Un enlace químico se forma cuando dos átomos comparten un solo par de electrones. . Dos pares de electrones se comparten en un doble enlace Un enlace químico formado cuando dos átomos comparten dos pares de electrones. , que se indica por dos líneas, por ejemplo, O 2 es O=O. tres pares de electrones se comparten en un triple enlace Un enlace químico formado cuando dos átomos comparten tres pares de electrones. , que se indica mediante tres líneas, por ejemplo, N 2 es N≡N (ver Figura 5.8.2). El carbono es único en la medida en que forma enlaces simples, dobles y triples a sí mismo y a otros elementos. El número de enlaces formados por un átomo en sus compuestos covalentes no es arbitrario. Como hemos aprendido en el Capítulo 4, el hidrógeno, el oxígeno, el nitrógeno y el carbono tienen una tendencia muy fuerte a formar sustancias en las que tienen uno, dos, tres y cuatro enlaces con otros átomos, respectivamente (Figura 5.8.2).
Figura 5.8.2 Moléculas que contienen enlaces simples, dobles y triples
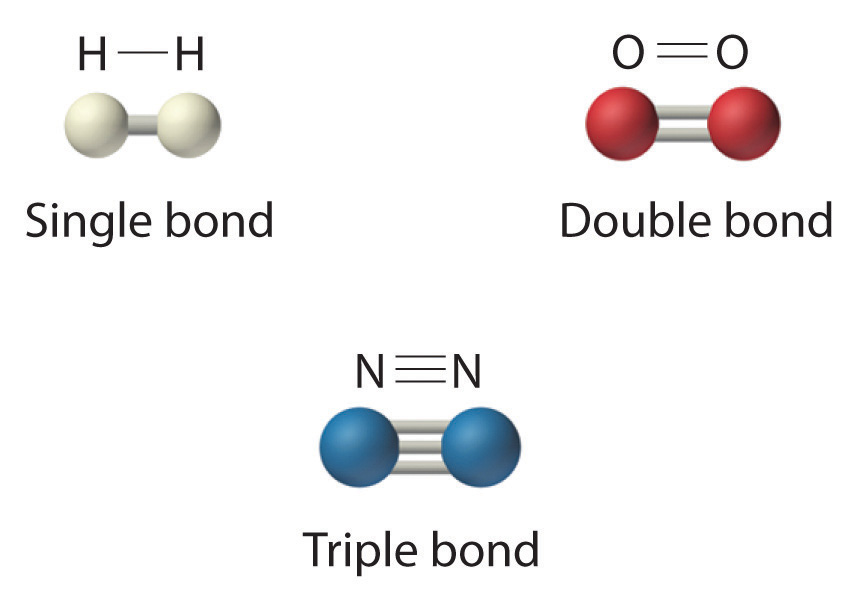
El hidrógeno (H 2) tiene un enlace sencillo entre los átomos. El oxígeno (O 2) tiene un doble enlace entre átomos, indicado por dos líneas (=). El nitrógeno (N 2) tiene un triple enlace entre átomos, indicado por tres líneas (≡). Cada enlace representa un par de electrones.
Cuadro 5.8.1 El número de enlaces que los átomos seleccionados forman comúnmente con otros átomos
| Atom | Número de bonos |
|---|---|
| H (grupo 1) | 1 |
| O (grupo 16) | 2 |
| N (grupo 15) | 3 |
| C (grupo 14) | 4 |
La fórmula estructural para el agua se puede dibujar de la siguiente manera, pero incluir los dos pares solitarios en el oxígeno proporciona más información:

Porque como aprendimos de VSEPR, este último se aproxima a la forma determinada experimentalmente de la molécula de agua, es más informativa. Del mismo modo, el amoníaco (NH 3) y el metano (CH 4) a menudo se escriben como moléculas planas pero al menos para el amoníaco, sería más informativo incluir el par solitario en el átomo de nitrógeno:

Como se muestra en la Figura 5.8.3, sin embargo, sabemos que la estructura tridimensional real del NH 3 parece una pirámide con una base triangular de tres átomos de hidrógeno. Nuevamente usando VSEPR, o lo que sabemos sobre los orbitales sp3 en el átomo central en las tres moléculas, la estructura de CH 4, con cuatro átomos de hidrógeno dispuestos alrededor de un átomo de carbono central como se muestra en la Figura 5.8.3, es tetraédrica. Es decir, los átomos de hidrógeno están posicionados en cada otro vértice de un cubo. Muchos compuestos—compuestos de carbono, en particular— tienen cuatro átomos unidos dispuestos alrededor de un átomo central para formar un tetraedro.
Figura 5.8.3 Las estructuras tridimensionales del agua, el amoníaco y el metano
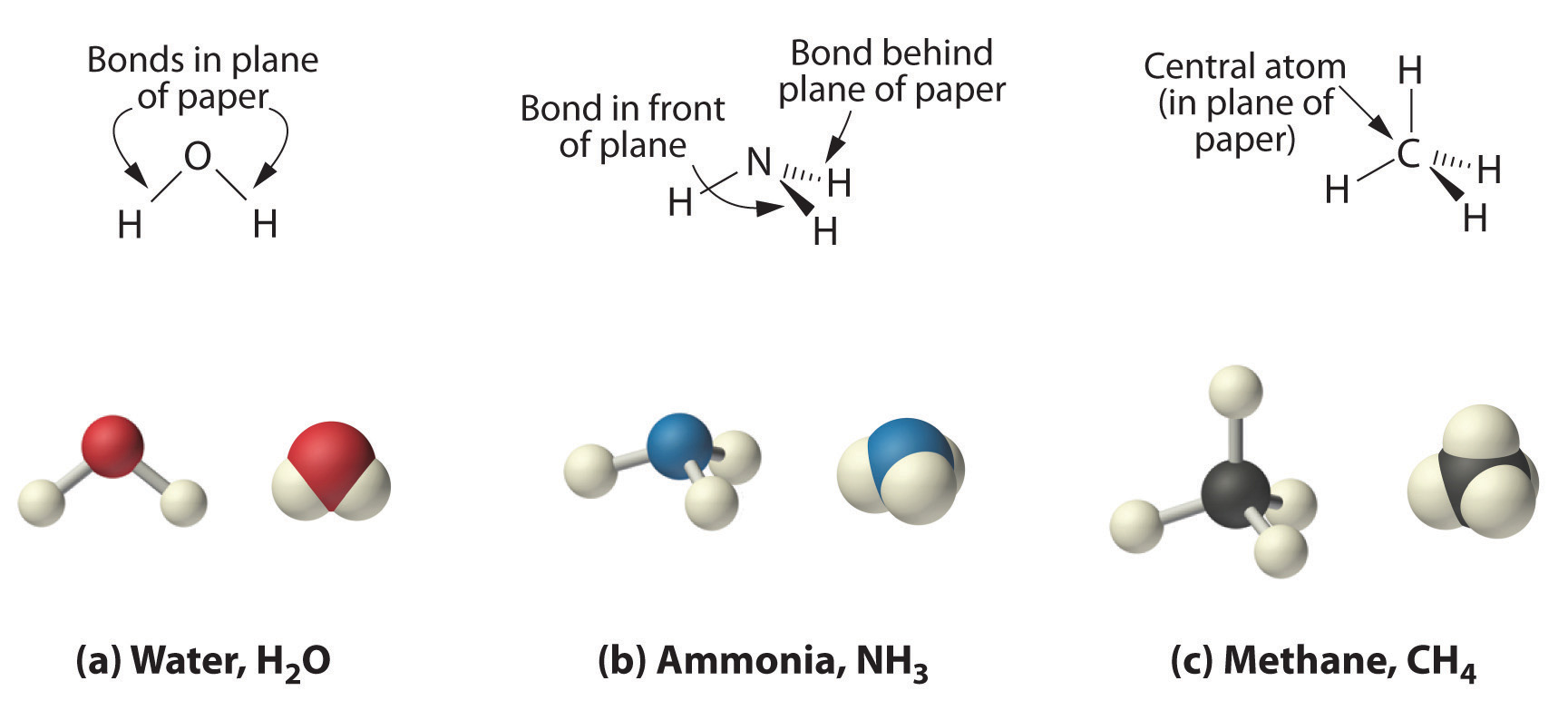
(a) El agua es una molécula en forma de V, en la que los tres átomos se encuentran en un plano. (b) En contraste, el amoníaco tiene una estructura piramidal, en la que los tres átomos de hidrógeno forman la base de la pirámide y el átomo de nitrógeno está en el vértice. c) Los cuatro átomos de hidrógeno del metano forman un tetraedro; el átomo de carbono se encuentra en el centro.
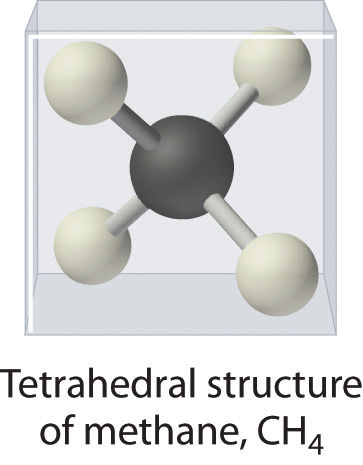
CH 4. El metano tiene una estructura tridimensional tetraédrica.
La Figura 5.8.1 y la Figura 5.8.3 ilustran diferentes formas de representar las estructuras de las moléculas. Debe quedar claro que no existe una sola “mejor” manera de dibujar la estructura de una molécula; el método que uses depende del aspecto de la estructura que quieras enfatizar y de cuánto tiempo y esfuerzo quieres dedicar. La Figura 5.8.4 muestra algunas de las diferentes formas de retratar la estructura de una molécula ligeramente más compleja: el metanol. Estas representaciones difieren mucho en su contenido de información. Por ejemplo, la fórmula molecular para metanol (parte (a) en la Figura 5.8.4) da solo el número de cada tipo de átomo; escribir metanol como CH 4 O no dice nada sobre su estructura. En contraste, la fórmula estructural (parte (b) en la Figura 5.8.4) indica cómo están conectados los átomos, pero hace que el metanol parezca plano (lo cual no lo es). Tanto el modelo de bola y varilla (parte (c) en la Figura 5.8.4) como el dibujo en perspectiva (parte (d) en la Figura 5.8.4) muestran la estructura tridimensional de la molécula. Esta última (también llamada representación de cuña y guión) es la forma más fácil de esbozar la estructura de una molécula en tres dimensiones. Muestra qué átomos están por encima y por debajo del plano del papel mediante el uso de cuñas y guiones, respectivamente; siempre se supone que el átomo central está en el plano del papel. El modelo de relleno de espacio (parte (e) en la Figura 5.8.4) ilustra los tamaños relativos aproximados de los átomos en la molécula, pero no muestra los enlaces entre los átomos. Además, en un modelo de relleno de espacio, los átomos en el “frente” de la molécula pueden oscurecer los átomos en la “parte posterior”.
Figura 5.8.4 Diferentes formas de representar la estructura de una molécula
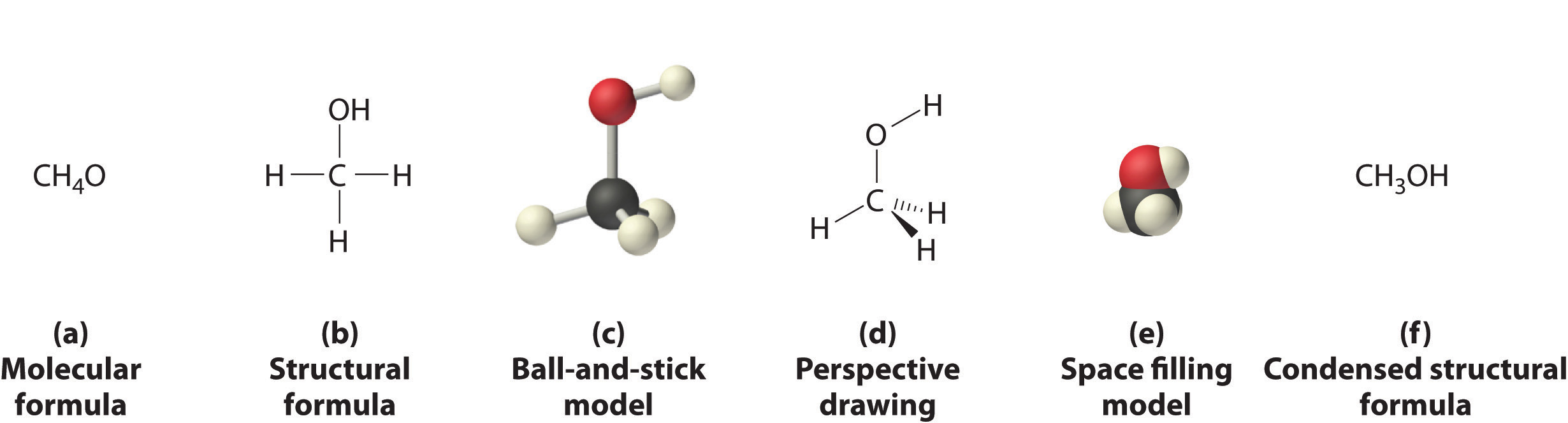
(a) La fórmula molecular del metanol da sólo el número de cada tipo de átomo presente. (b) La fórmula estructural muestra qué átomos están conectados. (c) El modelo de bola y varilla muestra los átomos como esferas y los enlaces como palos. d) Un dibujo en perspectiva (también llamado representación de cuña y guion) intenta mostrar la estructura tridimensional de la molécula. (e) El modelo de relleno de espacio muestra los átomos en la molécula pero no los enlaces. (f) La fórmula estructural condensada es, con mucho, la forma más fácil y común de representar una molécula.
Aunque una fórmula estructural, un modelo de bola y varilla, un dibujo en perspectiva y un modelo de relleno de espacio proporcionan una cantidad significativa de información sobre la estructura de una molécula, cada uno requiere tiempo y esfuerzo. En consecuencia, los químicos suelen utilizar una fórmula estructural condensada (parte (f) en la Figura 5.8.4), que omite las líneas que representan enlaces entre átomos y simplemente enumera los átomos unidos a un átomo dado junto a él. Múltiples grupos unidos al mismo átomo se muestran entre paréntesis, seguido de un subíndice que indica el número de dichos grupos. Por ejemplo, la fórmula estructural condensada para el metanol es CH 3 OH, lo que nos dice que la molécula contiene una unidad CH 3 que parece un fragmento de metano (CH 4). Por lo tanto, el metanol puede verse como una molécula de metano en la que un átomo de hidrógeno ha sido reemplazado por un grupo —OH o como una molécula de agua en la que un átomo de hidrógeno ha sido reemplazado por un fragmento —CH 3. Debido a su facilidad de uso y contenido de información, utilizamos fórmulas estructurales condensadas para moléculas a lo largo de este texto. Los modelos de bola y varilla se utilizan cuando es necesario para ilustrar la estructura tridimensional de las moléculas, y los modelos de relleno de espacio se usan solo cuando es necesario visualizar los tamaños relativos de átomos o moléculas para comprender un punto importante.
Ejemplo 2
Escriba la fórmula molecular para cada compuesto. Se da la fórmula estructural condensada.
- El monocloruro de azufre (también llamado dicloruro de disulfur) es un líquido amarillo corrosivo de olor vil utilizado en la producción de caucho sintético. Su fórmula estructural condensada es ClSSCl.
- El etilenglicol es el ingrediente principal en el anticongelante. Su fórmula estructural condensada es HOCH 2 CH 2 OH.
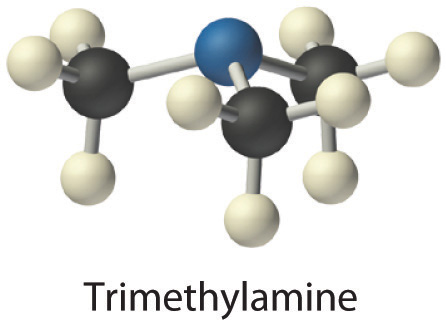
- La trimetilamina es una de las sustancias responsables del olor del pescado en mal estado. Su fórmula estructural condensada es (CH 3) 3 N.
Dado: fórmula estructural condensada
Preguntado por: fórmula molecular
Estrategia:
A Identificar cada elemento en la fórmula estructural condensada y luego determinar si el compuesto es orgánico o inorgánico.
B En su caso, utilice convención orgánica o inorgánica para enumerar los elementos. Luego agregue los subíndices apropiados para indicar el número de átomos de cada elemento presente en la fórmula molecular.
Solución:
La fórmula molecular enumera los elementos en la molécula y el número de átomos de cada uno.
- A Cada molécula de monocloruro de azufre tiene dos átomos de azufre y dos átomos de cloro. Debido a que no contiene principalmente carbono e hidrógeno, es un compuesto inorgánico. B El azufre se encuentra a la izquierda del cloro en la tabla periódica, por lo que se escribe primero en la fórmula. La adición de subíndices da la fórmula molecular S 2 Cl 2.
- A Contando los átomos en etilenglicol, obtenemos seis átomos de hidrógeno, dos átomos de carbono y dos átomos de oxígeno por molécula. El compuesto consiste principalmente en átomos de carbono e hidrógeno, por lo que es orgánico. B Al igual que con todos los compuestos orgánicos, C y H se escriben primero en la fórmula molecular. La adición de subíndices apropiados da la fórmula molecular C 2 H 6 O 2.
- A La fórmula estructural condensada muestra que la trimetilamina contiene tres unidades CH 3, por lo que tenemos un átomo de nitrógeno, tres átomos de carbono y nueve átomos de hidrógeno por molécula. Debido a que la trimetilamina contiene principalmente carbono e hidrógeno, es un compuesto orgánico. B De acuerdo con la convención para compuestos orgánicos, C y H se escriben primero, dando la fórmula molecular C 3 H 9 N.
Ejercicio
Escribe la fórmula molecular para cada molécula.
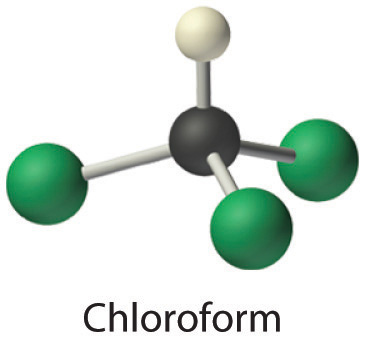
- El cloroformo, que fue uno de los primeros anestésicos y se utilizó en muchos jarabes para la tos hasta hace poco, contiene un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro. Su fórmula estructural condensada es CHCl 3.
- La hidrazina se utiliza como propulsor en los chorros de actitud del transbordador espacial. Su fórmula estructural condensada es H 2 NNH 2.
- La putrescina es un compuesto de olor penetrante aislado primero de extractos de carne podrida. Su fórmula estructural condensada es H 2 NCH 2 CH 2 CH 2 CH 2 NH 2. Esto suele escribirse como H 2 N (CH 2) 4 NH 2 para indicar que hay cuatro fragmentos CH 2 unidos entre sí.
Responder
- CHCl 3
- N 2 H 4
- C 4 H 12 N 2
Compuestos Ionicos
Las sustancias descritas en la discusión anterior están compuestas por moléculas que son eléctricamente neutras; es decir, el número de protones cargados positivamente en el núcleo es igual al número de electrones cargados negativamente. En contraste, los iones son átomos o conjuntos de átomos que tienen una carga eléctrica neta. Los iones que contienen menos electrones que los protones tienen una carga neta positiva y se denominan cationes Un ion que tiene menos electrones que protones, resultando en una carga neta positiva. . Por el contrario, los iones que contienen más electrones que protones tienen una carga neta negativa y se denominan aniones Un ion que tiene menos protones que electrones, resultando en una carga neta negativa. . Los compuestos iónicos contienen tanto cationes como aniones en una proporción que no resulta en carga eléctrica neta.
Tenga en cuenta el patrón
Los compuestos iónicos contienen tanto cationes como aniones en una proporción que resulta en cero carga eléctrica.
En los compuestos covalentes, los electrones se comparten entre átomos unidos y son atraídos simultáneamente a más de un núcleo. Por el contrario, los compuestos iónicos contienen cationes y aniones en lugar de moléculas neutras discretas. Los compuestos iónicos se mantienen unidos por las atractivas interacciones electrostáticas entre cationes y aniones. En un compuesto iónico, los cationes y aniones están dispuestos en el espacio para formar una matriz tridimensional extendida que maximiza el número de interacciones electrostáticas atractivas y minimiza el número de interacciones electrostáticas repulsivas (Figura 5.8.5). Como se muestra en la Ecuación 5.8.1, la energía electrostática de la interacción entre dos partículas cargadas es proporcional al producto de las cargas sobre las partículas e inversamente proporcional a la distancia entre ellas:
\( electrostatic\; energy=\frac{Q_{1}Q_{2}}{r} \tag{6.1.1} \)
donde Q 1 y Q 2 son las cargas eléctricas sobre las partículas 1 y 2, y r es la distancia entre ellas. Cuando Q 1 y Q 2 son ambos positivos, correspondientes a las cargas en los cationes, los cationes se repelen entre sí y la energía electrostática es positiva. Cuando Q 1 y Q 2 son ambos negativos, correspondientes a las cargas sobre los aniones, los aniones se repelen entre sí y la energía electrostática vuelve a ser positiva. La energía electrostática es negativa solo cuando las cargas tienen signos opuestos; es decir, las especies cargadas positivamente son atraídas por especies cargadas negativamente y viceversa. Como se muestra en la Figura 5.8.6, la fuerza de la interacción es proporcional a la magnitud de las cargas y disminuye a medida que aumenta la distancia entre las partículas como hemos visto anteriormente
Tenga en cuenta el patrón
Si la energía electrostática es positiva, las partículas se repelen entre sí; si la energía electrostática es negativa, las partículas son atraídas entre sí.
Figura 5.8.5 Enlace covalente e iónico
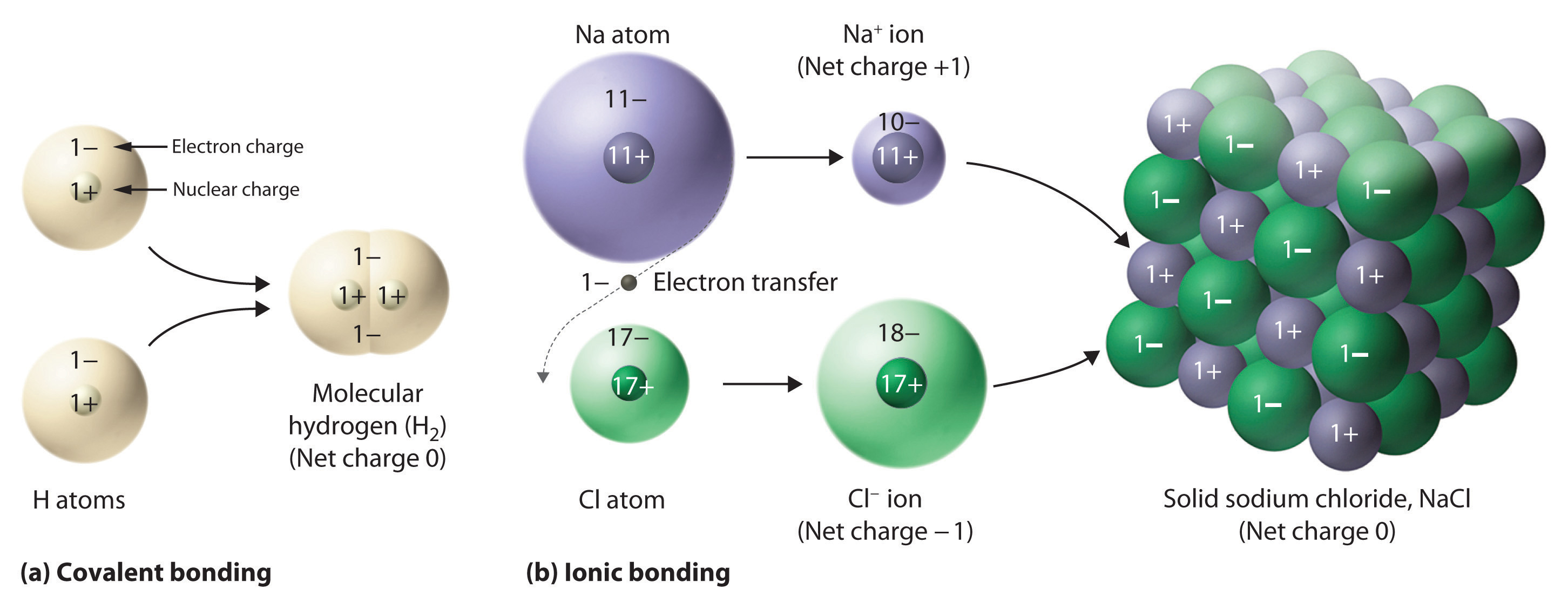
(a) En hidrógeno molecular (H 2), dos átomos de hidrógeno comparten dos electrones para formar un enlace covalente. b) El compuesto iónico que se forma NaCl cuando los electrones de los átomos de sodio se transfieren a átomos de cloro. Los iones Na + y Cl − resultantes forman un sólido tridimensional que se mantiene unido mediante interacciones electrostáticas atractivas.
Figura 5.8.6 El efecto de la carga y la distancia sobre la fuerza de las interacciones electrostáticas
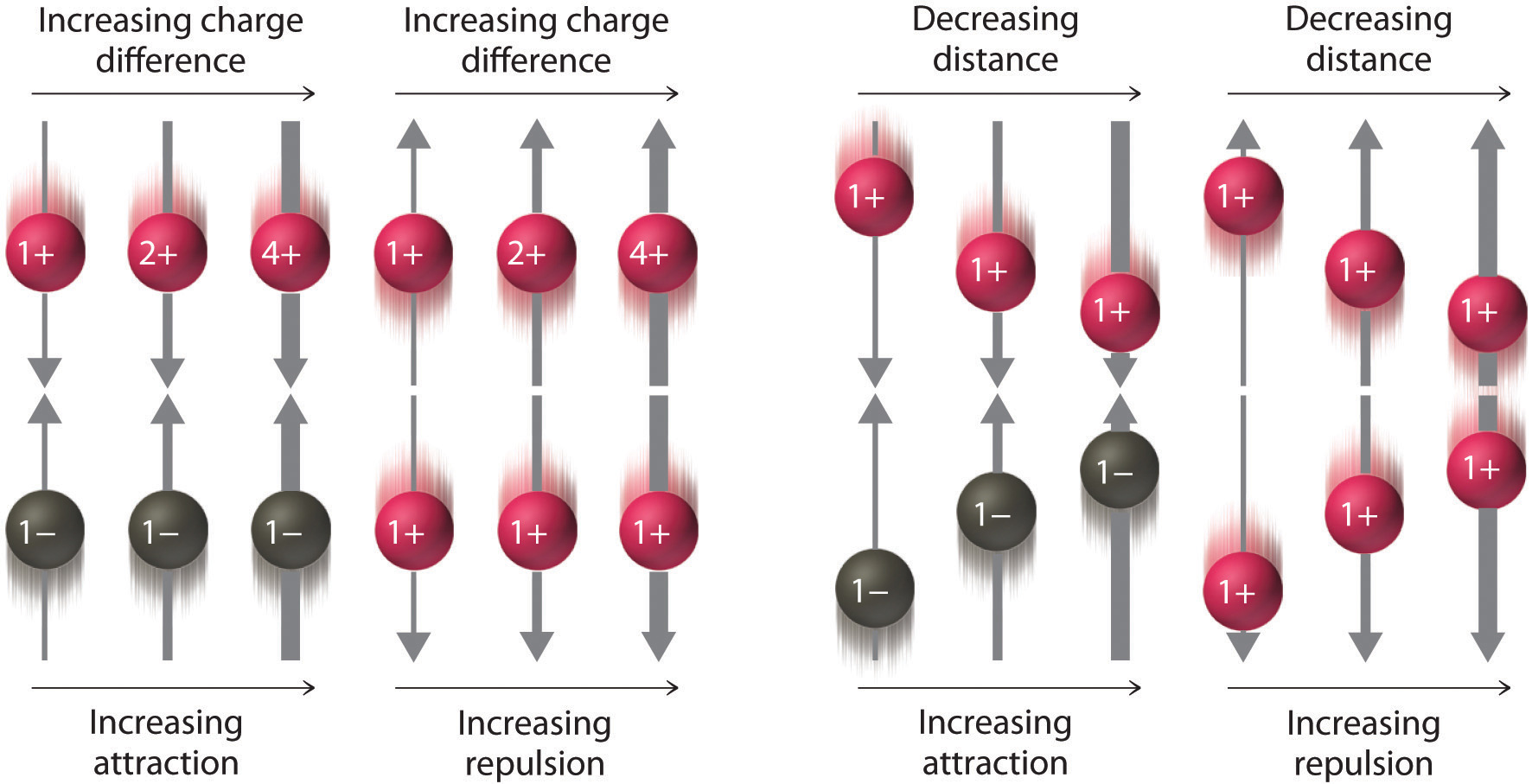
A medida que aumenta la carga sobre los iones o disminuye la distancia entre iones, también lo hace la fuerza de las interacciones atractivas (−... +) o repulsivas (−... − o +... +). La fuerza de estas interacciones está representada por el grosor de las flechas.
Un ejemplo que hemos estudiado de un compuesto iónico es el cloruro de sodio (NaCl; Figura 5.8.7), formado a partir de sodio y cloro. Al formar compuestos químicos, muchos elementos tienen tendencia a ganar o perder suficientes electrones para alcanzar el mismo número de electrones que el gas noble más cercano a ellos en la tabla periódica. Cuando el sodio y el cloro entran en contacto, cada átomo de sodio cede un electrón para convertirse en un ion Na +, con 11 protones en su núcleo pero solo 10 electrones (como el neón), y cada átomo de cloro gana un electrón para convertirse en un ion Cl −, con 17 protones en su núcleo y 18 electrones (como argón), como se muestra en la parte (b) de la Figura 5.8.5. El cloruro de sodio sólido contiene igual número de cationes (Na +) y aniones (Cl −), manteniendo así la neutralidad eléctrica. Cada ion Na + está rodeado por 6 iones Cl −, y cada ion Cl − está rodeado por 6 iones Na +. Debido a la gran cantidad de interacciones atractivas de Na + Cl −, la energía electrostática atractiva total en NaCl es grande.
Figura 5.8.7 Cloruro de sodio: un sólido iónico

Los planos de un cristal de NaCl reflejan la disposición tridimensional regular de sus iones Na + (púrpura) y Cl − (verde).
Consistente con una tendencia a tener el mismo número de electrones que el gas noble más cercano, al formar iones, los elementos de los grupos 1, 2 y 3 tienden a perder uno, dos y tres electrones, respectivamente, para formar cationes, como Na + y Mg 2 +. Entonces tienen el mismo número de electrones que el gas noble más cercano: el neón. De igual manera, K +, Ca 2 + y Sc 3 + tienen 18 electrones cada uno, como el gas noble más cercano: el argón. Además, los elementos del grupo 13 pierden tres electrones para formar cationes, como Al 3 +, alcanzando nuevamente el mismo número de electrones que el gas noble más cercano a ellos en la tabla periódica. Debido a que los lantánidos y actínidos pertenecen formalmente al grupo 3, el ion más común formado por estos elementos es M 3 +, donde M representa el metal. Por el contrario, los elementos de los grupos 17, 16 y 15 a menudo reaccionan para ganar uno, dos y tres electrones, respectivamente, para formar iones como Cl −, S2- y P3−. Los iones como estos, que contienen solo un solo átomo, se denominan iones monatómicos Un ion con un solo átomo. . Los nombres de los cationes de un solo átomo son simplemente el nombre del metal del que se derivan. Los nombres de los aniones de un solo átomo añaden el sufijo -ide a la primera sílaba del átomo, por ejemplo óxido, cloruro, nitruro, etc.
Se pueden predecir las cargas de la mayoría de los iones monatómicos derivados de los elementos del grupo principal simplemente mirando la tabla periódica y contando cuántas columnas se encuentra un elemento desde el extremo izquierdo o derecho. Por ejemplo, se puede predecir que el bario (en el grupo 2) formará Ba 2 + para tener el mismo número de electrones que su gas noble más cercano, el xenón, que el oxígeno (en el grupo 16) formará O 2− para tener el mismo número de electrones que el neón, y el cesio (en el grupo 1) formará Cs + para tener también el mismo número de electrones que el xenón. Este método no suele funcionar para la mayoría de los metales de transición. Algunos iones monoatómicos comunes se encuentran en el Cuadro 5.8.2.
Tenga en cuenta el patrón
Los elementos en los grupos 1, 2 y 3 tienden a formar iones 1+, 2+ y 3+, respectivamente; los elementos de los grupos 15, 16 y 17 tienden a formar iones 3−, 2− y 1−, respectivamente.
Cuadro 5.8.2 Algunos iones monoatómicos comunes y sus nombres
| Grupo 1 | Grupo 2 | Grupo 3 | Grupo 13 | Grupo 15 | Grupo 16 | Grupo 17 |
|---|---|---|---|---|---|---|
|
Li + litio |
Ser 2 + berilio |
N 3− nitruro (azida) |
O 2− óxido |
F − fluoruro |
||
|
Na + sodio |
Mg 2 + magnesio |
Al 3 + aluminio |
P 3− fosfuro |
S 2− sulfuro |
Cl − cloruro |
|
|
K + potasio |
Ca 2 + calcio |
Sc 3 + Scandium |
Ga 3 + galio |
Como 3− arseniuro |
Se 2− selenida |
Br − bromuro |
|
Rb + rubidio |
Sr 2 + estroncio |
Y 3 + itrio |
En 3 + Indio |
Te 2− telururo |
I - yoduro |
|
|
Cs + cesio |
Ba 2 + bario |
La 3 + lantano |
Ejemplo 3
Predecir la carga sobre el ion monatómico más común formado por cada elemento.
- aluminio, utilizado en el reloj lógico cuántico, el reloj más preciso del mundo
- selenio, utilizado para hacer vidrio de color rubí
- itrio, utilizado para fabricar bujías de alto rendimiento
Dado: elemento
Preguntado por: carga iónica
Estrategia:
A Identificar el grupo en la tabla periódica al que pertenece el elemento. Con base en su ubicación en la tabla periódica, decidir si el elemento es un metal, que tiende a perder electrones; un no metal, que tiende a ganar electrones; o un semimetal, que puede hacer cualquiera de las dos.
B Después de localizar el gas noble que está más cerca del elemento, determinar el número de electrones que el elemento debe ganar o perder para tener el mismo número de electrones que el gas noble más cercano.
Solución:
- A El aluminio es un metal del grupo 13; en consecuencia, tenderá a perder electrones. B El gas noble más cercano al aluminio es el neón. El aluminio perderá tres electrones para formar el ion Al 3 +, que tiene el mismo número de electrones que el neón.
- A Selenio es un no metal en el grupo 16, por lo que tenderá a ganar electrones. B El gas noble más cercano es el kriptón, por lo que predecimos que el selenio ganará dos electrones para formar el ion Se 2−, que tiene el mismo número de electrones que el kriptón.
- A El itrio está en el grupo 3, y los elementos de este grupo son metales que tienden a perder electrones. B El gas noble más cercano al itrio es el kriptón, por lo que se prevé que el itrio pierda tres electrones para formar Y 3 +, que tiene el mismo número de electrones que el kriptón.
Ejercicio
Predecir la carga sobre el ion monatómico más común formado por cada elemento.
- calcio, utilizado para prevenir la osteoporosis
- yodo, requerido para la síntesis de hormonas tiroideas
- circonio, ampliamente utilizado en reactores nucleares
Responder
- Ca 2 +
- I -
- Zr 4 +
Propiedades físicas de los compuestos iónicos y covalentes
En general, los compuestos iónicos y covalentes tienen diferentes propiedades físicas. Como hemos comentado, los compuestos iónicos suelen formar sólidos cristalinos duros que se funden a temperaturas bastante altas y son muy resistentes a la evaporación. Estas propiedades provienen de la estructura interna característica de un sólido iónico, ilustrada esquemáticamente en la parte (a) en la Figura 5.8.8, que muestra la matriz tridimensional de iones positivos y negativos alternos unidos por fuertes atracciones electrostáticas. Por el contrario, como se muestra en la parte (b) en la Figura 5.8.8, la mayoría de los compuestos covalentes consisten en moléculas discretas mantenidas juntas por fuerzas intermoleculares comparativamente débiles (las fuerzas entre moléculas), aunque los átomos dentro de cada molécula se mantienen unidos por fuertes enlaces covalentes intramoleculares (las fuerzas dentro de la molécula). Las sustancias covalentes pueden ser gases, líquidos o sólidos a temperatura y presión ambiente, dependiendo de la fuerza de las interacciones intermoleculares. Los sólidos moleculares covalentes tienden a formar cristales blandos que se funden a temperaturas bastante bajas y se evaporan con relativa facilidad. Algunas sustancias covalentes, sin embargo, no son moleculares sino que consisten en infinitas matrices tridimensionales de átomos unidos covalentemente e incluyen algunos de los materiales más duros conocidos, como el diamante. Este tema se abordará en el segundo semestre. Los enlaces covalentes que mantienen unidos los átomos en las moléculas no se ven afectados cuando las sustancias covalentes se funden o evaporan, por lo que se forma un líquido o vapor de moléculas discretas e independientes. Por ejemplo, a temperatura ambiente, el metano, el principal constituyente del gas natural, es un gas que está compuesto por moléculas discretas de CH 4. En la Tabla 5.8.3 se ofrece una comparación de las diferentes propiedades físicas de los compuestos iónicos y sustancias moleculares covalentes.
Tabla 5.8.3 Propiedades Físicas de Compuestos Iónicos Típicos y Sustancias Moleculares Covalentes
| Compuestos Ionicos | Sustancias moleculares covalentes |
|---|---|
| sólidos duros | gases, líquidos o sólidos blandos |
| altos puntos de fusión | puntos de fusión bajos |
| no volátil | volátil |
Figura 5.8.8 Interacciones en Sólidos Iónicos y Covalentes
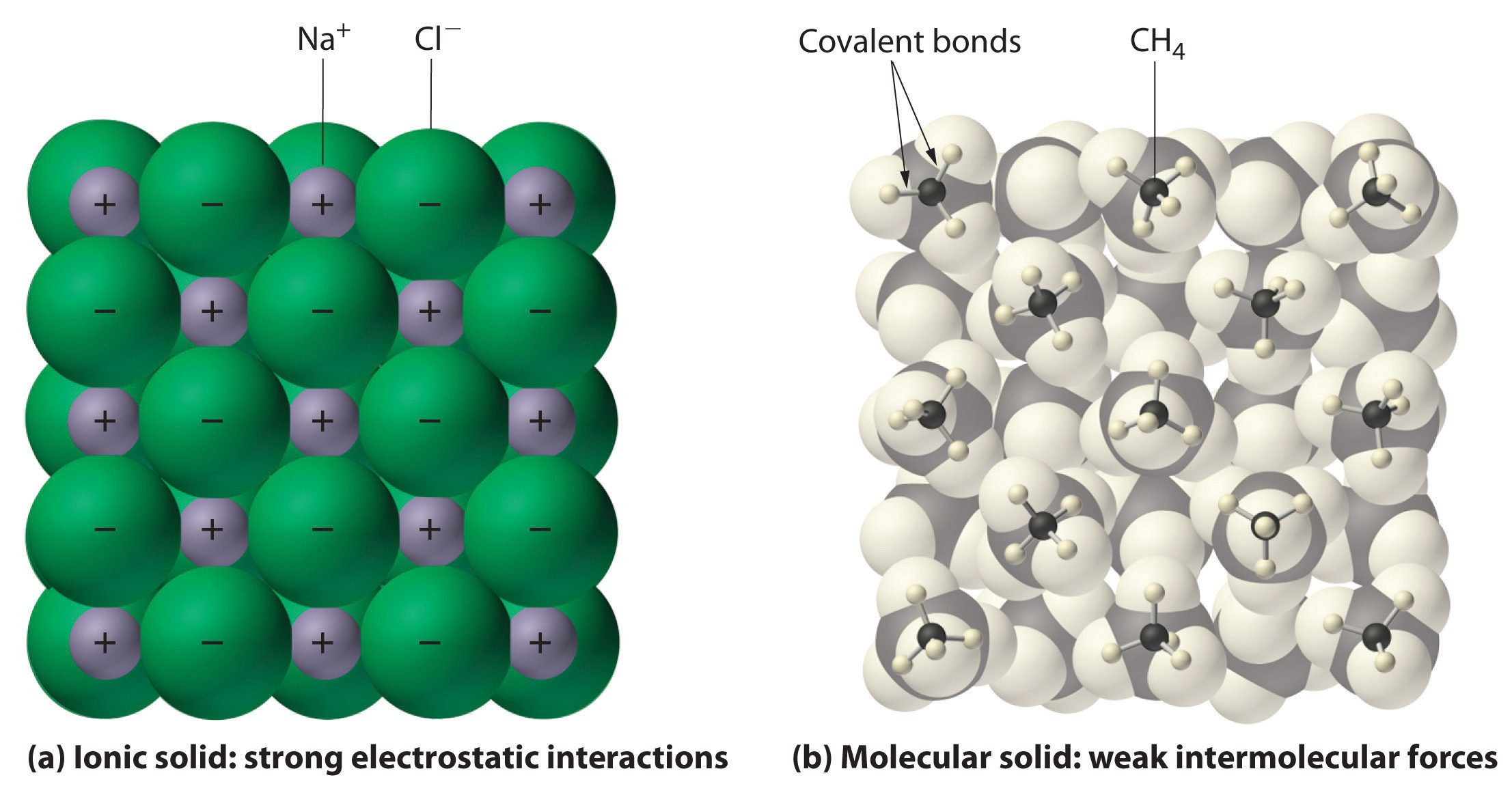
(a) Los iones cargados positiva y negativamente en un sólido iónico como el cloruro de sodio (NaCl) se mantienen unidos por fuertes interacciones electrostáticas. (b) En esta representación del empaquetamiento de moléculas de metano (CH 4) en metano sólido, un sólido molecular prototípico, las moléculas de metano se mantienen unidas en el sólido solo por fuerzas intermoleculares relativamente débiles, a pesar de que los átomos dentro de cada molécula de metano se mantienen unidos por fuertes enlaces covalentes.
Resumen
Los átomos en los compuestos químicos se mantienen unidos por interacciones electrostáticas atractivas conocidas como enlaces químicos. Los compuestos iónicos contienen iones cargados positiva y negativamente en una proporción que resulta en una carga global de cero. Los iones se mantienen unidos en una disposición espacial regular por fuerzas electrostáticas. La mayoría de los compuestos covalentes consisten en moléculas, grupos de átomos en los que uno o más pares de electrones son compartidos por al menos dos átomos para formar un enlace covalente. Los átomos en las moléculas se mantienen unidos por la atracción electrostática entre los núcleos cargados positivamente de los átomos unidos y los electrones cargados negativamente compartidos por los núcleos. La fórmula molecular de un compuesto covalente da los tipos y números de átomos presentes. Los compuestos que contienen predominantemente carbono e hidrógeno se denominan compuestos orgánicos, mientras que los compuestos que consisten principalmente en elementos distintos del carbono y el hidrógeno son compuestos inorgánicos. Las moléculas diatómicas contienen dos átomos, y las moléculas poliatómicas contienen más de dos. Una fórmula estructural indica la composición y estructura aproximada y forma de una molécula. Los enlaces simples, dobles y triples enlaces son enlaces covalentes en los que uno, dos y tres pares de electrones, respectivamente, se comparten entre dos átomos unidos. Los átomos o grupos de átomos que poseen una carga eléctrica neta se denominan iones; pueden tener una carga positiva (cationes) o una carga negativa (aniones). Los iones pueden consistir en un átomo (iones monatómicos) o varios (iones poliatómicos). Las cargas sobre los iones monatómicos de la mayoría de los elementos del grupo principal se pueden predecir a partir de la ubicación del elemento en la tabla periódica. Los compuestos iónicos suelen formar sólidos cristalinos duros con altos puntos de fusión. Los compuestos moleculares covalentes, por el contrario, consisten en moléculas discretas unidas por fuerzas intermoleculares débiles y pueden ser gases, líquidos o sólidos a temperatura y presión ambiente.
Llave para llevar
- Existen dos tipos fundamentalmente diferentes de enlaces químicos (covalentes e iónicos) que hacen que las sustancias tengan propiedades muy diferentes.
Problemas conceptuales
-
Los compuestos iónicos y covalentes se mantienen unidos por atracciones electrostáticas entre partículas cargadas opositivamente. Describir las diferencias en la naturaleza de las atracciones en compuestos iónicos y covalentes. ¿Qué clase de compuestos contiene pares de electrones compartidos entre átomos unidos?
-
¿Cuál contiene menos electrones que el átomo neutro, el catión correspondiente o el anión?
-
¿Cuál es la diferencia entre un compuesto orgánico y un compuesto inorgánico?
-
¿Cuál es la ventaja de escribir una fórmula estructural como fórmula condensada?
-
La mayoría de los elementos que existen como moléculas diatómicas se encuentran en un grupo de la tabla periódica. Identificar el grupo.
-
Discutir las diferencias entre compuestos covalentes e iónicos con respecto a
- las fuerzas que mantienen unidos a los átomos.
- puntos de fusión.
- estados físicos a temperatura y presión ambiente.
-
¿Por qué los compuestos covalentes generalmente tienden a tener puntos de fusión más bajos que los compuestos iónicos?
Contestar
-
Los compuestos covalentes generalmente se funden a temperaturas más bajas que los compuestos iónicos debido a que las interacciones intermoleculares que mantienen unidas a las moléculas en un sólido molecular son más débiles que las atracciones electrostáticas que mantienen unidos los iones con carga opuesta en un sólido iónico.
Problemas numéricos
-
La fórmula estructural para el cloroformo (CHCl 3) se mostró en el Ejemplo 2. Con base en esta información, se dibuja la fórmula estructural del diclorometano (CH 2 Cl 2).
-
¿Cuál es el número total de electrones presentes en cada ion?
- F −
- Rb +
- Ce 3 +
- Zr 4 +
- Zn 2 +
- Kr 2 +
- B 3 +
-
¿Cuál es el número total de electrones presentes en cada ion?
- Ca 2 +
- Se 2−
- En 3 +
- Sr 2 +
- Como 3 +
- N 3−
- Tl +
-
Predecir cuántos electrones hay en cada ion.
- un ion oxígeno con una carga −2
- un ion berilio con una carga +2
- un ion de plata con una carga +1
- un ion selenio con una carga +4
- un ion hierro con una carga +2
- un ion cloro con una carga −1
-
Predecir cuántos electrones hay en cada ion.
- un ion de cobre con una carga +2
- un ion molibdeno con una carga +4
- un ion yodo con una carga −1
- un ion galio con una carga +3
- un ion de itterbio con una carga +3
- un ion de escandio con una carga +3
-
Predecir la carga sobre el ion monatómico más común formado por cada elemento.
- cloro
- fósforo
- Scandium
- magnesio
- arsénico
- oxígeno
-
Predecir la carga sobre el ion monatómico más común formado por cada elemento.
- sodio
- selenio
- bario
- rubidio
- nitrógeno
- aluminio
-
Para cada representación de un ion monatómico, identificar el átomo padre, escribir la fórmula del ion usando un superíndice apropiado, e indicar el período y grupo de la tabla periódica en la que se encuentra el elemento.
- \( _{4}^{9}\textrm{X}_{2+} \)
- \( _{1}^{1}\textrm{X}_{-} \)
- \( _{8}^{16}\textrm{X}_{2-} \)
-
Para cada representación de un ion monatómico, identificar el átomo padre, escribir la fórmula del ion usando un superíndice apropiado, e indicar el período y grupo de la tabla periódica en la que se encuentra el elemento.
- \( _{3}^{7}\textrm{X}_{+} \)
- \( _{9}^{19}\textrm{X}_{-} \)
- \( _{13}^{27}\textrm{X}_{3+} \)
RESPUESTAS
-
- 27
- 38
- 54
- 28
- 67
- 18
-
- Li, Li +, 2do periodo, grupo 1
- F, F —, 2do periodo, grupo 17
- Al, Al 3 +, 3o periodo, grupo 13
Colaboradores
- Anonymous
Modificado por Joshua Halpern


