11.1: Introducción
- Page ID
- 78328
- Familiarizarse con la descripción cinética molecular de líquidos.
La teoría molecular cinética de los gases descrita en el Capítulo 10 da una descripción razonablemente precisa del comportamiento de los gases. Un modelo similar se puede aplicar a líquidos, pero debe tomar en cuenta los volúmenes de partículas distintos de cero y la presencia de fuertes fuerzas de atracción intermoleculares.
En un gas, la distancia entre moléculas, ya sean monatómicas o poliatómicas, es muy grande en comparación con el tamaño de las moléculas; así los gases tienen una baja densidad y son altamente compresibles. En contraste, las moléculas en los líquidos están muy juntas, esencialmente sin espacio vacío entre ellas. Al igual que en los gases, sin embargo, las moléculas en los líquidos están en constante movimiento, y su energía cinética (y por lo tanto su velocidad) depende de su temperatura. Comenzamos nuestra discusión examinando algunas de las propiedades características de los líquidos para ver cómo cada uno es consistente con una descripción molecular cinética modificada.
Densidad
Las moléculas de un líquido se empaquetan relativamente juntas. En consecuencia, los líquidos son mucho más densos que los gases. La densidad de un líquido es típicamente aproximadamente la misma que la densidad del estado sólido de la sustancia. Por lo tanto, las densidades de los líquidos se miden más comúnmente en unidades de gramos por centímetro cúbico (g/cm 3) o gramos por mililitro (g/mL) que en gramos por litro (g/L), la unidad comúnmente utilizada para gases.
Orden Molecular
Los líquidos exhiben orden de corto alcance porque fuertes fuerzas de atracción intermolecular hacen que las moléculas se empaqueten con bastante fuerza. Sin embargo, debido a su mayor energía cinética en comparación con las moléculas en un sólido, las moléculas en un líquido se mueven rápidamente unas con respecto a otras. Por lo tanto, a diferencia de los iones en los sólidos iónicos discutidos en la Sección 4.1, las moléculas en los líquidos no están dispuestas en una matriz tridimensional repetitiva. A diferencia de las moléculas en los gases, sin embargo, la disposición de las moléculas en un líquido no es completamente aleatoria.
Compresibilidad
Los líquidos tienen tan poco espacio vacío entre sus moléculas componentes que no pueden comprimirse fácilmente. La compresión obligaría a los átomos de las moléculas adyacentes a ocupar la misma región del espacio.
Expansión Térmica
Las fuerzas intermoleculares en los líquidos son lo suficientemente fuertes como para evitar que se expandan significativamente cuando se calientan (típicamente solo unos pocos por ciento en un rango de temperatura de 100 °C). Así los volúmenes de líquidos son algo fijos. Observe del Cuadro 11.0.1 que la densidad del agua, por ejemplo, cambia solo en aproximadamente 3% sobre un rango de temperatura de 90 grados.
Cuadro 11.0.1 La densidad del agua a diversas temperaturas
| T (°C) | Densidad (g/cm 3) |
|---|---|
| 0 | 0.99984 |
| 30 | 0.99565 |
| 60 | 0.98320 |
| 90 | 0.96535 |
Difusión
Las moléculas en los fluidos se difunden porque están en constante movimiento (Figura 11.0.1). Una molécula en un líquido no puede moverse mucho antes de chocar con otra molécula, sin embargo, por lo que la trayectoria libre media en líquidos es muy corta, y la velocidad de difusión es mucho más lenta que en los gases.
Figura 11.0.1 Difusión molecular en un líquido Se añade una gota de una solución acuosa que contiene un colorante marcador a un volumen mayor de agua. A medida que se difunde, el color del tinte se vuelve más tenue en los bordes.
Fluidez
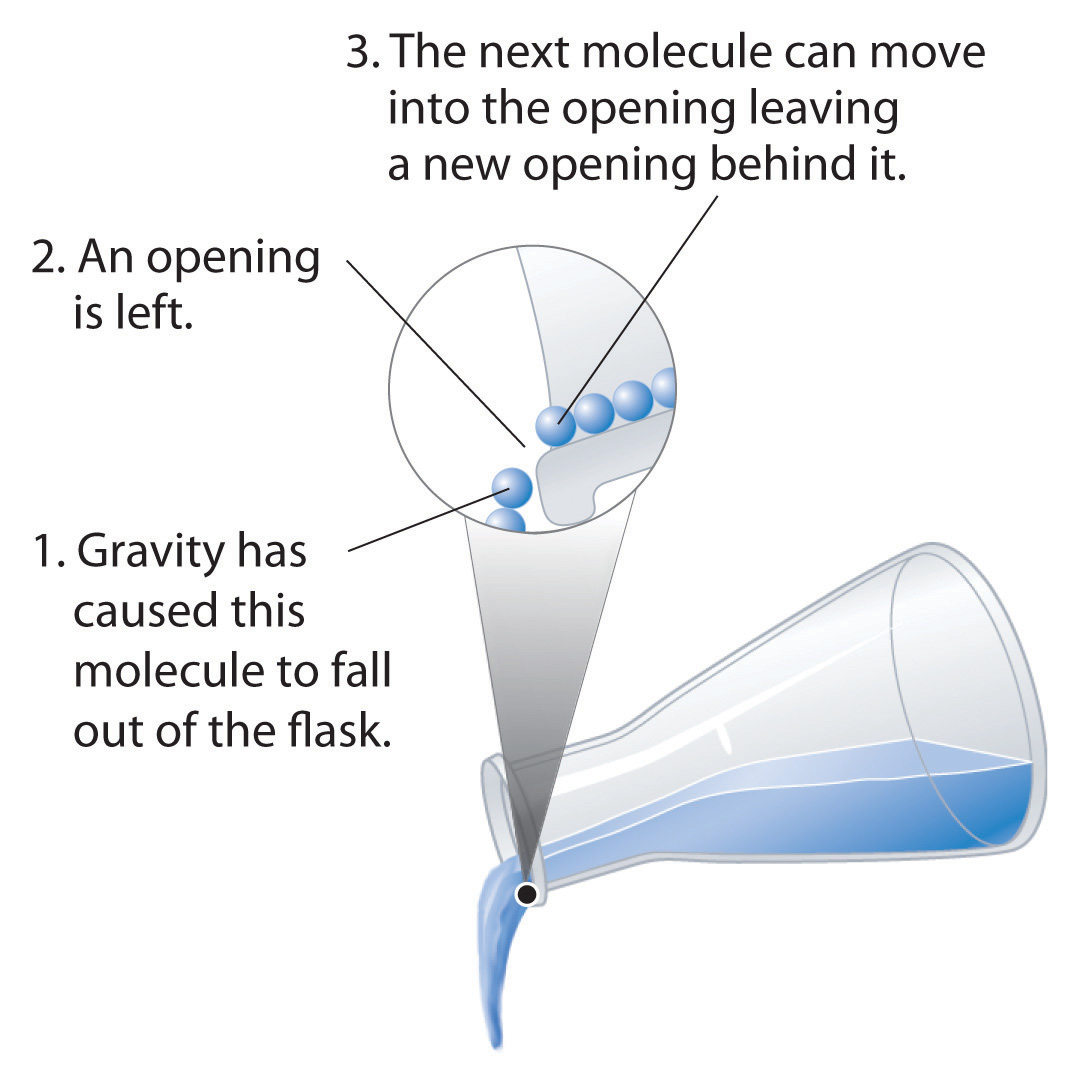
Los líquidos pueden fluir, ajustándose a la forma de sus contenedores, porque sus moléculas son libres de moverse. Esta libertad de movimiento y su estrecha separación permiten que las moléculas en un líquido se desplacen rápidamente hacia las aberturas dejadas por otras moléculas, generando a su vez más aberturas, y así sucesivamente (Figura 11.0.2).
Figura 11.0.2 Por qué Líquidos Flo w Las moléculas en un líquido están en constante movimiento. En consecuencia, cuando el matraz se inclina, las moléculas se mueven hacia la izquierda y hacia abajo debido a la fuerza de la gravedad, y las aberturas son ocupadas por otras moléculas. El resultado es un flujo neto de líquido fuera del recipiente.
Resumen
Las propiedades de los líquidos pueden explicarse utilizando una versión modificada de la teoría molecular cinética de los gases descrita en el Capítulo 10. Este modelo explica la mayor densidad, mayor orden y menor compresibilidad de los líquidos frente a los gases; la expansión térmica de los líquidos; por qué se difunden; y por qué adoptan la forma (pero no el volumen) de sus contenedores.
Llave para llevar
- La descripción molecular cinética de los líquidos debe tomar en cuenta tanto los volúmenes de partículas distintos de cero como la presencia de fuertes fuerzas de atracción intermoleculares.
Problemas conceptuales
-
Un líquido, a diferencia de un gas, es prácticamente incompresible. Explique qué significa esto usando descripciones macroscópicas y microscópicas. ¿Qué propiedades físicas generales comparten los líquidos con los sólidos? ¿Qué propiedades comparten los líquidos con los gases?
-
Utilizando un enfoque molecular cinético, discutir las diferencias y similitudes entre líquidos y gases con respecto a
- expansión térmica.
- fluidez.
- difusión.
-
¿Cómo se debe alterar la ley de gases ideales para aplicar la teoría molecular cinética de los gases a los líquidos? Explicar.
-
¿Por qué las velocidades cuadráticas medias de las moléculas en los líquidos son menores que las velocidades cuadráticas medias de las moléculas en los gases?