24.5: Estabilidad Termodinámica del Núcleo Atómico
- Page ID
- 78223
- Calcular un balance masa-energía y una energía nuclear vinculante.
- Comprender las diferencias entre la fisión nuclear y la fusión.
Las reacciones nucleares, como las reacciones químicas, van acompañadas de cambios en la energía. Los cambios energéticos en las reacciones nucleares, sin embargo, son enormes comparados con los de incluso las reacciones químicas más energéticas. De hecho, los cambios energéticos en una reacción nuclear típica son tan grandes que resultan en un cambio medible de masa. En esta sección, describimos la relación entre masa y energía en las reacciones nucleares y mostramos cómo los aparentemente pequeños cambios en la masa que acompañan a las reacciones nucleares dan como resultado la liberación de enormes cantidades de energía.
Balance de masa y energía
La relación entre masa (m) y energía (E) se expresa en la siguiente ecuación:
\[E = mc^2 \label{20.27}\]
donde c es la velocidad de la luz (2.998 × 10 8 m/s), y E y m se expresan en unidades de julios y kilogramos, respectivamente. Albert Einstein derivó por primera vez esta relación en 1905 como parte de su teoría especial de la relatividad: la masa de una partícula es directamente proporcional a su energía. Así, según la Ecuación 20.27, cada masa tiene una energía asociada, y de manera similar, cualquier reacción que implique un cambio en la energía debe ir acompañada de un cambio en la masa. Esto implica que todas las reacciones exotérmicas deben ir acompañadas de una disminución de la masa, y todas las reacciones endotérmicas deben ir acompañadas de un aumento de masa. Dada la ley de conservación de la masa, ¿cómo puede ser esto cierto? La solución a esta aparente contradicción es que las reacciones químicas en efecto van acompañadas de cambios en la masa, pero estos cambios son simplemente demasiado pequeños para ser detectados. Como recordarás, todas las partículas presentan un comportamiento ondular, pero la longitud de onda es inversamente proporcional a la masa de la partícula (en realidad, a su momento, el producto de su masa y velocidad). En consecuencia, el comportamiento de tipo onda es detectable solo para partículas con masas muy pequeñas, como los electrones. Por ejemplo, la ecuación química para la combustión de grafito para producir dióxido de carbono es la siguiente:
\[\textrm{C(graphite)} + \frac{1}{2}\textrm O_2(\textrm g)\rightarrow \mathrm{CO_2}(\textrm g)\hspace{5mm}\Delta H^\circ=-393.5\textrm{ kJ/mol} \label{20.28}\]
Las reacciones de combustión se llevan a cabo típicamente a presión constante, y bajo estas condiciones, el calor liberado o absorbido es igual a ΔH. Cuando se lleva a cabo una reacción a volumen constante, el calor liberado o absorbido es igual a ΔE. Para la mayoría de las reacciones químicas, sin embargo, ΔE ≈ ΔH. Si reescribimos la ecuación de Einstein como
podemos reorganizar la ecuación para obtener la siguiente relación entre el cambio de masa y el cambio de energía:
\[\Delta m=\dfrac{\Delta E}{c^2} \label{20.30}\]
Debido a que 1 J = 1 (kg·m 2) /s 2, el cambio en masa es el siguiente:
Esto es un cambio de masa de aproximadamente 3.6 × 10 −10 g/g de carbono que se quema, o aproximadamente 100 millonésimas de la masa de un electrón por átomo de carbono. En la práctica, este cambio de masa es demasiado pequeño para medirlo experimentalmente y es insignificante.
En contraste, para una reacción nuclear típica, como la desintegración radiactiva de 14 C a 14 N y un electrón (una partícula β), hay un cambio de masa mucho mayor:
Podemos usar las masas medidas experimentalmente de partículas subatómicas e isótopos comunes para calcular el cambio de masa directamente. La reacción implica la conversión de un átomo neutro de 14 C en un ion 14 N cargado positivamente (con seis, no siete, electrones) y una partícula β cargada negativamente (un electrón), por lo que la masa de los productos es idéntica a la masa de un átomo neutro de 14 N. El cambio total de masa durante la reacción es, por lo tanto, la diferencia entre la masa de un átomo neutro de 14 N (14.003074 amu) y la masa de un átomo de 14 C (14.003242 amu):
\ [\ begin {align}\ Delta m &= {\ textrm {masa} _ {\ textrm {productos}} -\ textrm {masa} _ {\ textrm {reactantes}}
\\ &=14.003074\ textrm {amu} - 14.003242\ textrm {amu} = - 0.000168\ textrm {amu}\ end {alinear}\ etiqueta {20.33}\]
La diferencia de masa, que ha sido liberada como energía, corresponde a casi un tercio de un electrón. El cambio de masa para la descomposición de 1 mol de 14 C es −0.000168 g = −1.68 × 10 −4 g = −1.68 × 10-7 kg. Si bien un cambio de masa de esta magnitud puede parecer pequeño, es aproximadamente 1000 veces mayor que el cambio de masa para la combustión del grafito. El cambio energético es el siguiente:
La energía liberada en esta reacción nuclear es más de 100.000 veces mayor que la de una reacción química típica, a pesar de que la descomposición de 14 C es una reacción nuclear de energía relativamente baja.
Debido a que los cambios de energía en las reacciones nucleares son tan grandes, a menudo se expresan en kiloelectronvoltios (1 keV = 10 3 eV), megaelectronvoltios (1 MeV = 10 6 eV), e incluso gigaelectronvoltios (1 GeV = 10 9 eV) por átomo o partícula. El cambio de energía que acompaña a una reacción nuclear puede calcularse a partir del cambio de masa usando la relación 1 amu = 931 MeV. La energía liberada por la desintegración de un átomo de 14 C es así
Calcular los cambios de masa (en unidades de masa atómica) y energía (en julios por mol y electronvoltios por átomo) que acompañan a la desintegración radiactiva de 238 U a 234 Th y una partícula α. La partícula α absorbe dos electrones de la materia circundante para formar un átomo de helio.
Dado: reacción de desintegración nuclear
Preguntado por: cambios en masa y energía
Estrategia:
A Utilice los valores de masa del Cuadro 20.1 para calcular el cambio de masa para la reacción de decaimiento en unidades de masa atómica.
B Utilice la Ecuación 20.30 para calcular el cambio de energía en julios por mol.
C Utilizar la relación entre unidades de masa atómica y megaelectronvoltios para calcular el cambio de energía en electronvoltios por átomo.
Solución
A Utilizando masas de partículas e isótopos de la Tabla 20.1, podemos calcular el cambio de masa de la siguiente manera:
\\ &= (234.043601\ textrm {amu} +4.002603\ textrm {amu}) - 238.050788\ textrm {amu} = - 0.004584\ textrm {amu}\ end {align}\)
B Así, el cambio de masa para 1 mol de 238 U es −0.004584 g o −4.584 × 10 −6 kg. El cambio de energía en julios por mol es el siguiente:
ΔE = (Δm) c 2 = (−4.584 × 10 −6 kg) (2.998 × 10 8 m/s) 2 = −4.120 × 10 11 J/mol
C El cambio de energía en electronvoltios por átomo es el siguiente:
Calcular los cambios de masa (en unidades de masa atómica) y energía (en kilojulios por mol y kiloelectronvoltios por átomo) que acompañan a la desintegración radiactiva del tritio (3 H) a 3 He y una partícula β.
Contestar
Δm = −2.0 × 10 −5 amu; ΔE = −1.9 × 10 6 kJ/mol = −19 Kev/átomo
Energías de unión nuclear
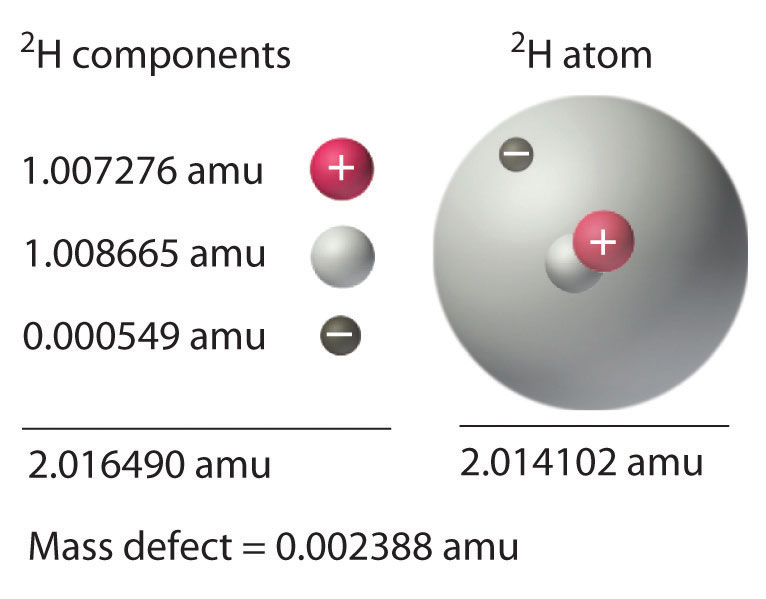
Hemos visto que los cambios energéticos tanto en las reacciones químicas como en las nucleares van acompañados de cambios en la masa. La ecuación de Einstein, que nos permite interconvertir masa y energía, tiene otra consecuencia interesante: La masa de un átomo es siempre menor que la suma de las masas de sus partículas componentes. La única excepción a esta regla es el hidrógeno-1 (1 H), cuya masa medida de 1.007825 amu es idéntica a la suma de las masas de un protón y un electrón. En contraste, la masa medida experimentalmente de un átomo de deuterio (2 H) es 2.014102 amu, aunque su masa calculada es 2.016490 amu:
\\ &=1.008665\ textrm {amu} +1.007276\ textrm {amu} +0.000549\ textrm {amu} u} =2.016490\ textrm {amu}\ end {align}\ label {20.36}\]
La diferencia entre la suma de las masas de los componentes y la masa atómica medida se denomina defecto de masa del núcleo. Así como una molécula es más estable que sus átomos aislados, un núcleo es más estable (menor en energía) que sus componentes aislados. En consecuencia, cuando los nucleones aislados se ensamblan en un núcleo estable, se libera energía. Según la Ecuación\(\ref{20.30}\), esta liberación de energía debe ir acompañada de una disminución en la masa del núcleo.
La cantidad de energía liberada cuando se forma un núcleo a partir de sus nucleones componentes es la energía de unión nuclear (Figura 21.2.1). En el caso del deuterio, el defecto de masa es 0.002388 amu, lo que corresponde a una energía de unión nuclear de 2.22 MeV para el núcleo de deuterio. Debido a que la magnitud del defecto de masa es proporcional a la energía de unión nuclear, ambos valores indican la estabilidad del núcleo.
Así como una molécula es más estable (menor en energía) que sus átomos aislados, un núcleo es más estable que sus componentes aislados.
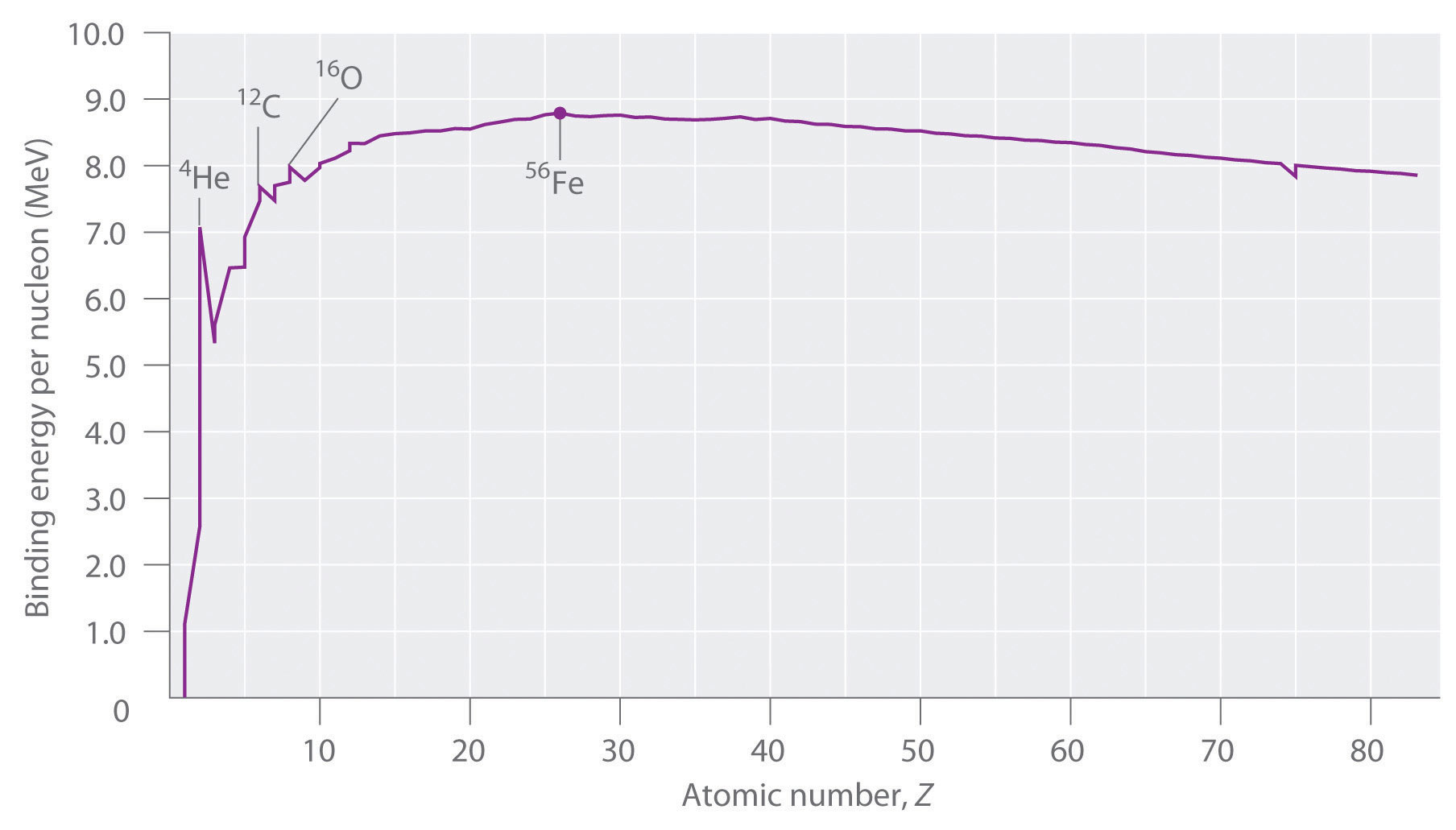
No todos los núcleos son igualmente estables. Los químicos describen la estabilidad relativa de diferentes núcleos comparando la energía de unión por nucleón, la cual se obtiene dividiendo la energía de unión nuclear por el número de masa (A) del núcleo. Como se muestra en la Figura\(\PageIndex{2}\), la energía de unión por nucleón aumenta rápidamente al aumentar el número atómico hasta aproximadamente Z = 26, donde se nivela a aproximadamente 8—9 MeV por nucleón y luego disminuye lentamente. El aumento inicial en la energía de unión no es una curva suave sino que exhibe picos agudos correspondientes a los núcleos de luz que tienen igual número de protones y neutrones (por ejemplo, 4 He, 12 C y 16 O). Como se mencionó anteriormente, se trata de combinaciones particularmente estables.
Debido a que la energía de unión máxima por nucleón se alcanza a 56 Fe, todos los demás núcleos son termodinámicamente inestables con respecto a la formación de 56 Fe. En consecuencia, los núcleos más pesados (hacia la derecha adentro\(\PageIndex{2}\)) deben sufrir espontáneamente reacciones como la desintegración alfa, que resultan en una disminución en el número atómico. Por el contrario, los elementos más ligeros (a la izquierda en la Figura\(\PageIndex{2}\)) deben sufrir espontáneamente reacciones que resulten en un aumento en el número atómico. Este es efectivamente el patrón observado.
Los núcleos más pesados experimentan espontáneamente reacciones nucleares que disminuyen su número atómico. Los núcleos más ligeros experimentan espontáneamente reacciones nucleares que incrementan su número atómico.
Calcular la energía nuclear total de unión (en megaelectronvoltios) y la energía de unión por nucleón para 56 Fe. La masa experimental del nucleido se da en la Tabla A4.
Dado: nucleido y masa
Preguntado por: energía de unión nuclear y energía de unión por nucleón
Estrategia:
A Suma las masas de los protones, electrones y neutrones o, alternativamente, utilice la masa del número apropiado de átomos de 1 H (porque su masa es la misma que la masa de un electrón y un protón).
B Calcular el defecto de masa restando la masa experimental de la masa calculada.
C Determinar la energía de unión nuclear multiplicando el defecto de masa por el cambio de energía en electronvoltios por átomo. Divida este valor por el número de nucleones para obtener la energía de unión por nucleón.
Solución
A Un átomo de hierro 56 tiene 26 protones, 26 electrones y 30 neutrones. Podríamos sumar las masas de estos tres conjuntos de partículas; sin embargo, al señalar que 26 protones y 26 electrones equivalen a 26 átomos de 1 H, podemos calcular la suma de las masas más rápidamente de la siguiente manera:
&=26 (1.007825)\ textrm {amu} +30 (1.008665)\ textrm {amu} =56.463400\ textrm {amu}\\
\ textrm {masa experimental} &=55.934938
\ end {align}\)
B restamos para encontrar el defecto de masa:
\\ &=56.463400\ textrm {amu} -55.934938\ textrm {amu} =0.528462\ textrm {amu}\ end {align}\)
C La energía de unión nuclear es así 0.528462 amu × 931 MeV/AMU = 492 MeV. La energía de unión por nucleón es 492 MeV/56 nucleones = 8.79 MeV/nucleón.
Calcular la energía nuclear total de unión (en megaelectronvoltios) y la energía de unión por nucleón para 238 U.
Contestar 1800 MeV/ 238 U; 7.57 MeV/Nucleón
Fsión y Fusión Nuclear
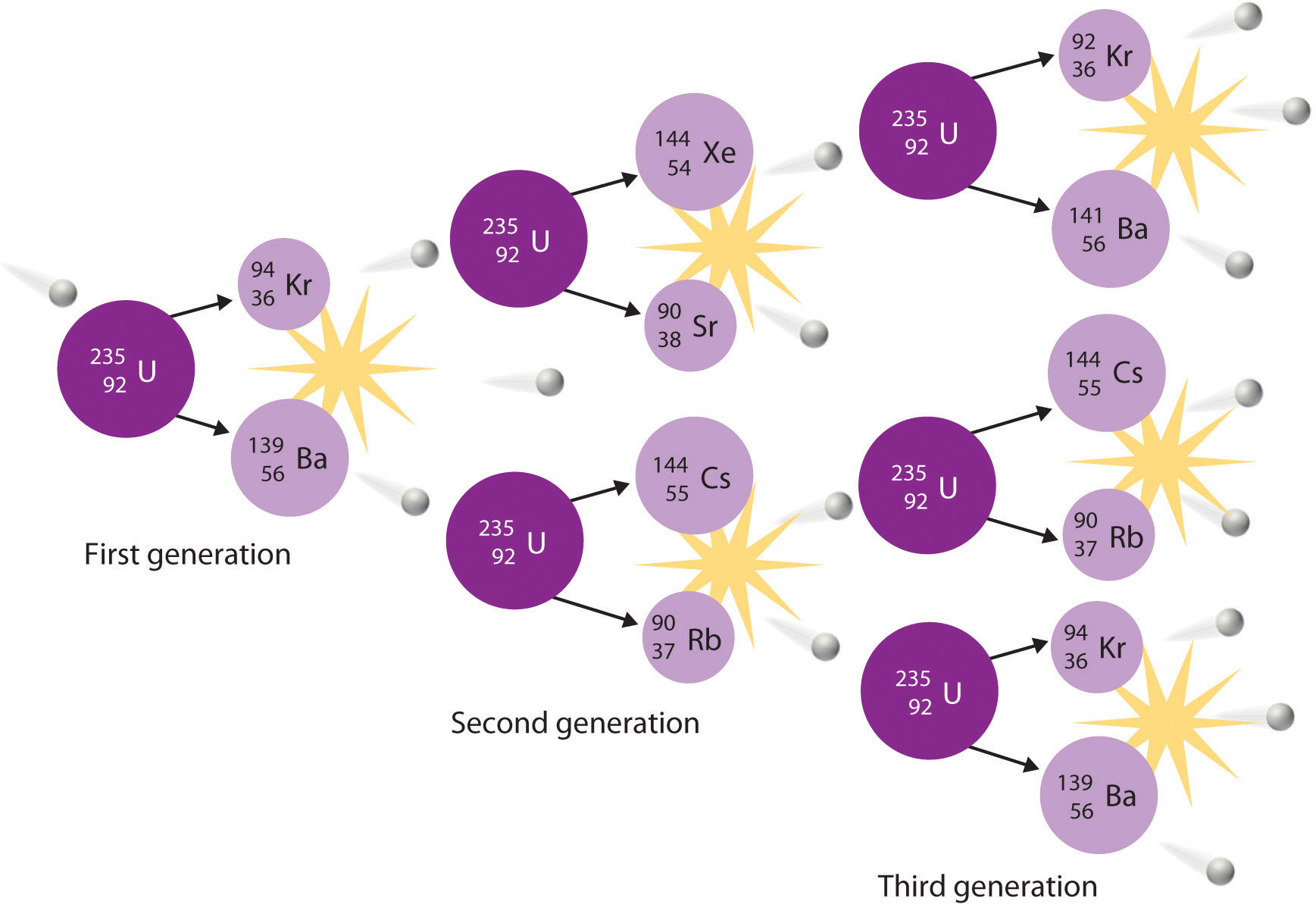
La fisión nuclear N es la división de un núcleo pesado en dos más ligeros. La fisión fue descubierta en 1938 por los científicos alemanes Otto Hahn, Lise Meitner y Fritz Strassmann, quienes bombardearon una muestra de uranio con neutrones en un intento de producir nuevos elementos con Z > 92. Observaron que durante la reacción se formaron elementos más ligeros como el bario (Z = 56), y se dieron cuenta de que dichos productos tenían que originarse de la fisión inducida por neutrones del uranio-235:
\[_{92}^{235}\textrm U+\,_0^1\textrm n \rightarrow \,_{56}^{141}\textrm{Ba}+\,_{36}^{92}\textrm{Kr}+3_0^1\textrm n \label{20.37}\]
Esta hipótesis se confirmó detectando el producto de fisión de kriptón-92. El núcleo suele dividirse asimétricamente en lugar de en dos partes iguales, y la fisión de un nucleido dado no da los mismos productos cada vez.
En una reacción típica de fisión nuclear, cada núcleo divisorio libera más de un neutrón. Cuando estos neutrones chocan e inducen fisión en otros núcleos vecinos, puede resultar una serie autosostenida de reacciones de fisión nuclear conocidas como reacción en cadena nuclear (Figura\(\PageIndex{3}\)). Por ejemplo, la fisión de 235 U libera de dos a tres neutrones por evento de fisión. Si son absorbidos por otros núcleos de 235 U, esos neutrones inducen eventos de fisión adicionales, y la velocidad de la reacción de fisión aumenta geométricamente. Cada serie de eventos se llama generación. Experimentalmente, se encuentra que se requiere alguna masa mínima de un isótopo fisionable para sostener una reacción nuclear en cadena; si la masa es demasiado baja, demasiados neutrones son capaces de escapar sin ser capturados e induciendo una reacción de fisión. La masa mínima capaz de soportar la fisión sostenida se denomina masa crítica. Esta cantidad depende de la pureza del material y la forma de la masa, que corresponde a la cantidad de superficie disponible de la que pueden escapar los neutrones, y de la identidad del isótopo. Si la masa del isótopo fisible es mayor que la masa crítica, entonces en las condiciones adecuadas, la masa supercrítica resultante puede liberar energía explosivamente. La enorme energía liberada de las reacciones nucleares en cadena es la responsable de la destrucción masiva causada por la detonación de armas nucleares como las bombas de fisión, pero también forma la base de la industria de la energía nuclear.
La fusión nuclear, en la que se combinan dos núcleos ligeros para producir un núcleo más pesado y estable, es lo opuesto a la fisión nuclear. Al igual que en las reacciones de transmutación nuclear discutidas en la Sección 20.2, la carga positiva en ambos núcleos da como resultado una gran barrera de energía electrostática a la fusión. Esta barrera se puede superar si una o ambas partículas tienen suficiente energía cinética para superar las repulsiones electrostáticas, permitiendo que los dos núcleos se acerquen lo suficientemente cerca como para que ocurra una reacción de fusión. El principio es similar a agregar calor para aumentar la velocidad de una reacción química. Como se muestra en la gráfica de energía de unión nuclear por nucleón versus número atómico en la Figura 21.2.3, las reacciones de fusión son más exotérmicas para el elemento más ligero. Por ejemplo, en una reacción de fusión típica, dos átomos de deuterio se combinan para producir helio-3, un proceso conocido como fusión deuterio-deuterio (fusión D-D):
En otra reacción, un átomo de deuterio y un átomo de tritio se fusionan para producir helio-4 (Figura\(\PageIndex{4}\)), un proceso conocido como fusión deuterio-tritio (fusión D-T):
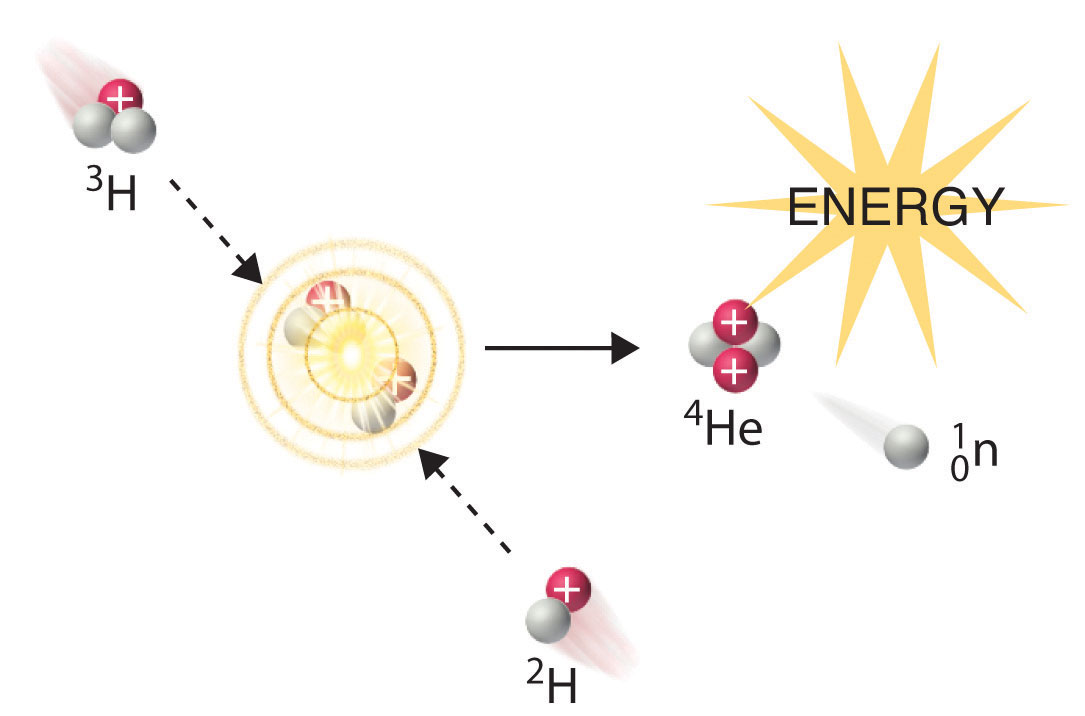
Iniciar estas reacciones, sin embargo, requiere una temperatura comparable a la del interior del sol (aproximadamente 1.5 × 10 7 K). Actualmente, el único método disponible en la Tierra para lograr tal temperatura es la detonación de una bomba de fisión. Por ejemplo, la llamada bomba de hidrógeno (o bomba H) es en realidad una bomba de deuterio-tritio (una bomba D—T), que utiliza una reacción de fisión nuclear para crear las temperaturas muy altas necesarias para iniciar la fusión de deuterido de litio sólido (6 LiD), que libera neutrones que luego reaccionan con 6 Li, produciendo tritio. La reacción deuterio-tritio libera energía explosivamente. El Ejemplo 9 y su correspondiente ejercicio demuestran las enormes cantidades de energía que producen las reacciones de fisión y fusión nucleares. De hecho, las reacciones de fusión son las fuentes de energía para todas las estrellas, incluido nuestro sol.
Calcular la cantidad de energía (en electronvoltios por átomo y kilojulios por mol) liberada cuando la fisión inducida por neutrones de 235 U produce 144 Cs, 90 Rb y dos neutrones:
Dado: reacción nuclear equilibrada
Preguntado por: energía liberada en electronvoltios por átomo y kilojulios por mol
Estrategia:
A Siguiendo el método utilizado en el Ejemplo\(\PageIndex{1}\), calcular el cambio de masa que acompaña a la reacción. Convertir este valor al cambio de energía en electronvoltios por átomo.
B Calcular el cambio de masa por mol de 235 U. Luego usa la Ecuación\(\ref{20.29}\) para calcular el cambio de energía en kilojulios por mol.
Solución
A El cambio de masa que acompaña a la reacción es el siguiente:
\\ & =( 143.932077\ textrm {amu} +89.914802\ textrm {amu} +1.008665\ textrm {amu}) -\ textrm {235.043930 amu}
\\ &=-0.188386\ textrm {amu}\ end {align}\)
El cambio de energía en electronvoltios por átomo es el siguiente:
B El cambio de masa por mol de\(_{92}^{235}\textrm{U}\) es −0.188386 g = −1.88386 × 10 −4 kg, por lo que el cambio de energía en kilojulios por mol es el siguiente:
\\ &=-1.693\ tiempos10^ {13}\ textrm {J/mol} =-1.693\ tiempos10^ {10}\ textrm {kJ/mol}\ end {align}\)
Calcular la cantidad de energía (en electronvoltios por átomo y kilojulios por mol) liberada cuando el deuterio y el tritio se fusionan para dar helio-4 y un neutrón:
Contestar
ΔE = −17.6 MeV/átomo = −1.697 × 10 9 kJ/mol
Resumen
A diferencia de una reacción química, una reacción nuclear da como resultado un cambio significativo en la masa y un cambio asociado de energía, como lo describe la ecuación de Einstein. Las reacciones nucleares van acompañadas de grandes cambios en la energía, que resultan en cambios detectables en la masa. El cambio en masa está relacionado con el cambio en la energía según la ecuación de Einstein: ΔE = (Δm) c 2. Los grandes cambios en la energía generalmente se reportan en kiloelectronvoltios o megaelectronvoltios (miles o millones de electronvoltios). Con la excepción de 1 H, la masa determinada experimentalmente de un átomo es siempre menor que la suma de las masas de las partículas componentes (protones, neutrones y electrones) en una cantidad llamada defecto de masa del núcleo. La energía correspondiente al defecto de masa es la energía nuclear de unión, la cantidad de energía liberada cuando se forma un núcleo a partir de sus partículas componentes. En la fisión nuclear, los núcleos se dividieron en núcleos más ligeros con una liberación acompañante de múltiples neutrones y grandes cantidades de energía. La masa crítica es la masa mínima requerida para soportar una reacción en cadena nuclear autosostenida. La fusión nuclear es un proceso en el que dos núcleos ligeros se combinan para producir un núcleo más pesado más una gran cantidad de energía.


