6.E: Estructura Electrónica y Propiedades Periódicas (Ejercicios)
- Page ID
- 75286
6.1: Energía electromagnética
Q6.1.1
La luz producida por un letrero de neón rojo se debe a la emisión de luz por los átomos de neón excitados. Describir cualitativamente el espectro producido al pasar la luz de una lámpara de neón a través de un prisma.
S6.1.1
El espectro consiste en líneas coloreadas, al menos una de las cuales (probablemente la más brillante) es roja.
Q6.1.2
Una estación de radio FM que se encuentra en 103.1 en el dial FM emite a una frecuencia de 1.031 × 10 8 s −1 (103.1 MHz). ¿Cuál es la longitud de onda de estas ondas de radio en metros?
S6.1.2
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{1.031 \times10^{8}\: \dfrac{1}{s}} = 2.908\:m\)
Q6.1.3
FM-95, una estación de radio FM, emite a una frecuencia de 9.51 × 10 7 s −1 (95.1 MHz). ¿Cuál es la longitud de onda de estas ondas de radio en metros?
S6.1.3
\(λ=\dfrac{c}{ν}\)
\(λ = \dfrac{2.998 \times10^{8}\: \dfrac{m}{s}}{9.51 \times10^{7}\: \dfrac{1}{s}} = 3.15 \:m\)
Q6.1.4
Una línea violeta brillante ocurre a 435.8 nm en el espectro de emisión de vapor de mercurio. ¿Qué cantidad de energía, en julios, debe ser liberada por un electrón en un átomo de mercurio para producir un fotón de esta luz?
S6.1.4
\(E= \dfrac{hc}{λ}\)
\(E= \dfrac{(2.998 \times 10^{8} \dfrac{m}{s})\: (6.6262 \times 10^{-34} Js)}{4.358 \times 10^{-7} m}\)
\(=4.56\times 10^{-19}J\)
Q6.1.5
La luz con una longitud de onda de 614.5 nm se ve naranja. ¿Cuál es la energía, en julios, por fotón de esta luz naranja? ¿Cuál es la energía en eV (1 eV = 1.602 × 10 −19 J)?
S6.1.5
1.) Primero convierte 614.5 nm en metros
\(6.145 nm\)=\(6.145 \times10^{-7} m\)
2.) Luego calcula la cantidad de energía que contiene esta longitud de onda de luz usando las ecuaciones:
\(E = hν\)y\(ν=\dfrac{c}{λ}\) que puede ser manipulado algebraicamente en:\(E=\dfrac{hc}{λ}\)
- h = Constante de Planck →\(6.6262 \times10^{-34} Js\)
- c = Velocidad de la luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = longitud de onda del fotón →\(6.145 \times10^{-7} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {6.145 \times 10^{−7}m \ } =3.233 \times 10^{-19} J\]
3.) Luego convierte Julios en eV:
\[=(3.233 \times 10^{−19}J) \times\dfrac{1eV}{1.602\times 10^{-19}J} \]\[=2.018 eV\]
Los átomos de litio calentados emiten fotones de luz con una energía de 2.961 × 10 −19 J. Calcular la frecuencia y longitud de onda de uno de estos fotones. ¿Cuál es la energía total en 1 mol de estos fotones? ¿Cuál es el color de la luz emitida?
S6.1.6
1.) \(E = hν\)y\(ν=\dfrac{E}{h}\)
- h = Constante de Planck →\(6.6262 \times10^{-34} Js\)
Frecuencia:\(ν=\dfrac{ 2.961\times 10^{-19}J}{6.6262\times 10^{-34}Js}\ = 4.469\times 10^{14} Hz\)
2.) \(λ=\dfrac{c}{ν}\)
c = Velocidad de la luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
Longitud de onda:\(λ=\dfrac{ 2.998\times 10^{8}\dfrac {m}{s}}{4.469\times 10^{14}\dfrac {1}{s}}\ = 6.709\times 10^{-7} m\) = Luz roja
Energía total:
\(E= \dfrac{2.961 \times 10^{-19}J}{1\: photon}\times\dfrac{6.022\times 10^{23}\: photons}{1\: mole} = 1.783\times 10^{5} J \)
Q6.1.7
Un fotón de luz producido por un láser quirúrgico tiene una energía de 3.027 × 10 −19 J. Calcular la frecuencia y longitud de onda del fotón. ¿Cuál es la energía total en 1 mol de fotones? ¿Cuál es el color de la luz emitida?
S6.1.7
ν = 4.568 × 10 14 s; λ = 656,3 nm; Energía mol −1 = 1.823 × 10 5 J mol −1; rojo
Q6.1.8
Cuando los iones rubidio se calientan a una temperatura alta, se observan dos líneas en su espectro lineal a longitudes de onda (a) 7.9 × 10 −7 m y (b) 4.2 × 10 −7 m. ¿Cuáles son las frecuencias de las dos líneas? ¿Qué color vemos cuando calentamos un compuesto de rubidio?
Q6.1.9
El espectro de emisión de cesio contiene dos líneas cuyas frecuencias son (a) 3.45 × 10 14 Hz y (b) 6.53 × 10 14 Hz. ¿Cuáles son las longitudes de onda y energías por fotón de las dos líneas? ¿De qué color son las líneas?
S6.1.9
(a) λ = 8.69 × 10 −7 m; E = 2.29 × 10 −19 J; (b) λ = 4.59 × 10-7 m; E = 4.33 × 10 −19 J; El color de (a) es rojo; (b) es azul.
Q6.1.10
Los fotones de radiación infrarroja son responsables de gran parte del calor que sentimos al tomar nuestras manos ante un incendio. Estos fotones también calentarán otros objetos. Cuántos fotones infrarrojos con una longitud de onda de 1.5 × 10 −6 m deben ser absorbidos por el agua para calentar una taza de agua (175 g) de 25.0 °C a 40°
S6.1.10
1.) Primero debemos usar la ecuación: Q=MCδt ° para calcular la cantidad de Energía en Julios (J) para calentar 175g de H 2 O un total de 15° Celsius
- m = masa en gramos (g) → 175g
- C = Calor específico de H 2 O (l) →\(\dfrac {4.184 J}{g°C}\)
- ΔT ° = Diferencia de temperatura → 40 - 25 =15°
\[q = 175g\times \dfrac {4.184 J}{g°C}\times 15° C\]
q= 11.000 J
2.) Ahora necesitamos calcular la cantidad de energía en Julios (J) que contiene un Fotón con una longitud de onda de 1.5x10 -6 m. Usaremos las ecuaciones:
\(E = hν\)y\(ν=\dfrac{c}{λ}\) que puede ser manipulado algebraicamente en:\(E=\dfrac{hc}{λ}\)
- h = Constante de Planck →\(6.6262 \times10^{-34} Js\)
- c = Velocidad de la luz →\(2.998\times 10^{8}\; \dfrac {m}{s}\)
- λ = longitud de onda del fotón →\(1.5 \times10^{-6} m\)
\[= \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {1.5 \times 10^{−6}m \ } =1.3 \times 10^{-19} J\]
Esta es la energía en un fotón, así que ahora tenemos que ver cuántas veces 1.3x10 -19 J encaja en los 11,000 J de nuestro primer cálculo:
\[= \dfrac{11,000\;J} {1.3 \times 10^{−19}\; \dfrac {J}{photon} } =8.3\times 10^{22} photons\]
\[= 8.3\times 10^{22} photons\]
Q6.1.11
Uno de los dispositivos radiográficos utilizados en el consultorio de un odontólogo emite una radiografía de longitud de onda de 2.090 × 10 −11 m. ¿Cuál es la energía, en julios, y la frecuencia de esta radiografía?
S6.1.11
E = 9.502 × 10 −15 J; ν = 1.434 × 10 19 s −1
Q6.1.12
Los ojos de ciertos reptiles pasan una sola señal visual al cerebro cuando los receptores visuales son golpeados por fotones de una longitud de onda de 850 nm. Si se requiere una energía total de 3.15 × 10 −14 J para activar la señal, ¿cuál es el número mínimo de fotones que deben golpear al receptor?
S6.1.12
1.) Primero necesitamos convertir nanómetros a metros
850nm = 8.5 x 10 -7 m
2. Luego calcula Energía en Julios un fotón de esta longitud de onda (λ) produce:
\[(E=\dfrac{hc}{λ}) = \dfrac{(6.6262\times 10^{−34}\;Js) \ (2.998\times 10^{8}\; \dfrac {m}{s}) } {8.5 \times 10^{−7}m \ } = 2.3 \times 10^{-19} \dfrac {J}{photon}\]
3.) Entonces tenemos que averiguar cuántos de estos fotones se necesitarán para hacer tropezar la señal visual al cerebro:
\[ \begin{align} &= \dfrac{3.15\times 10^{-14}\;\cancel{J}} {2.3 \times 10^{−19}\; \dfrac {\cancel{J}}{photon} } \\[5pt] &=1.3\times 10^{5}\, photons \end{align}\]
Q6.1.13
La televisión en color RGB y las pantallas de computadora utilizan tubos de rayos catódicos que producen colores mezclando luz roja, verde y azul. Si miramos la pantalla con una lupa, podemos ver que los puntos individuales se encienden y apagan a medida que cambian los colores. Utilizando un espectro de luz visible, determinar la longitud de onda aproximada de cada uno de estos colores. ¿Cuál es la frecuencia y energía de un fotón de cada uno de estos colores?
S6.1.13
- Rojo: 660 nm; 4.54 × 10 14 Hz; 3.01 × 10 −19 J.
- Verde: 520 nm; 5.77 × 10 14 Hz; 3.82 × 10 −19 J.
- Azul: 440 nm; 6.81 × 10 14 Hz; 4.51 × 10 −19 J.
También son posibles números algo diferentes.
Q6.1.14
Responde las siguientes preguntas sobre un láser Blu-ray:
- El láser en un reproductor de Blu-ray tiene una longitud de onda de 405 nm. ¿En qué región del espectro electromagnético se encuentra esta radiación? ¿Cuál es su frecuencia?
- Un láser Blu-ray tiene una potencia de 5 milivatios (1 vatio = 1 J s −1). ¿Cuántos fotones de luz produce el láser en 1 hora?
- La resolución ideal de un reproductor que utiliza un láser (como un reproductor Blu-ray), que determina qué tan cerca se pueden almacenar los datos en un disco compacto, se determina usando la siguiente fórmula: Resolución = 0.60 (λ /NA), donde λ es la longitud de onda del láser y NA es la numérica apertura. La apertura numérica es una medida del tamaño del punto de luz en el disco; cuanto mayor es la NA, menor es la mancha. En un sistema típico de Blu-ray, NA = 0.95. Si el láser de 405 nm se usa en un reproductor Blu-ray, ¿qué es lo más cercano que se puede almacenar la información en un disco Blu-ray?
- La densidad de datos de un disco Blu-ray usando un láser de 405 nm es de 1.5 × 10 7 bits mm −2. Los discos tienen un diámetro exterior de 120 mm y un orificio de 15 mm de diámetro. ¿Cuántos bits de datos se pueden contener en el disco? Si un disco Blu-ray puede contener 9.400.000 páginas de texto, ¿cuántos bits de datos se necesitan para una página mecanografiada? (Pista: Determine el área del disco que está disponible para contener datos. El área dentro de un círculo viene dada por A = πr 2, donde el radio r es la mitad del diámetro.)
Q6.1.15
¿Cuál es la frecuencia umbral para el metal de sodio si un fotón con frecuencia 6.66 × 10 14 s −1 expulsa un fotón con 7.74 × 10 −20 J de energía cinética? ¿Se observará el efecto fotoeléctrico si el sodio se expone a la luz naranja?
S6.1.15
5.49 × 10 14 s −1; no
6.2: El modelo Bohr
Q6.2.1
¿Por qué el electrón en un átomo de hidrógeno de Bohr está unido menos fuertemente cuando tiene un número cuántico de 3 que cuando tiene un número cuántico de 1?
Q6.2.2
¿Qué significa decir que se cuantifica la energía de los electrones en un átomo?
S6.2.2
Energía cuantificada significa que los electrones solo pueden poseer ciertos valores discretos de energía; no se permiten valores entre esos valores cuantificados.
Q6.2.3
Utilizando el modelo de Bohr, se determina la energía, en julios, necesaria para ionizar un átomo de hidrógeno en estado fundamental. Muestra tus cálculos.
Q6.2.4
El electrón voltio (eV) es una unidad conveniente de energía para expresar energías de escala atómica. Es la cantidad de energía que gana un electrón cuando se somete a un potencial de 1 voltio;\(1 \;eV = 1.602 \times 10^{-19}\; J\). Utilizando el modelo Bohr, determinar la energía, en electrón-voltios, del fotón producido cuando un electrón en un átomo de hidrógeno se mueve de la órbita con\(n = 5\) a la órbita con\(n = 2\). Muestra tus cálculos.
S6.2.4
\[E=E_2−E_5=2.179 \times 10^{−18} \left (\dfrac{1}{n_2^2}−\dfrac{1}{n^2_5}\right) \; J\]
\[ = 2.179 \times 10^{-18} \left (\dfrac{1}{2^2}−\dfrac{1}{5^2}\right)=4.576 \times 10^{−19}\; J\]
\[= \dfrac{4.576\times 10^{−19}\;J} {1.602 \times 10^{−19}\;J \; eV^{−1} } =2.856\; eV\]
Q6.2.5
Usando el modelo Bohr, determinar la energía más baja posible para el electrón en el\(He^+\) ion.
Q6.2.6
Utilizando el modelo de Bohr, determinar la energía de un electrón con\(n = 6\) un átomo de hidrógeno.
S6.2.6
−8.716 × 10−18 J
Q6.2.7
Utilizando el modelo de Bohr, determinar la energía de un electrón con\(n = 8\) un átomo de hidrógeno.
Q6.2.8
¿Qué tan lejos del núcleo en angstroms (1 angstrom =\(1 \times 10^{–10}\; \ce m\)) está el electrón en un átomo de hidrógeno si tiene una energía de\(-8.72 \times 10^{-20}\; \ce J\)?
S6.2.8
\(−3.405 \times 10^{−20} J\)
Q6.2.9
¿Cuál es el radio, en angstroms, del orbital de un electrón con n = 8 en un átomo de hidrógeno?
Q6.2.10
Utilizando el modelo Bohr, determinar la energía en julios del fotón producido cuando un electrón en un\(\ce{He^{+}}\) ion se mueve de la órbita con n = 5 a la órbita con n = 2.
Q6.2.11
Utilizando el modelo Bohr, determinar la energía en julios del fotón producido cuando un electrón en un ion Li2+ se mueve de la órbita con n = 2 a la órbita con n = 1.
S6.2.11
1.471 × 10−17 J
Q6.2.12
Considere un gran número de átomos de hidrógeno con electrones distribuidos aleatoriamente en las órbitas n = 1, 2, 3 y 4
- ¿Cuántas longitudes de onda diferentes de luz son emitidas por estos átomos a medida que los electrones caen en orbitales de menor energía?
- Calcular las energías más bajas y altas de luz producidas por las transiciones descritas en la parte (a).
- Calcular las frecuencias y longitudes de onda de la luz producida por las transiciones descritas en la parte (b).
Q6.2.13
¿Cómo son similares el modelo Bohr y el modelo Rutherford del átomo? ¿En qué se diferencian?
Q6.2.14
Los espectros de hidrógeno y de calcio se muestran en [link]. ¿Qué causa las líneas en estos espectros? ¿Por qué son diferentes los colores de las líneas? Sugerir una razón para la observación de que el espectro de calcio es más complicado que el espectro de hidrógeno
S6.2.14
Ambos involucran un núcleo relativamente pesado con electrones moviéndose a su alrededor, aunque estrictamente hablando, el modelo Bohr funciona solo para átomos o iones de un electrón. Según la mecánica clásica, el modelo de Rutherford predice un “sistema solar” en miniatura con electrones moviéndose alrededor del núcleo en órbitas circulares o elípticas que están confinadas a planos. Si se ignoran los requisitos de la teoría electromagnética clásica de que los electrones en tales órbitas emitirían radiación electromagnética, dichos átomos serían estables, teniendo energía constante y momento angular, pero no emitirían ninguna luz visible (contrario a la observación). Si se aplica la teoría electromagnética clásica, entonces el átomo de Rutherford emitiría radiación electromagnética de frecuencia continuamente creciente (contrario a los espectros discretos observados), perdiendo así energía hasta que el átomo colapsó en un tiempo absurdamente corto (contrario a la estabilidad observada a largo plazo de átomos). El modelo de Bohr conserva la vista mecánica clásica de órbitas circulares confinadas a planos que tienen energía constante e impulso angular, pero los restringe a valores cuantificados dependientes de un solo número cuántico, n. Se supone que el electrón orbitante en el modelo de Bohr no emite ninguna radiación electromagnética mientras moviéndose alrededor del núcleo en sus órbitas estacionarias, pero el átomo puede emitir o absorber radiación electromagnética cuando el electrón cambia de una órbita a otra. Debido a las órbitas cuantificadas, tales “saltos cuánticos” producirán espectros discretos, de acuerdo con las observaciones.
6.3: Desarrollo de la Teoría Cuántica
Q6.3.1
¿Cómo son similares el modelo Bohr y el modelo mecánico cuántico del átomo de hidrógeno? ¿En qué se diferencian?
S6.3.1
Ambos modelos tienen un núcleo central cargado positivamente con electrones moviéndose alrededor del núcleo de acuerdo con el potencial electrostático de Coulomb. El modelo de Bohr asume que los electrones se mueven en órbitas circulares que tienen energías cuantificadas, momento angular y radios que se especifican por un solo número cuántico, n = 1, 2, 3,..., pero esta cuantificación es una suposición ad hoc hecha por Bohr para incorporar la cuantificación en un esencialmente mecánica clásica descripción del átomo. Bohr también asumió que los electrones que orbitan el núcleo normalmente no emiten ni absorben radiación electromagnética, pero lo hacen cuando el electrón cambia a una órbita diferente. En el modelo mecánico cuántico, los electrones no se mueven en órbitas precisas (tales órbitas violan el principio de incertidumbre de Heisenberg) y, en cambio, se utiliza una interpretación probabilística de la posición del electrón en cualquier instante dado, con una función matemática ψ llamada función de onda que puede ser utilizado para determinar la distribución de probabilidad espacial del electrón. Estas funciones de onda, u orbitales, son ondas estacionarias tridimensionales que pueden especificarse mediante tres números cuánticos que surgen naturalmente de sus matemáticas subyacentes (no se requieren supuestos ad hoc): el número cuántico principal, n (el mismo utilizado por Bohr), que especifica conchas tales que los orbitales que tienen la misma n tienen todos la misma energía y aproximadamente la misma extensión espacial; el número cuántico de momento angular l, que es una medida del momento angular del orbital y corresponde a las formas generales de las orbitales, además de especificar subconchas de tal manera que los orbitales que tienen la misma l (y n) tienen todos la misma energía; y el número cuántico de orientación m, que es una medida de la componente z del momento angular y corresponde a las orientaciones de los orbitales. El modelo Bohr da la misma expresión para la energía que la expresión mecánica cuántica y, por lo tanto, ambos dan cuenta adecuadamente del espectro discreto del hidrógeno (un ejemplo de obtener las respuestas correctas por razones equivocadas, algo con lo que muchos estudiantes de química pueden simpatizar), pero da el error expresión para el momento angular (las órbitas de Bohr necesariamente tienen un momento angular distinto de cero, pero algunos orbitales cuánticos [s orbitales] pueden tener un momento angular cero).
Q6.3.2
¿Cuáles son los valores permitidos para cada uno de los cuatro números cuánticos: n, l, m l y m s?
Q6.3.3
Describir las propiedades de un electrón asociadas a cada uno de los siguientes cuatro números cuánticos: n, l, m l y m s.
S6.3.3
n determina el rango general para el valor de la energía y las distancias probables que el electrón puede ser desde el núcleo. l determina la forma de la órbita. m l determina la orientación de los orbitales del mismo valor l uno con respecto al otro. m s determina el espín de un electrón.
Q6.3.4
Responde las siguientes preguntas:
- Sin usar números cuánticos, describa las diferencias entre las conchas, subconchas y orbitales de un átomo.
- ¿En qué se diferencian los números cuánticos de las conchas, subconchas y orbitales de un átomo?
Q6.3.5
Identificar la subcapa en la que se encuentran los electrones con los siguientes números cuánticos:
- n = 2, l = 1
- n = 4, l = 2
- n = 6, l = 0
S6.3.5
a) 2 p; b) 4 d; c) 6 s
Q6.3.6
¿Cuáles de las subconchas descritas en la Pregunta 5 contienen orbitales degenerados? ¿Cuántos orbitales degenerados hay en cada uno?
Q6.3.7
Identificar la subcapa en la que se encuentran los electrones con los siguientes números cuánticos:
- n = 3, l = 2
- n = 1, l = 0
- n = 4, l = 3
S6.3.7
a) 3 d; b) 1 s; c) 4 f
Q6.3.8
¿Cuáles de las subconchas descritas en la Pregunta 7 contienen orbitales degenerados? ¿Cuántos orbitales degenerados hay en cada uno?
Q6.3.9
Dibuje la superficie límite de las orbitales a\(d_{x^2−y^2}\) y p y. Asegúrese de mostrar y etiquetar los ejes.
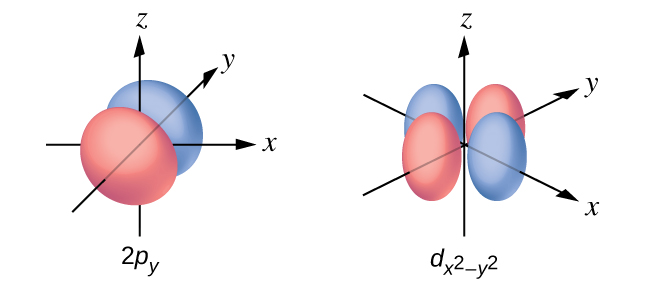
Q6.3.10
Esbozar los orbitales p x y d xz. Asegúrese de mostrar y etiquetar las coordenadas.
Q6.3.11
Considera los orbitales que aquí se muestran en bosquejo.
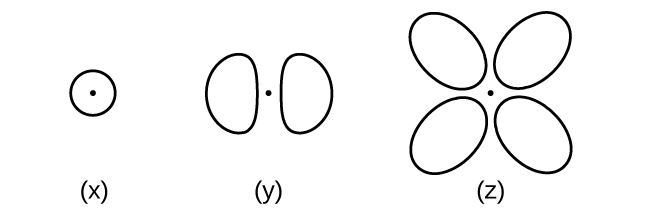
- ¿Cuál es el número máximo de electrones contenidos en un orbital de tipo (x)? De tipo (y)? De tipo (z)?
- ¿Cuántos orbitales de tipo (x) se encuentran en un caparazón con n = 2? ¿Cuántos de tipo (y)? ¿Cuántos de tipo (z)?
- Escribe un conjunto de números cuánticos para un electrón en un orbital de tipo (x) en una concha con n = 4. De un orbital de tipo (y) en una concha con n = 2. De un orbital de tipo (z) en una concha con n = 3.
- ¿Cuál es el valor n más pequeño posible para una órbita de tipo (x)? De tipo (y)? De tipo (z)?
- ¿Cuáles son los posibles valores l y m l para una órbita de tipo (x)? De tipo (y)? De tipo (z)?
S6.3.11
(a) x. 2, y. 2, z. 2; (b) x. 1, y. 3, z. 0; (c) x. 4 0 0\(\dfrac{1}{2}\), y. 2 1 0 \(\dfrac{1}{2}\), z. 3 2 0 \(\dfrac{1}{2}\); (d) x. 1, y. 2, z. 3; (e) x. l = 0, ml = 0, y. l = 1, ml = –1, 0, or +1, z. l = 2, ml = –2, –1, 0, +1, +2
Q6.3.12
State the Heisenberg uncertainty principle. Describe briefly what the principle implies.
Q6.3.13
How many electrons could be held in the second shell of an atom if the spin quantum number ms could have three values instead of just two? (Hint: Consider the Pauli exclusion principle.)
S6.3.13
12
Q6.3.14
Which of the following equations describe particle-like behavior? Which describe wavelike behavior? Do any involve both types of behavior? Describe the reasons for your choices.
- \(c = λν\)
- \(E=\dfrac{mν^2}{2}\)
- \(r=\dfrac{n^2a_0}{Z}\)
- \(E = hν\)
- \(λ=\dfrac{h}{mν}\)
Q6.3.15
Write a set of quantum numbers for each of the electrons with an n of 4 in a Se atom.
S6.3.15
| n | l | ml | s |
|---|---|---|---|
| 4 | 0 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 0 | 0 | \(−\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | 0 | \(+\dfrac{1}{2}\) |
| 4 | 1 | +1 | \(+\dfrac{1}{2}\) |
| 4 | 1 | −1 | \(−\dfrac{1}{2}\) |
6.4: Electronic Structure of Atoms (Electron Configurations)
Q6.4.1
Read the labels of several commercial products and identify monatomic ions of at least four transition elements contained in the products. Write the complete electron configurations of these cations.
Q6.4.2
Read the labels of several commercial products and identify monatomic ions of at least six main group elements contained in the products. Write the complete electron configurations of these cations and anions.
S6.4.2
For example, Na+: 1s22s22p6; Ca2+: 1s22s22p6; Sn2+: 1s22s22p63s23p63d104s24p64d105s2; F–: 1s22s22p6; O2–: 1s22s22p6; Cl–: 1s22s22p63s23p6.
Q6.4.3
Using complete subshell notation (not abbreviations, 1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- C
- P
- V
- Sb
- Sm
S6.4.3
a.) 1s22s22p2
b.) 1s22s22p63s23p3
c.) 1s22s22p63s23p63d34s2
d.) 1s22s22p63s23p63d104s24p64d105s25p3
e.) 1s22s22p63s23p63d104s24p64d104f65s25p66s2
Q6.4.4
Using complete subshell notation (1s22s22p6, and so forth), predict the electron configuration of each of the following atoms:
- N
- Si
- Fe
- Te
- Tb
S6.4.4
- 1s22s22p3;
- 1s22s22p63s23p2;
- 1s22s22p63s23p64s23d6;
- 1s22s22p63s23p64s23d104p65s24d105p4;
- 1s22s22p63s23p64s23d104p65s24d105p66s24f9
Q6.4.5
Is 1s22s22p6 the symbol for a macroscopic property or a microscopic property of an element? Explain your answer.
Q6.4.6
What additional information do we need to answer the question “Which ion has the electron configuration 1s22s22p63s23p6”?
S6.4.6
The charge on the ion.
Q6.4.7
Draw the orbital diagram for the valence shell of each of the following atoms:
- C
- P
- V
- Sb
- Ru
Q6.4.8
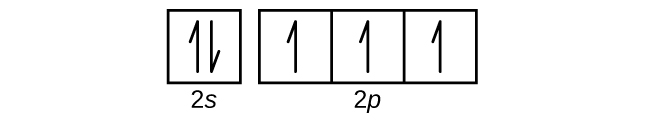
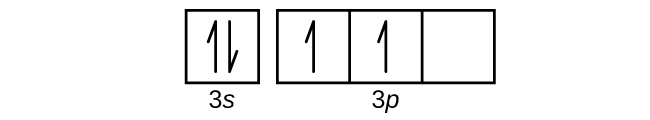
Use an orbital diagram to describe the electron configuration of the valence shell of each of the following atoms:
- N
- Si
- Fe
- Te
- Mo
S6.4.8
(a)
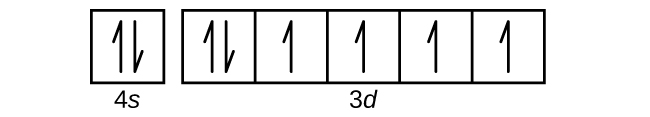
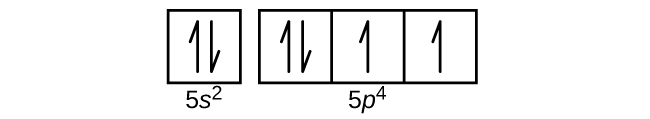

Q6.4.9
Usando notación completa de subshell (1 s 2 2 s 2 2 p 6, y así sucesivamente), predecir las configuraciones de electrones de los siguientes iones.
- N 3—
- Ca 2+
- S —
- Cs 2+
- Cr 2+
- Gd 3+
Q6.4.10
Qué átomo tiene la configuración electrónica: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 2?
S6.4.10
Zr
Q6.4.11
¿Qué átomo tiene la configuración electrónica: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 7 4 s 2?
S6.4.11
Co; Cobalto
Q6.4.12
Que ion con una carga +1 tiene la configuración electrónica 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ? ¿Qué ion con una carga —2 tiene esta configuración?
S6.4.12
Rb +, Se 2−
Q6.4.13
¿Cuál de los siguientes átomos contiene sólo tres electrones de valencia: Li, B, N, F, Ne?
S6.4.13
B; Boro
Q6.4.14
¿Cuál de los siguientes tiene dos electrones desapareados?
- Mg
- Si
- S
- Tanto Mg como S
- Tanto Si como S.
S6.4.14
Si bien tanto (b) como (c) son correctos, (e) abarca ambos y es la mejor respuesta.
Q6.4.15
¿Qué átomo se esperaría que tuviera una subcapa de 6 p medio llena?
S6.4.15
Bi; Bismuto
Q6.4.16
¿Qué átomo se esperaría que tuviera una subcapa de 4 s medio llena?
S6.4.16
K
Q6.4.17
En una zona de Australia, el ganado no prosperó a pesar de la presencia de forraje adecuado. Una investigación mostró que la causa fue la ausencia de suficiente cobalto en el suelo. El cobalto forma cationes en dos estados de oxidación, Co 2+ y Co 3+. Escribe la estructura electrónica de los dos cationes.
Q6.4.18
El talio se utilizó como veneno en la historia de misterio de Agatha Christie “El caballo pálido”. El talio tiene dos posibles formas catiónicas, +1 y +3. Los compuestos +1 son los más estables. Escribe la estructura electrónica del catión +1 del talio.
S6.4.18
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 6 6 s 2 4 f 14 5 d 10
Q6.4.19
Escriba las configuraciones de electrones para los siguientes átomos o iones:
- B 3+
- O —
- Cl 3+
- Ca 2+
- Ti
Q6.4.20
El cobalto—60 y el yodo—131 son isótopos radiactivos comúnmente utilizados en la medicina nuclear. ¿Cuántos protones, neutrones y electrones hay en los átomos de estos isótopos? Escriba la configuración completa de los electrones para cada isótopo.
S6.4.20
Co tiene 27 protones, 27 electrones y 33 neutrones: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 p 6 4 s 2 3 d 7.
I tiene 53 protones, 53 electrones y 78 neutrones: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 5.
Q6.4.21
Escribe un conjunto de números cuánticos para cada uno de los electrones con un n de 3 en un átomo de Sc.
6.5: Variaciones periódicas en las propiedades del elemento
Q6.5.1
Con base en sus posiciones en la tabla periódica, predicen cuál tiene el radio atómico más pequeño: Mg, Sr, Si, Cl, I.
S6.5.1
Cl
Q6.5.2
Con base en sus posiciones en la tabla periódica, predicen cuál tiene el mayor radio atómico: Li, Rb, N, F, I.
Q6.5.3
Con base en sus posiciones en la tabla periódica, predicen cuál tiene la mayor energía de primera ionización: Mg, Ba, B, O, Te.
S6.5.3
O
Q6.5.4
Con base en sus posiciones en la tabla periódica, predicen cuál tiene la menor energía de primera ionización: Li, Cs, N, F, I.
Q6.5.5
Con base en sus posiciones en la tabla periódica, clasifican los siguientes átomos en orden de aumentar la energía de la primera ionización: F, Li, N, Rb
S6.5.5
Rb < Li < N < F
Q6.5.6
Con base en sus posiciones en la tabla periódica, clasifican los siguientes átomos o compuestos en orden de aumentar la energía de la primera ionización: Mg, O, S, Si
Q6.5.7
Átomos de qué grupo en la tabla periódica tienen una configuración electrónica de concha de valencia de ns 2 np 3?
S6.5.7
15 (5A)
Q6.5.8
Átomos de qué grupo en la tabla periódica tienen una configuración electrónica de concha de valencia de ns 2?
Q6.5.9
Con base en sus posiciones en la tabla periódica, enumere los siguientes átomos en orden de radio creciente: Mg, Ca, Rb, Cs.
S6.5.9
Mg < Ca < Rb < Cs
Q6.5.10
Con base en sus posiciones en la tabla periódica, enumere los siguientes átomos en orden de radio creciente: Sr, Ca, Si, Cl.
Q6.5.11
Con base en sus posiciones en la tabla periódica, enumere los siguientes iones en orden de radio creciente: K +, Ca 2+, Al 3+, Si 4+.
S6.5.11
Si 4+ < Al 3+ < Ca 2+ < K +
Q6.5.12
Enumere los siguientes iones en orden de radio creciente: Li +, Mg 2+, Br —, Te 2—.
Q6.5.13
¿Qué átomo y/o ion es (son) isoelectrónicos con Br +: Se 2+, Se, As —, Kr, Ga 3+, Cl —?
S6.5.13
Se, As -
Q6.5.14
¿Cuál de los siguientes átomos e iones es (son) isoelectrónicos con S 2+: Si 4+, Cl 3+, Ar, As 3+, Si, Al 3+?
Q6.5.15
Compare tanto los números de protones como electrones presentes en cada uno para clasificar los siguientes iones en orden de radio creciente: As 3—, Br —, K +, Mg 2+.
S6.5.15
Mg 2+ < K + < Br — < As 3—
Q6.5.16
De los cinco elementos Al, Cl, I, Na, Rb, ¿cuál tiene la reacción más exotérmica? (E representa un átomo.) ¿Qué nombre se le da a la energía para la reacción? Consejo: tenga en cuenta que el proceso representado no corresponde a la afinidad de electrones
\(\ce{E+}(g)+\ce{e-}⟶\ce{E}(g)\)
Q6.5.17
Of the five elements Sn, Si, Sb, O, Te, which has the most endothermic reaction? (E represents an atom.) What name is given to the energy for the reaction?
\[\ce{E}(g)⟶\ce{E+}(g)+\ce{e-}\]
S6.5.17
O, IE1
Q6.5.18
The ionic radii of the ions S2–, Cl–, and K+ are 184, 181, 138 pm respectively. Explain why these ions have different sizes even though they contain the same number of electrons.
Q6.5.19
Which main group atom would be expected to have the lowest second ionization energy?
S6.5.19
Ra
Q6.5.20
Explain why Al is a member of group 13 rather than group 3?


