10.E: Líquidos y Sólidos (Ejercicios)
- Page ID
- 75272
10.1: Fuerzas intermoleculares
Q10.1.1
En cuanto a sus propiedades a granel, ¿en qué se diferencian los líquidos y los sólidos? ¿Cómo son similares?
S10.1.1
Los líquidos y sólidos son similares en que son materia compuesta por átomos, iones o moléculas. Son incompresibles y tienen densidades similares que son a la vez mucho mayores que las de los gases. Son diferentes en que los líquidos no tienen forma fija, y los sólidos son rígidos.
Q10.1.2
En términos de la teoría molecular cinética, ¿de qué manera los líquidos son similares a los sólidos? ¿De qué manera se diferencian los líquidos de los sólidos?
Q10.1.3
En términos de la teoría molecular cinética, ¿de qué manera los líquidos son similares a los gases? ¿De qué manera se diferencian los líquidos de los gases?
S10.1.3
Son similares en que los átomos o moléculas son libres de moverse de una posición a otra. Se diferencian en que las partículas de un líquido están confinadas a la forma del recipiente en el que se colocan. En contraste, un gas se expandirá sin límite para llenar el espacio en el que se coloca.
Q10.1.4
Explique por qué los líquidos asumen la forma de cualquier recipiente en el que se vierten, mientras que los sólidos son rígidos y conservan su forma.
Q10.1.5
¿Cuál es la evidencia de que todos los átomos neutros y moléculas ejercen fuerzas atractivas entre sí?
S10.1.5
Todos los átomos y moléculas se condensarán en un líquido o sólido en el que las fuerzas de atracción excedan la energía cinética de las moléculas, a temperatura suficientemente baja.
Q10.1.6
Abra la Simulación PhET de Estados de la Materia para responder a las siguientes preguntas:
- Seleccione la pestaña Sólido, Líquido, Gas. Explore seleccionando diferentes sustancias, calentando y enfriando los sistemas y cambiando el estado. ¿Qué similitudes nota entre las cuatro sustancias para cada fase (sólida, líquida, gaseosa)? ¿Qué diferencias notas?
- Para cada sustancia, seleccione cada uno de los estados y registre las temperaturas dadas. ¿Cómo se correlacionan las temperaturas dadas para cada estado con las fortalezas de sus atractivos intermoleculares? Explique.
- Seleccione la pestaña Potencial de interacción y utilice los átomos de neón predeterminados. Mueve el átomo de Ne a la derecha y observa cómo cambia la energía potencial. Selecciona el botón Fuerza Total y mueve el átomo de Ne como antes. ¿Cuándo la fuerza total sobre cada átomo es atractiva y lo suficientemente grande como para importar? A continuación, selecciona el botón Fuerzas de componente y mueve el átomo de Ne. ¿Cuándo se equilibran las fuerzas atractivas (van der Waals) y repulsivas (solapamiento de electrones)? ¿Cómo se relaciona esto con el gráfico de energía potencial versus la distancia entre átomos? Explique.
Q10.1.7
Defina lo siguiente y dé un ejemplo de cada uno:
- fuerza de dispersión
- atracción dipolo-dipolo
- enlace de hidrógeno
S10.1.7
- Las fuerzas de dispersión ocurren cuando un átomo desarrolla un momento dipolar temporal cuando sus electrones se distribuyen asimétricamente alrededor del núcleo. Esta estructura es más prevalente en átomos grandes como el argón o el radón. Un segundo átomo puede entonces ser distorsionado por la aparición del dipolo en el primer átomo. Los electrones del segundo átomo son atraídos hacia el extremo positivo del primer átomo, lo que establece un dipolo en el segundo átomo. El resultado neto son dipolos temporales rápidamente fluctuantes que se atraen entre sí (ejemplo: Ar).
- Una atracción dipolo-dipolo es una fuerza que resulta de una atracción electrostática del extremo positivo de una molécula polar para el extremo negativo de otra molécula polar (ejemplo: las moléculas ICI se atraen entre sí por interacción dipolo-dipolo).
- Los enlaces de hidrógeno se forman siempre que un átomo de hidrógeno está unido a uno de los átomos más electronegativos, como un átomo de flúor, oxígeno, nitrógeno o cloro. La atracción electrostática entre el átomo de hidrógeno parcialmente positivo en una molécula y el átomo parcialmente negativo en otra molécula da lugar a una fuerte interacción dipolo-dipolo llamada enlace de hidrógeno (ejemplo:\(\mathrm{HF⋯HF}\)).
Q10.1.8
Los tipos de fuerzas intermoleculares en una sustancia son idénticos ya sea un sólido, un líquido o un gas. ¿Por qué entonces una sustancia cambia de fase de un gas a un líquido o a un sólido?
Q10.1.9
¿Por qué aumentan los puntos de ebullición de los gases nobles en el orden He < Ne < Ar < Kr < Xe?
S10.1.9
Las fuerzas de Londres suelen aumentar a medida que aumenta el número de electrones.
Q10.1.10
Neón y HF tienen aproximadamente las mismas masas moleculares.
- Explica por qué difieren los puntos de ebullición de Neón y HF.
- Comparar el cambio en los puntos de ebullición de Ne, Ar, Kr y Xe con el cambio de los puntos de ebullición de HF, HCl, HBr e HI, y explicar la diferencia entre los cambios con el aumento de la masa atómica o molecular.
Q10.1.11
Organice cada uno de los siguientes conjuntos de compuestos en orden de aumentar la temperatura del punto de ebullición:
- HCl, H 2 O, SiH 4
- F 2, Cl 2, Br 2
- CH 4, C 2 H 6, C 3 H 8
- O 2, NO, N 2
S10.1.11
(a) SiH 4 < HCl < H 2 O; (b) F 2 < Cl 2 < Br 2; (c) CH 4 < C 2 H 6 < C 3 H 8; (d) N 2 < O 2 < NO
Q10.1.12
La masa molecular del butanol, C 4 H 9 OH, es 74.14; la del etilenglicol, CH 2 (OH) CH 2 OH, es 62.08, sin embargo sus puntos de ebullición son 117.2 °C y 174 °C, respectivamente. Explique el motivo de la diferencia.
Q10.1.13
Sobre la base de las atracciones intermoleculares, explicar las diferencias en los puntos de ebullición de n-butano (−1 °C) y cloroetano (12 °C), los cuales tienen masas molares similares.
S10.1.13
Solo las interacciones dipolo-dipolo bastante pequeñas de los enlaces C-H están disponibles para mantener n-butano en estado líquido. El cloroetano, sin embargo, tiene interacciones dipolares bastante grandes debido al enlace Cl-C; por lo tanto, la interacción es más fuerte, lo que lleva a un punto de ebullición más alto.
Q10.1.14
A partir de momentos dipolares y/o enlaces de hidrógeno, explicar de manera cualitativa las diferencias en los puntos de ebullición de acetona (56.2 °C) y 1-propanol (97.4 °C), que tienen masas molares similares.
Q10.1.15
El punto de fusión de H 2 O (s) es 0 °C. ¿Esperaría que el punto de fusión de H 2 S (s) sea −85 °C, 0 °C o 185 °C? Explica tu respuesta.
S10.1.15
−85 °C. El agua tiene enlaces de hidrógeno más fuertes por lo que se funde a una temperatura más alta.
Q10.1.16
El silano (SiH 4), la fosfina (PH 3) y el sulfuro de hidrógeno (H 2 S) funden a −185 °C, −133 °C y −85 °C, respectivamente. ¿Qué sugiere esto sobre el carácter polar y los atractivos intermoleculares de los tres compuestos?
Q10.1.17
Explique por qué un enlace de hidrógeno entre dos moléculas de agua es más débil que un enlace de hidrógeno entre dos moléculas de fluoruro de hidrógeno.
S10.1.17
El enlace de hidrógeno entre dos moléculas de fluoruro de hidrógeno es más fuerte que el de dos moléculas de agua porque la electronegatividad de F es mayor que la de O. En consecuencia, la carga negativa parcial en F es mayor que la de O. El enlace de hidrógeno entre el H parcialmente positivo y el mayor F parcialmente negativo será más fuerte que el formado entre H y O.
Q10.1.18
Bajo ciertas condiciones, las moléculas de ácido acético, CH 3 COOH, forman “dímeros”, pares de moléculas de ácido acético unidas por fuertes atracciones intermoleculares:

Dibujar un dímero de ácido acético, mostrando cómo se mantienen unidas dos moléculas de CH 3 COOH, e indicando el tipo de IMF que es responsable.
Q10.1.19
Las proteínas son cadenas de aminoácidos que se pueden formar en una variedad de arreglos, uno de los cuales es una hélice. ¿Qué tipo de FMI se encarga de mantener la cadena proteica en esta forma? En la imagen de la proteína, muestra las ubicaciones de los IMF que mantienen unida la proteína:

S10.1.19
La unión H es el principio IMF que mantiene unidas las hebras de ADN. La unión en H se encuentra entre\(\mathrm{N−H}\) and \(\mathrm{C=O}\).
Q10.1.20
The density of liquid NH3 is 0.64 g/mL; the density of gaseous NH3 at STP is 0.0007 g/mL. Explain the difference between the densities of these two phases.
Q10.1.21
Identify the intermolecular forces present in the following solids:
- CH3CH2OH
- CH3CH2CH3
- CH3CH2Cl
S10.1.21
(a) hydrogen bonding and dispersion forces; (b) dispersion forces; (c) dipole-dipole attraction and dispersion forces
10.2: Properties of Liquids
Q10.2.1
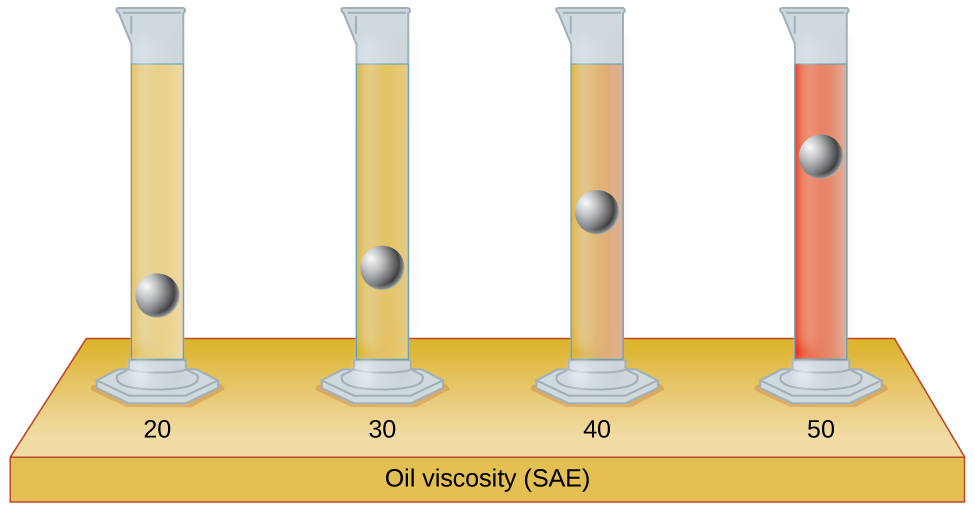
The test tubes shown here contain equal amounts of the specified motor oils. Identical metal spheres were dropped at the same time into each of the tubes, and a brief moment later, the spheres had fallen to the heights indicated in the illustration. Rank the motor oils in order of increasing viscosity, and explain your reasoning:
Q10.2.2
Aunque el acero es más denso que el agua, se puede hacer flotar una aguja de acero o un clip para papel colocado cuidadosamente a lo largo de la superficie del agua sin gas. Explique a nivel molecular cómo esto es posible:

(crédito: Cory Zanker)
S10.2.2
Las moléculas de agua tienen fuertes fuerzas intermoleculares de enlaces de hidrógeno. Las moléculas de agua son así fuertemente atraídas entre sí y exhiben una tensión superficial relativamente grande, formando un tipo de “piel” en su superficie. Esta piel puede soportar un insecto o un clip de papel si se coloca suavemente en el agua.
Q10.2.3
Aquí se muestran los valores de tensión superficial y viscosidad para éter dietílico, acetona, etanol y etilenglicol.
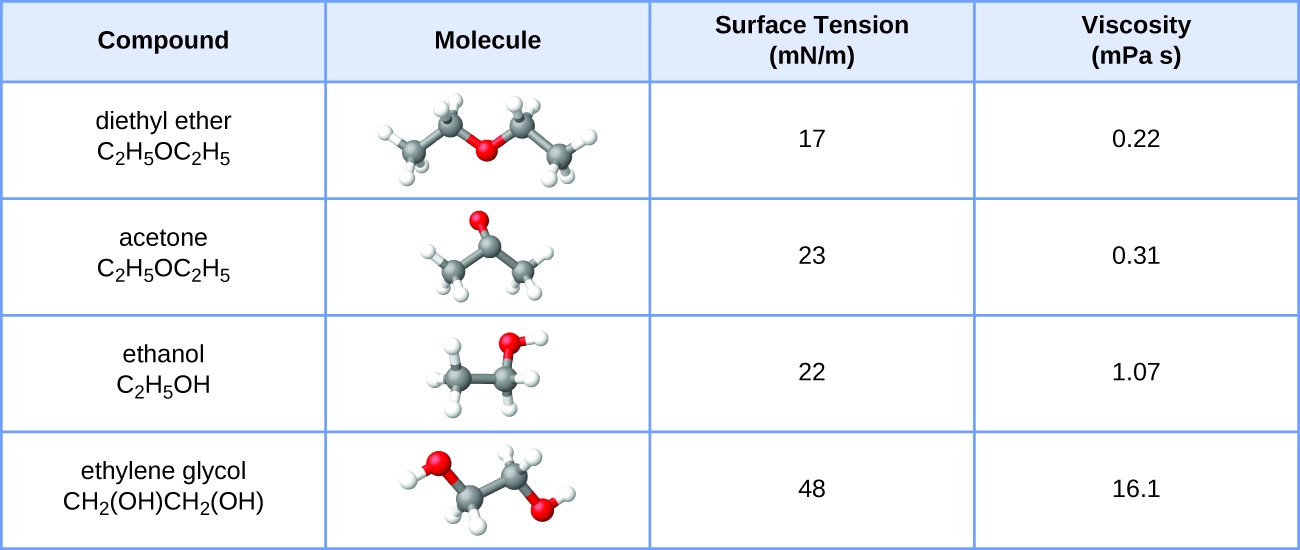
- Explicar sus diferencias de viscosidad en cuanto al tamaño y forma de sus moléculas y sus IMF.
- Explicar sus diferencias en la tensión superficial en términos del tamaño y forma de sus moléculas y sus IMF:
Q10.2.4
Es posible que hayas escuchado a alguien usar la figura del habla “más lenta que la melaza en invierno” para describir un proceso que ocurre lentamente. Explique por qué se trata de un modismo apto, utilizando conceptos de tamaño y forma molecular, interacciones moleculares y el efecto del cambio de temperatura.
S10.2.4
La temperatura tiene un efecto sobre las fuerzas intermoleculares: cuanto mayor es la temperatura, mayores son las energías cinéticas de las moléculas y mayor es el grado en que se superan sus fuerzas intermoleculares, y así cuanto más fluido (menos viscoso) es el líquido; cuanto menor es la temperatura, menor es la intermolecular se superan las fuerzas, y así cuanto menos viscoso es el líquido.
Q10.2.5
A menudo se recomienda dejar que el motor de su automóvil funcione inactivo para calentarse antes de conducir, especialmente en los fríos días de invierno. Si bien el beneficio del ralentí prolongado es dudoso, ciertamente es cierto que un motor caliente es más eficiente en combustible que uno frío. Explique el motivo de esto.
Q10.2.6
La tensión superficial y la viscosidad del agua a varias temperaturas diferentes se dan en esta tabla.
| Agua | Tensión superficial (mN/m) | Viscosidad (mPa s) |
|---|---|---|
| 0 °C | 75.6 | 1.79 |
| 20 °C | 72.8 | 1.00 |
| 60 °C | 66.2 | 0.47 |
| 100 °C | 58.9 | 0.28 |
- A medida que aumenta la temperatura, ¿qué sucede con la tensión superficial del agua? Explique por qué ocurre esto, en términos de interacciones moleculares y el efecto del cambio de temperatura.
- A medida que aumenta la temperatura, ¿qué pasa con la viscosidad del agua? Explique por qué ocurre esto, en términos de interacciones moleculares y el efecto del cambio de temperatura.
S10.2.6
(a) A medida que el agua alcanza temperaturas más altas, el aumento de las energías cinéticas de sus moléculas es más eficaz para superar los enlaces de hidrógeno, por lo que disminuye su tensión superficial. La tensión superficial y las fuerzas intermoleculares están directamente relacionadas. b) Se observa la misma tendencia en viscosidad que en la tensión superficial, y por la misma razón.
Q10.2.7
A 25 °C, ¿qué tan alto subirá el agua en un tubo capilar de vidrio con un diámetro interno de 0.63 mm? Consulte Ejemplo para obtener la información requerida.
Q10.2.8
El agua sube en un tubo capilar de vidrio a una altura de 17 cm. ¿Cuál es el diámetro del tubo capilar?
S10.2.8
9.5 × 10 −5 m
10.3: Transiciones de fase
Q10.3.1
Se agrega calor al agua hirviendo. Explique por qué la temperatura del agua hirviendo no cambia. ¿Qué cambia?
Q10.3.2
Se agrega calor al hielo a 0 °C. Explique por qué la temperatura del hielo no cambia. ¿Qué cambia?
S10.3.2
El calor es absorbido por el hielo, proporcionando la energía requerida para superar parcialmente las fuerzas de atracción intermoleculares en el sólido y provocando una transición de fase al agua líquida. La solución permanece a 0 °C hasta que se funde todo el hielo. Sólo la cantidad de agua que existe como hielo cambia hasta que el hielo desaparece. Entonces la temperatura del agua puede subir.
Q10.3.3
¿Qué característica caracteriza el equilibrio dinámico entre un líquido y su vapor en un recipiente cerrado?
Q10.3.4
Identificar dos observaciones comunes que indican que algunos líquidos tienen presiones de vapor suficientes para evaporarse notablemente?
S10.3.4
Podemos ver disminuir la cantidad de líquido en un recipiente abierto y podemos oler el vapor de algunos líquidos.
Q10.3.5
Identificar dos observaciones comunes que indican que algunos sólidos, como el hielo seco y las bolas de naftalina, tienen presiones de vapor suficientes para sublimar?
Q10.3.6
¿Cuál es la relación entre las fuerzas intermoleculares en un líquido y su presión de vapor?
S10.3.7
La presión de vapor de un líquido disminuye a medida que aumenta la fuerza de sus fuerzas intermoleculares.
Q10.3.7
¿Cuál es la relación entre las fuerzas intermoleculares en un sólido y su temperatura de fusión?
Q10.3.8
¿Por qué la gasolina derramada se evapora más rápidamente en un día caluroso que en un día frío?
S10.3.8
A medida que aumenta la temperatura, aumenta la energía cinética promedio de las moléculas de gasolina y así una mayor fracción de moléculas tienen suficiente energía para escapar del líquido que a temperaturas más bajas.
Q10.3.9
El tetracloruro de carbono, CCl 4, alguna vez se utilizó como disolvente de limpieza en seco, pero ya no se usa porque es cancerígeno. A 57.8 °C, la presión de vapor de CCl 4 es 54.0 kPa, y su entalpía de vaporización es 33.05 kJ/mol. Utilice esta información para estimar el punto de ebullición normal para CCl 4.
Q10.3.10
¿Cuándo el punto de ebullición de un líquido es igual a su punto de ebullición normal?
S10.3.10
Cuando la presión del gas por encima del líquido es exactamente de 1 atm
Q10.3.11
¿En qué se diferencia la ebullición de un líquido de su evaporación?
Q10.3.12
Utilice la información de la Figura para estimar el punto de ebullición del agua en Denver cuando la presión atmosférica es de 83.3 kPa.
S10.3.12
aproximadamente 95 °C
Q10.3.13
Una jeringa a una temperatura de 20 °C se llena con éter líquido de tal manera que no hay espacio para ningún vapor. Si la temperatura se mantiene constante y se retira el émbolo para crear un volumen que pueda ser ocupado por el vapor, ¿cuál sería la presión aproximada del vapor producido?
Q10.3.14
Explique las siguientes observaciones:
- Se tarda más en cocinar un huevo en Ft. Davis, Texas (altitud, 5000 pies sobre el nivel del mar) que en Boston (a nivel del mar).
- La transpiración es un mecanismo para enfriar el cuerpo.
S10.3.14
a) A 5000 pies, la presión atmosférica es menor que a nivel del mar, por lo que el agua hervirá a menor temperatura. Esta temperatura más baja provocará que los cambios físicos y químicos involucrados en la cocción del huevo procedan más lentamente, y se requiere un tiempo más largo para cocinar completamente el huevo. (b) Mientras el aire que rodea el cuerpo contenga menos vapor de agua que el máximo que el aire pueda retener a esa temperatura, la transpiración se evaporará, enfriando así el cuerpo eliminando el calor de vaporización requerido para vaporizar el agua.
Q10.3.15
La entalpía de vaporización del agua es mayor que su entalpía de fusión. Explique por qué.
Q10.3.16
Explicar por qué las entalpías molares de vaporización de las siguientes sustancias aumentan en el orden CH 4 < C 2 H 6 < C 3 H 8, aunque las tres sustancias experimentan las mismas fuerzas de dispersión cuando están en estado líquido.
S10.3.16
Las fuerzas de dispersión aumentan con la masa molecular o el tamaño. A medida que aumenta el número de átomos que componen las moléculas en esta serie homóloga, también lo hace el grado de atracción intermolecular a través de las fuerzas de dispersión y, en consecuencia, la energía requerida para superar estas fuerzas y vaporizar los líquidos.
Q10.3.17
Explicar por qué las entalpías de vaporización de las siguientes sustancias aumentan en el orden CH 4 < NH 3 < H 2 O, a pesar de que las tres sustancias tienen aproximadamente la misma masa molar.
Q10.3.18
La entalpía de vaporización del CO 2 (l) es 9.8 kJ/mol. ¿Esperaría que la entalpía de vaporización de CS 2 (l) sea de 28 kJ/mol, 9.8 kJ/mol, o −8.4 kJ/mol? Discutir la verosimilitud de cada una de estas respuestas.
S10.3.18
El punto de ebullición de CS 2 es mayor que el del CO 2 parcialmente debido al mayor peso molecular de CS 2; en consecuencia, las fuerzas de atracción son más fuertes en CS 2. Se esperaría, por lo tanto, que el calor de vaporización fuera mayor al de 9.8 kJ/mol para el CO 2. Un valor de 28 kJ/mol parecería razonable. Un valor de −8.4 kJ/mol indicaría una liberación de energía tras la vaporización, lo cual es claramente inverosímil.
Q10.3.19
La molécula de fluoruro de hidrógeno, HF, es más polar que una molécula de agua, H 2 O (por ejemplo, tiene un mayor momento dipolar), sin embargo la entalpía molar de vaporización para el fluoruro de hidrógeno líquido es menor que la del agua. Explique.
Q10.3.20
Se utiliza cloruro de etilo (punto de ebullición, 13 °C) como anestésico local. Cuando el líquido se pulveriza sobre la piel, la enfría lo suficiente como para congelarla y adormecerla. Explicar el efecto refrescante del cloruro de etilo líquido.
S10.3.20
La energía térmica (calor) necesaria para evaporar el líquido se elimina de la piel.
Q10.3.21
¿Cuál contiene los compuestos enumerados correctamente en orden de aumento de los puntos de ebullición?
- N 2 < CS 2 < H 2 O < KCl
- H 2 O < N 2 < CS 2 < KCl
- N 2 < KCl < CS 2 < H 2 O
- CS 2 < N 2 < KCl < H 2 O
- KCl < H 2 O < CS 2 < N 2
Q10.3.22
¿Cuánto calor se requiere para convertir 422 g de líquido H 2 O a 23,5 °C en vapor a 150 °C?
S10.3.22
1130 kJ
Q10.3.22
La evaporación del sudor requiere energía y así eliminar el exceso de calor del cuerpo. Parte del agua que bebes puede eventualmente convertirse en sudor y evaporarse. Si bebes una botella de agua de 20 onzas que había estado en el refrigerador a 3.8 °C, ¿cuánto calor se necesita para convertir toda esa agua en sudor y luego en vapor? (Nota: Tu temperatura corporal es de 36.6 °C. Con el propósito de resolver este problema, supongamos que las propiedades térmicas del sudor son las mismas que para el agua.)
Q10.3.24
El tetracloruro de titanio, TiCl 4, tiene un punto de fusión de −23.2 °C y tiene una fusión Δ H = 9.37 kJ/mol.
- ¿Cuánta energía se requiere para fundir 263.1 g TiCl 4?
- Para TiCl 4, ¿cuál probablemente tendrá la mayor magnitud: Δ H fusión o Δ H vaporización? Explica tu razonamiento.
S10.3.24
a) 13.0 kJ; b) Es probable que el calor de vaporización tenga una magnitud mayor ya que en el caso de la vaporización las interacciones intermoleculares tienen que ser superadas por completo, mientras que el derretimiento debilita o destruye sólo algunas de ellas.
10.4: Diagramas de fases
Q10.4.1
A partir del diagrama de fases para el agua, determine el estado del agua en:
- 35 °C y 85 kPa
- −15 °C y 40 kPa
- −15 °C y 0.1 kPa
- 75 °C y 3 kPa
- 40 °C y 0.1 kPa
- 60 °C y 50 kPa
Q10.4.2
¿Qué cambios de fase se producirán cuando el agua se someta a presión variable a una temperatura constante de 0.005 °C? ¿A 40 °C? ¿A −40 °C?
S10.4.2
A bajas presiones y 0.005 °C, el agua es un gas. A medida que la presión aumenta a 4.6 torr, el agua se vuelve sólida; a medida que la presión aumenta aún más, se convierte en líquido. A 40 °C, el agua a baja presión es un vapor; a presiones superiores a aproximadamente 75 torr, se convierte en líquido. A -40 °C, el agua pasa de un gas a un sólido a medida que la presión aumenta por encima de valores muy bajos.
Q10.4.3
Las ollas a presión permiten que los alimentos se cocinen más rápido porque la mayor presión dentro de la olla a presión aumenta la temperatura de ebullición del agua. Una olla a presión en particular tiene una válvula de seguridad que se establece para ventilar el vapor si la presión supera los 3.4 atm. ¿Cuál es la temperatura máxima aproximada que se puede alcanzar dentro de esta olla a presión? Explica tu razonamiento.
Q10.4.4
A partir del diagrama de fases para el dióxido de carbono, determinar el estado de CO 2 en:
- 20 °C y 1000 kPa
- 10 °C y 2000 kPa
- 10 °C y 100 kPa
- −40 °C y 500 kPa
- −80 °C y 1500 kPa
- −80 °C y 10 kPa

Los ejes de presión y temperatura en este diagrama de fases del dióxido de carbono no se dibujan a escala constante para ilustrar varias propiedades importantes.
S10.4.4
a) líquido; b) sólido; c) gas; d) gas; e) gas; f) gas
Q10.4.5
¿Determinar los cambios de fase que experimenta el dióxido de carbono a medida que cambia la presión si la temperatura se mantiene a −50 °C? Si la temperatura se mantiene en −40 °C? ¿A 20 °C?

Los ejes de presión y temperatura en este diagrama de fases del dióxido de carbono no se dibujan a escala constante para ilustrar varias propiedades importantes.
Q10.4.6
Considere un cilindro que contenga una mezcla de dióxido de carbono líquido en equilibrio con dióxido de carbono gaseoso a una presión inicial de 65 atm y una temperatura de 20 °C. Dibuje una gráfica que represente el cambio en la presión del cilindro con el tiempo a medida que el dióxido de carbono gaseoso se libera a temperatura constante.
S10.4.6

Q10.4.7
El hielo seco, CO 2 (s), no se funde a presión atmosférica. Se sublima a una temperatura de −78 °C. ¿Cuál es la presión más baja a la que se fundirá CO 2 (s) para dar CO 2 (l)? ¿A aproximadamente qué temperatura ocurrirá esto? (Ver Figura para el diagrama de fases.)
S10.4.7
El hielo seco, CO 2 (s), se fundirá para dar CO 2 (l) a 5.11 atm a −56.6 °C, el punto triple del dióxido de carbono.
Q10.4.8
Si una tormenta severa resulta en la pérdida de electricidad, puede ser necesario usar un tendedero para secar la ropa. En muchas partes del país en pleno invierno, la ropa se congelará rápidamente cuando se cuelguen en la línea. Si no nieva, ¿se secarán de todos modos? Explica tu respuesta.
S10.4.8
Sí, el hielo se sublimará, aunque puede tardar varios días. El hielo tiene una pequeña presión de vapor, y algunas moléculas de hielo forman gas y escapan de los cristales de hielo. A medida que pasa el tiempo, cada vez más sólidos se convierten en gas hasta que finalmente la ropa se seca.
Q10.4.9
¿Es posible licuar nitrógeno a temperatura ambiente (aproximadamente 25 °C)? ¿Es posible licuar dióxido de azufre a temperatura ambiente? Explica tus respuestas.
Q10.4.10
El carbono elemental tiene una fase gaseosa, una fase líquida y tres fases sólidas diferentes, como se muestra en el diagrama de fases:
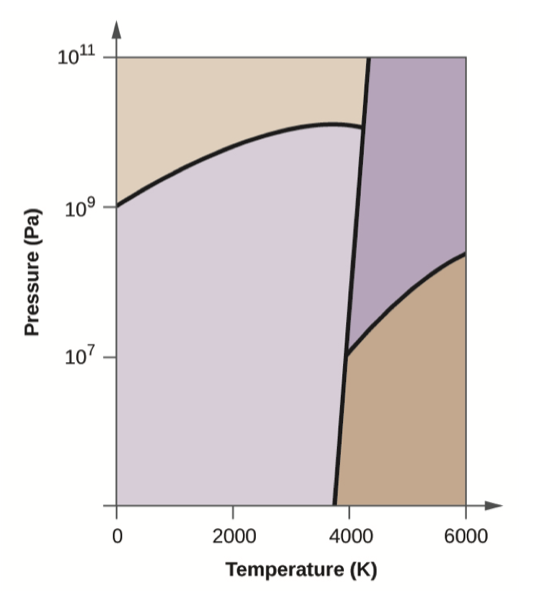
- En el diagrama de fases, etiquete las regiones de gas y líquido.
- El grafito es la fase más estable del carbono en condiciones normales. En el diagrama de fases, etiquetar la fase de grafito.
- Si el grafito en condiciones normales se calienta a 2500 K mientras que la presión se incrementa a 10 10 Pa, se convierte en diamante. Etiquete la fase de diamante.
- Circula cada punto triple en el diagrama de fases.
- ¿En qué fase existe el carbono a 5000 K y 10 8 Pa?
- Si la temperatura de una muestra de carbono aumenta de 3000 K a 5000 K a una presión constante de 10 6 Pa, ¿qué transición de fase se produce, en su caso?
10.5: El estado sólido de la materia
Q10.5.1
¿Qué tipos de líquidos suelen formar sólidos amorfos?
S10.5.1
Los sólidos amorfos carecen de una estructura interna ordenada. Los materiales líquidos que contienen moléculas grandes y engorrosas que no pueden moverse fácilmente a posiciones ordenadas generalmente forman dichos sólidos.
Q10.5.2
A temperaturas muy bajas el oxígeno, O 2, se congela y forma un sólido cristalino. ¿Cuál describe mejor estos cristales?
- iónico
- red covalente
- metálico
- amorfo
- cristales moleculares
S10.5.3
(e) cristales moleculares
Q10.5.4
A medida que se enfría, el aceite de oliva se solidifica lentamente y forma un sólido en un rango de temperaturas. ¿Cuál describe mejor al sólido?
- iónico
- red covalente
- metálico
- amorfo
- cristales moleculares
S10.5.4
(d) amorfo
Q10.5.5
Explique por qué el hielo, que es un sólido cristalino, tiene una temperatura de fusión de 0 °C, mientras que la mantequilla, que es un sólido amorfo, se ablanda en un rango de temperaturas.
S10.5.6
El hielo tiene una estructura cristalina estabilizada por enlaces de hidrógeno. Estas fuerzas intermoleculares son de fuerza comparable y por lo tanto requieren la misma cantidad de energía para superarlas. Como resultado, el hielo se funde a una sola temperatura y no a lo largo de un rango de temperaturas. Las diversas moléculas muy grandes que componen la mantequilla experimentan variadas atracciones de van der Waals de diversas fortalezas que se superan a diversas temperaturas, por lo que el proceso de fusión se produce en un amplio rango de temperaturas.
Q10.5.7
Identificar el tipo de sólido cristalino (metálico, covalente de red, iónico o molecular) formado por cada una de las siguientes sustancias:
- SiO 2
- KCl
- Cu
- CO 2
- C (diamante)
- BaSO 4
- NH 3
- NH 4 F
- C 2 H 5 OH
S10.5.7
(a) SiO 2, red covalente; (b) KCl, iónico; (c) Cu, metálico; (d) CO, molecular; (e) C (diamante), red covalente; (f) BasO 4, iónico; (g) NH 3, molecular; (h) NH 4 F, iónico; (i) C 2 H 5 OH, molecular
Q10.5.8
Identificar el tipo de sólido cristalino (metálico, covalente de red, iónico o molecular) formado por cada una de las siguientes sustancias:
- CaCl 2
- SiC
- N 2
- Fe
- C (grafito)
- CH 3 CH 2 CH 2 CH 3
- HCl
- NH 4 NO 3
- K 3 PO 4
S10.5.8
(a) CaCl 2, iónico; (b) SiC, red covalente; (c) N 2, molecular; (d) Fe, metálico; (e) C (grafito), red covalente; (f) CH 3 CH 2 CH 2 CH 3, molecular; (g) HCl, molecular; (h) NH 4 NO 3, iónico; (i) K 3 PO 4, iónico
Q10.5.9
Clasifique cada sustancia en la tabla como un sólido metálico, iónico, molecular o de red covalente:
| Sustancia | Apariencia | Punto de fusión | Conductividad eléctrica | Solubilidad en Agua |
|---|---|---|---|---|
| X | lustroso, maleable | 1500 °C | alto | insoluble |
| Y | suave, amarillo | 113 °C | ninguno | insoluble |
| Z | duro, blanco | 800 °C | solo si se fundió/disuelve | soluble |
S10.5.9
X = metálico; Y = red covalente; Z = iónico
Q10.5.10
Clasifique cada sustancia en la tabla como un sólido metálico, iónico, molecular o de red covalente:
| Sustancia | Apariencia | Punto de fusión | Conductividad eléctrica | Solubilidad en Agua |
|---|---|---|---|---|
| X | quebradizo, blanco | 800 °C | solo si se fundió/disuelve | soluble |
| Y | brillante, maleable | 1100 °C | alto | insoluble |
| Z | duro, incoloro | 3550 °C | ninguno | insoluble |
S10.5.10
X = iónico; Y = metálico; Z = red covalente
Q10.5.11
Identificar las siguientes sustancias como sólidos iónicos, metálicos, de red covalente o moleculares:
La sustancia A es maleable, dúctil, conduce bien la electricidad y tiene un punto de fusión de 1135 °C. La sustancia B es quebradiza, no conduce la electricidad como un sólido pero lo hace cuando se funde, y tiene un punto de fusión de 2072 °C. La sustancia C es muy dura, no conduce electricidad y tiene un punto de fusión de 3440 °C. La sustancia D es blanda, no conduce electricidad y tiene un punto de fusión de 185 °C.
S10.5.11
A = metálico; B = iónico; C = red covalente; D = molecular
Q10.5.12
La sustancia A es brillante, conduce bien la electricidad y se funde a 975 °C. La sustancia A es probablemente a (n):
- sólido iónico
- sólido metálico
- sólido molecular
- sólido de red covalente
S10.5.12
(b) sólido metálico
Q10.5.13
La sustancia B es dura, no conduce electricidad y se funde a 1200 °C. La sustancia B es probablemente a (n):
- sólido iónico
- sólido metálico
- sólido molecular
- sólido de red covalente
S10.5.13
(d) red covalente sólida
10.6: Estructuras de celosía
Q10.6.1
Describir la estructura cristalina del hierro, que cristaliza con dos átomos metálicos equivalentes en una celda unitaria cúbica.
S10.6.1
La estructura de esta forma de hierro a baja temperatura (por debajo de 910 °C) es cúbica centrada en el cuerpo. Hay un octavo átomo en cada una de las ocho esquinas del cubo y un átomo en el centro del cubo.
Q10.6.2
Describir la estructura cristalina de Pt, que cristaliza con cuatro átomos metálicos equivalentes en una celda unitaria cúbica.
Q10.6.3
¿Cuál es el número de coordinación de un átomo de cromo en la estructura cúbica centrada en el cuerpo del cromo?
S10.6.3
ocho
Q10.6.4
¿Cuál es el número de coordinación de un átomo de aluminio en la estructura cúbica centrada en la cara del aluminio?
Q10.6.5
El metal cobalto cristaliza en una estructura empaquetada hexagonal más cercana. ¿Cuál es el número de coordinación de un átomo de cobalto?
S10.6.5
12
Q10.6.6
El níquel metálico cristaliza en una estructura cúbica empaquetada más cercana. ¿Cuál es el número de coordinación de un átomo de níquel?
Q10.6.7
El tungsteno cristaliza en una celda unitaria cúbica centrada en el cuerpo con una longitud de borde de 3.165 Å.
- ¿Cuál es el radio atómico del tungsteno en esta estructura?
- Calcular la densidad del tungsteno.
S10.6.7
(a) 1.370 Å; (b) 19.26 g/cm
Q10.6.8
El platino (radio atómico = 1.38 Å) cristaliza en una estructura cúbica estrechamente empaquetada. Calcule la longitud del borde de la celda unitaria cúbica centrada en la cara y la densidad del platino.
Q10.6.9
El bario cristaliza en una celda unitaria cúbica centrada en el cuerpo con una longitud de borde de 5.025 Å
- ¿Cuál es el radio atómico del bario en esta estructura?
- Calcular la densidad del bario.
S10.6.9
(a) 2.176 Å; (b) 3.595 g/cm 3
Q10.6.10
El aluminio (radio atómico = 1.43 Å) cristaliza en una estructura cúbica estrechamente empaquetada. Calcule la longitud del borde de la celda unitaria cúbica centrada en la cara y la densidad del aluminio.
Q10.6.11
La densidad del aluminio es 2.7 g/cm 3; la del silicio es 2.3 g/cm 3. Explique por qué el Si tiene la menor densidad a pesar de que tiene átomos más pesados.
S10.6.11
La estructura cristalina del Si muestra que está menos apretada (coordinación número 4) en el sólido que Al (número de coordinación 12).
Q10.6.12
El espacio libre en un metal se puede encontrar restando el volumen de los átomos en una celda unitaria del volumen de la celda. Calcular el porcentaje de espacio libre en cada una de las tres celosías cúbicas si todos los átomos en cada una son de igual tamaño y tocan a sus vecinos más cercanos. ¿Cuál de estas estructuras representa el empaque más eficiente? Es decir, ¿qué empaca con la menor cantidad de espacio no utilizado?
Q10.6.13
El sulfuro de cadmio, a veces utilizado como pigmento amarillo por los artistas, cristaliza con cadmio, ocupando la mitad de los agujeros tetraédricos en una matriz empaquetada más cercana de iones sulfuro. ¿Cuál es la fórmula del sulfuro de cadmio? Explica tu respuesta.
S10.6.13
En una matriz empaquetada más cercana, existen dos agujeros tetraédricos para cada anión. Si sólo la mitad de los agujeros tetraédricos están ocupados, los números de aniones y cationes son iguales. La fórmula para el sulfuro de cadmio es CdS.
Q10.6.14
Un compuesto de cadmio, estaño y fósforo se utiliza en la fabricación de algunos semiconductores. Cristaliza con cadmio ocupando una cuarta parte de los agujeros tetraédricos y el estaño ocupando una cuarta parte de los orificios tetraédricos en una matriz empaquetada más cercana de iones fosfuro. ¿Cuál es la fórmula del compuesto? Explica tu respuesta.
Q10.6.15
¿Cuál es la fórmula del óxido magnético de cobalto, utilizado en cintas de grabación, que cristaliza con átomos de cobalto ocupando un octavo de los agujeros tetraédricos y la mitad de los agujeros octaédricos en una matriz estrechamente empaquetada de iones de óxido?
S10.6.15
Co 3 O 4
Q10.6.16
Un compuesto que contiene zinc, aluminio y azufre cristaliza con una matriz más cercana de iones sulfuro. Los iones de zinc se encuentran en una octava parte de los agujeros tetraédricos y los iones aluminio en la mitad de los orificios octaédricos. ¿Cuál es la fórmula empírica del compuesto?
Q10.6.17
Un compuesto de talio y yodo cristaliza en una simple matriz cúbica de iones yoduro con iones de talio en todos los agujeros cúbicos. ¿Cuál es la fórmula de este yoduro? Explica tu respuesta.
S10.6.17
En una matriz cúbica simple, solo un agujero cúbico puede ser ocupado como un catión para cada anión en la matriz. La relación de talio a yoduro debe ser 1:1; por lo tanto, la fórmula para el talio es TLi.
Q10.6.18
¿Cuál de los siguientes elementos reacciona con el azufre para formar un sólido en el que los átomos de azufre forman una matriz más cercana con todos los agujeros octaédricos ocupados: Li, Na, Be, Ca o Al?
Q10.6.19
¿Cuál es el porcentaje en masa de titanio en rutilo, un mineral que contiene titanio y oxígeno, si la estructura puede describirse como una matriz empaquetada más cercana de iones óxido con iones de titanio en la mitad de los agujeros octaédricos? ¿Cuál es el número de oxidación del titanio?
S10.6.19
59.95%; El número de oxidación del titanio es +4.
Q10.6.20
Explicar por qué los cloruros de metal alcalino químicamente similares NaCl y CsCl tienen diferentes estructuras, mientras que los químicamente diferentes NaCl y MnS tienen la misma estructura.
Q10.6.21
A medida que se formaron minerales a partir del magma fundido, diferentes iones ocuparon las mismas citas en los cristales. El litio suele ocurrir junto con el magnesio en los minerales a pesar de la diferencia en la carga sobre sus iones. Sugerir una explicación.
S10.6.21
Ambos iones son cercanos en tamaño: Mg, 0.65; Li, 0.60. Esta similitud permite que los dos se intercambien con bastante facilidad. La diferencia de carga es generalmente compensada por el interruptor de Si 4+ para Al 3+.
Q10.6.22
El yoduro de rubidio cristaliza con una celda unitaria cúbica que contiene iones yoduro en las esquinas y un ion rubidio en el centro. ¿Cuál es la fórmula del compuesto?
Q10.6.23
Uno de los diversos óxidos de manganeso cristaliza con una celda unitaria cúbica que contiene iones manganeso en las esquinas y en el centro. Los iones de óxido se localizan en el centro de cada borde de la celda unitaria. ¿Cuál es la fórmula del compuesto?
S10.6.23
Mn 2 O 3
Q10.6.24
El NaH cristaliza con la misma estructura cristalina que el NaCl. La longitud del borde de la celda unitaria cúbica de NaH es de 4.880 Å.
- Calcular el radio iónico de H −. (El radio iónico de Li + es 0.0.95 Å.)
- Calcular la densidad de NaH.
Q10.6.25
El yoduro de talio (I) cristaliza con la misma estructura que CsCl. La longitud del borde de la celda unitaria de TLi es de 4.20 Å. Calcular el radio iónico de TI +. (El radio iónico de I − es 2.16 Å.)
S10.6.25
1.48 Å
Q10.6.26
Una celda unitaria cúbica contiene iones manganeso en las esquinas e iones fluoruro en el centro de cada borde.
- ¿Cuál es la fórmula empírica de este compuesto? Explica tu respuesta.
- ¿Cuál es el número de coordinación del ion Mn 3+?
- Calcule la longitud del borde de la celda unitaria si el radio de un ion Mn 3+ es 0.65 A.
- Calcular la densidad del compuesto.
Q10.6.27
¿Cuál es el espaciamiento entre los planos cristalinos que difractan los rayos X con una longitud de onda de 1.541 nm en un ángulo θ de 15.55° (reflexión de primer orden)?
S10.6.27
2.874 Å
Q10.6.28
Un difractómetro usando rayos X con una longitud de onda de 0.2287 nm produjo un pico de difracción de primer orden para un ángulo de cristal θ = 16.21°. Determinar el espaciamiento entre los planos de difracción en este cristal.
Q10.6.29
Un metal con espaciamiento entre planos igual a 0.4164 nm difracta rayos X con una longitud de onda de 0.2879 nm. ¿Cuál es el ángulo de difracción para el pico de difracción de primer orden?
S10.6.29
20.2°
Q10.6.30
El oro cristaliza en una celda unitaria cúbica centrada en la cara. La reflexión de segundo orden (n = 2) de los rayos X para los planos que componen la parte superior e inferior de las celdas unitarias está en θ = 22.20°. La longitud de onda de los rayos X es de 1.54 Å. ¿Cuál es la densidad del oro metálico?
Q10.6.31
Cuando un electrón en un átomo de molibdeno excitado cae de la capa L a la K, se emite una radiografía. Estos rayos X son difractados en un ángulo de 7.75° por planos con una separación de 2.64 Å. ¿Cuál es la diferencia de energía entre la cáscara K y la cáscara L en molibdeno asumiendo una difracción de primer orden?
S10.6.31
1.74 × 10 4 eV


