20.2: Alcoholes y Éteres
- Page ID
- 75185
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir la estructura y propiedades de los alcoholes
- Describir la estructura y propiedades de los éteres
- Nombrar y dibujar estructuras para alcoholes y éteres
En esta sección, aprenderemos sobre alcoholes y éteres.
Alcoholes
La incorporación de un átomo de oxígeno en moléculas que contienen carbono e hidrógeno conduce a nuevos grupos funcionales y nuevas familias de compuestos. Cuando el átomo de oxígeno está unido por enlaces simples, la molécula es un alcohol o un éter.
Los alcoholes son derivados de hidrocarburos en los que un grupo —OH ha reemplazado a un átomo de hidrógeno. Aunque todos los alcoholes tienen uno o más grupos funcionales hidroxilo (—OH), no se comportan como bases como NaOH y KOH. El NaOH y el KOH son compuestos iónicos que contienen iones OH. Los alcoholes son moléculas covalentes; el grupo -OH en una molécula de alcohol está unido a un átomo de carbono por un enlace covalente.
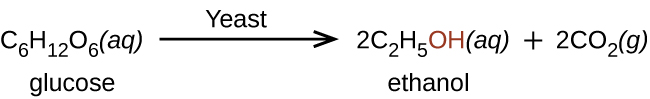
El etanol, CH 3 CH 2 OH, también llamado alcohol etílico, es un alcohol particularmente importante para uso humano. El etanol es el alcohol producido por algunas especies de levaduras que se encuentran en el vino, la cerveza y las bebidas destiladas. Durante mucho tiempo ha sido preparado por humanos aprovechando los esfuerzos metabólicos de las levaduras en la fermentación de diversos azúcares:
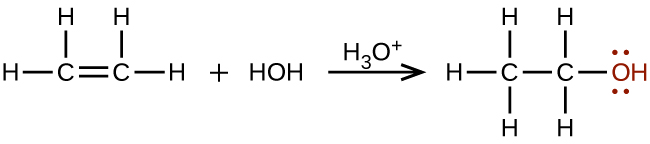
Se sintetizan grandes cantidades de etanol a partir de la reacción de adición de agua con etileno usando un ácido como catalizador:
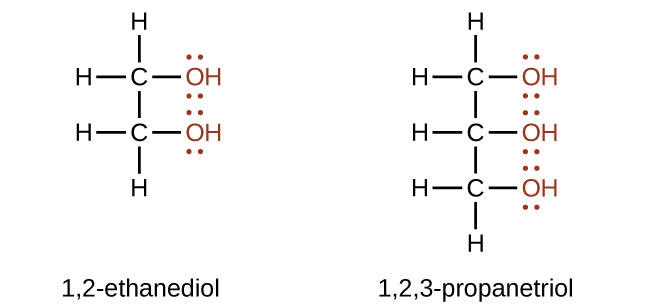
Se pueden elaborar alcoholes que contienen dos o más grupos hidroxilo. Los ejemplos incluyen 1,2-etandiol (etilenglicol, usado en anticongelante) y 1,2,3-propanotriol (glicerina, utilizado como disolvente para cosméticos y medicamentos):
Nombrar alcoholes
El nombre de un alcohol proviene del hidrocarburo del que se derivó. El -e final en el nombre del hidrocarburo se reemplaza por -ol, y el átomo de carbono al que está unido el grupo —OH se indica con un número colocado antes del nombre. 1
Considera el siguiente ejemplo. ¿Cómo debería nombrarse?
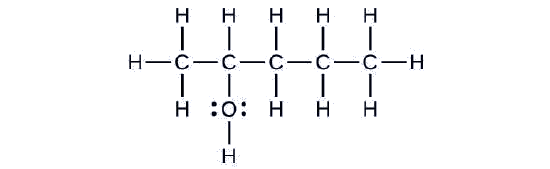
Solución
La cadena de carbono contiene cinco átomos de carbono. Si el grupo hidroxilo no estuviera presente, habríamos nombrado a esta molécula pentano. Para abordar el hecho de que el grupo hidroxilo está presente, cambiamos el final del nombre a -ol. En este caso, dado que el —OH está unido al carbono 2 en la cadena, llamaríamos a esta molécula 2-pentanol.
Nombra la siguiente molécula:
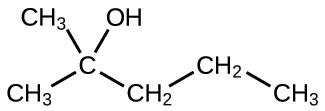
- Responder
-
2-metil-2-pentanol
Éteres
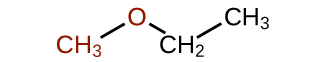
Los éteres son compuestos que contienen el grupo funcional —O—. Los éteres no tienen un sufijo designado como los otros tipos de moléculas que hemos nombrado hasta ahora. En el sistema IUPAC, el átomo de oxígeno y la rama de carbono más pequeña se nombran como sustituyente alcoxi y el resto de la molécula como la cadena base, como en alcanos. Como se muestra en el siguiente compuesto, los símbolos rojos representan el grupo alquilo más pequeño y el átomo de oxígeno, que se denominaría “metoxi”. La rama de carbono más grande sería etano, haciendo la molécula metoxietano. Muchos éteres son referidos con nombres comunes en lugar de los nombres del sistema IUPAC. Para los nombres comunes, las dos ramas conectadas al átomo de oxígeno se nombran por separado y seguidas de “éter”. El nombre común para el compuesto que se muestra a continuación es etilmetil éter:
Proporcione la IUPAC y el nombre común para el éter que se muestra aquí:
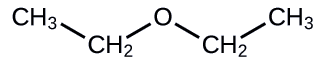
Solución
- Nombre de la IUPAC: La molécula está compuesta por un grupo etoxi unido a una cadena de etano, por lo que el nombre de la IUPAC sería etoxietano.
- Nombre común: Los grupos unidos al átomo de oxígeno son ambos grupos etilo, por lo que el nombre común sería éter dietílico.
Proporcione la IUPAC y el nombre común para el éter que se muestra:
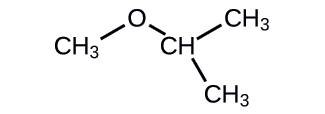
- Responder
-
IUPAC: 2-metoxipropano; común: isopropilmetil éter
Los éteres se pueden obtener a partir de alcoholes mediante la eliminación de una molécula de agua de dos moléculas del alcohol. Por ejemplo, cuando el etanol se trata con una cantidad limitada de ácido sulfúrico y se calienta a 140 °C, se forman éter dietílico y agua:
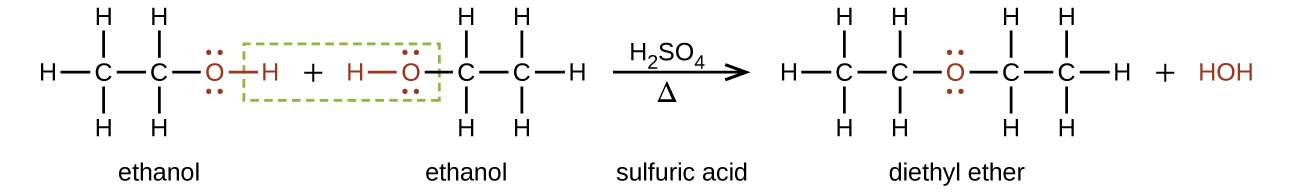
En la fórmula general para los éteres, R— O-R, los grupos hidrocarbonados (R) pueden ser iguales o diferentes. El éter dietílico, el compuesto más utilizado de esta clase, es un líquido incoloro y volátil que es altamente inflamable. Se utilizó por primera vez en 1846 como anestésico, pero mejores anestésicos ahora han ocupado en gran medida su lugar. El éter dietílico y otros éteres se utilizan actualmente principalmente como disolventes para gomas, grasas, ceras y resinas. El éter terciario -butil metílico, C 4 H 9 OCH 3 (abreviado MTBE —las porciones de nombres en cursiva no se cuentan al clasificar alfabéticamente los grupos, por lo que el butilo viene antes que el metilo en el nombre común), se usa como aditivo para la gasolina. MTBE pertenece a un grupo de químicos conocidos como oxigenados debido a su capacidad para aumentar el contenido de oxígeno de la gasolina.
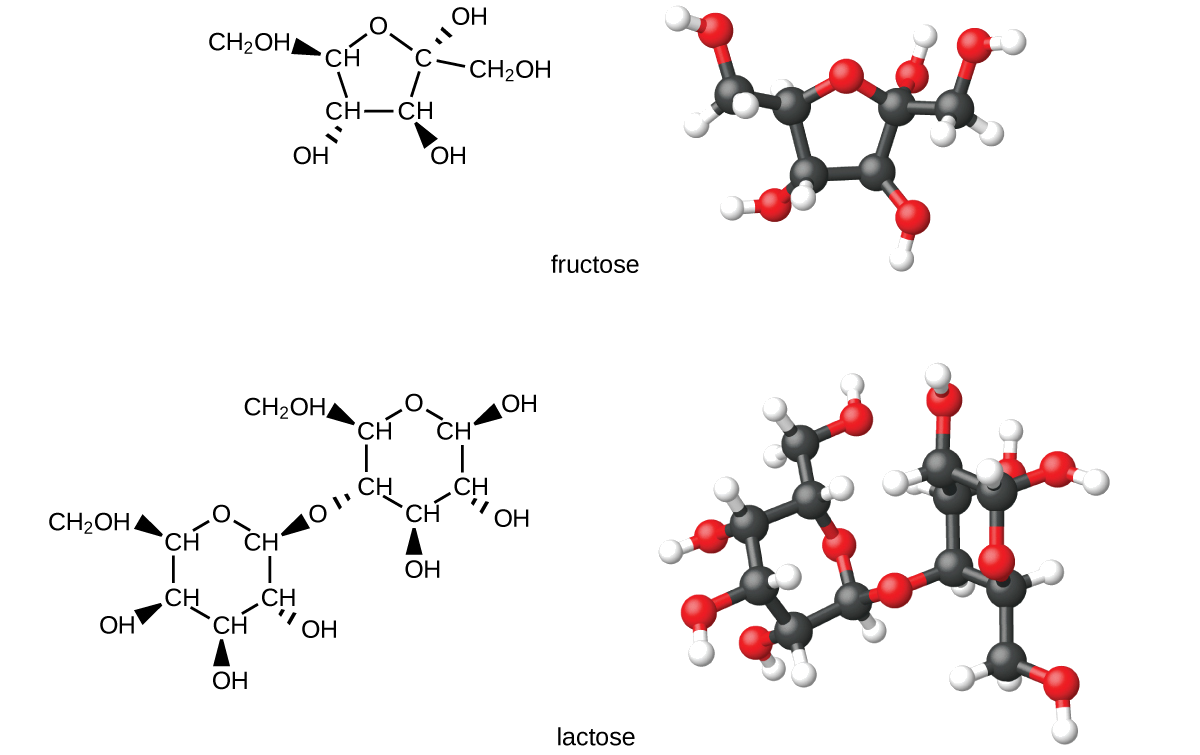
Los carbohidratos son biomoléculas grandes compuestas por carbono, hidrógeno y oxígeno. Las formas dietéticas de carbohidratos son alimentos ricos en este tipo de moléculas, como pastas, pan y dulces. El nombre “carbohidrato” proviene de la fórmula de las moléculas, la cual puede ser descrita por la fórmula general C m (H 2 O) n, que demuestra que son en cierto sentido “carbono y agua” o “hidratos de carbono”. En muchos casos, m y n tienen el mismo valor, pero pueden ser diferentes. Los carbohidratos más pequeños generalmente se denominan “azúcares”, el término bioquímico para este grupo de moléculas es “sacárido” de la palabra griega para azúcar (Figura\(\PageIndex{1}\)). Dependiendo del número de unidades de azúcar unidas entre sí, pueden clasificarse como monosacáridos (una unidad de azúcar), disacáridos (dos unidades de azúcar), oligosacáridos (algunos azúcares) o polisacáridos (la versión polimérica de los azúcares: los polímeros se describieron en la caja de características anterior en este capítulo sobre reciclaje plásticos). Los nombres científicos de los azúcares pueden reconocerse por el sufijo -ose al final del nombre (por ejemplo, el azúcar de la fruta es un monosacárido llamado “fructosa” y el azúcar de la leche es un disacárido llamado lactosa compuesto por dos monosacáridos, glucosa y galactosa, conectados entre sí). Los azúcares contienen algunos de los grupos funcionales que hemos discutido: Tenga en cuenta los grupos alcohol presentes en las estructuras y cómo se unen las unidades de monosacáridos para formar un disacárido mediante la formación de un éter.
Los organismos utilizan carbohidratos para una variedad de funciones. Los carbohidratos pueden almacenar energía, como los polisacáridos glucógeno en los animales o el almidón en las plantas. También proporcionan soporte estructural, como la celulosa polisacárida en plantas y la quitina polisacárida modificada en hongos y animales. Los azúcares ribosa y desoxirribosa son componentes de las cadenas principales de ARN y ADN, respectivamente. Otros azúcares juegan un papel clave en la función del sistema inmune, en el reconocimiento célula-célula y en muchos otros roles biológicos.
La diabetes es un grupo de enfermedades metabólicas en las que una persona tiene una alta concentración de azúcar en la sangre (Figura\(\PageIndex{2}\)). La diabetes puede ser causada por una producción insuficiente de insulina por parte del páncreas o por que las células del cuerpo no responden adecuadamente a la insulina que se produce. En una persona sana, la insulina se produce cuando es necesaria y funciona para transportar la glucosa de la sangre a las células donde puede ser utilizada como energía. Las complicaciones a largo plazo de la diabetes pueden incluir pérdida de la vista, enfermedades cardíacas e insuficiencia renal.
En 2013, se estimó que aproximadamente 3.3% de la población mundial (~380 millones de personas) padecía diabetes, resultando en más de un millón de muertes anuales. La prevención implica llevar una dieta saludable, hacer mucho ejercicio y mantener un peso corporal normal. El tratamiento involucra todas estas prácticas de estilo de vida y puede requerir inyecciones de insulina.
Resumen
Muchos compuestos orgánicos que no son hidrocarburos pueden considerarse derivados de hidrocarburos. Un derivado hidrocarbonado se puede formar reemplazando uno o más átomos de hidrógeno de un hidrocarburo por un grupo funcional, que contiene al menos un átomo de un elemento distinto de carbono o hidrógeno. Las propiedades de los derivados hidrocarbonados están determinadas en gran medida por el grupo funcional. El grupo —OH es el grupo funcional de un alcohol. El grupo —R-O-R— es el grupo funcional de un éter.
Notas al pie
- La IUPAC adoptó nuevas pautas de nomenclatura en 2013 que requieren que este número se coloque como un “infijo” en lugar de un prefijo. Por ejemplo, el nuevo nombre para 2-propanol sería propan-2-ol. La adopción generalizada de esta nueva nomenclatura llevará algún tiempo, y se alienta a los estudiantes a familiarizarse con los protocolos de nomenclatura tanto antiguos como nuevos.
Glosario
- alcohol
- compuesto orgánico con un grupo hidroxilo (-OH) unido a un átomo de carbono
- éter
- compuesto orgánico con un átomo de oxígeno que está unido a dos átomos de carbono


