3.8: Día 25- Catálisis Homogénea y Heterogénea
- Page ID
- 78810
23
Día 25: Catálisis Homogénea y Heterogénea
Catálisis Homogénea D25.1
Las reacciones que son facilitadas por los catalizadores se pueden dividir en dos clases principales: catálisis homogénea y catálisis heterogénea. Un catalizador homogéneo está presente en la misma fase que los reactivos. Las reacciones en fase gaseosa y las reacciones en solución son reacciones homogéneas y ya hemos discutido varios ejemplos en los que el catalizador y los reactivos están todos en la misma fase. Aquí hay uno más.
En la Sección D13.5 describimos las reacciones de condensación y las reacciones de hidrólisis que ocurren en soluciones acuosas. (La hidrólisis es el reverso de una condensación que produce agua como molécula pequeña). También mencionamos que la condensación y la hidrólisis pueden ser catalizadas por ácidos fuertes (es decir, por iones H +). Esta es una reacción catalítica homogénea porque los reactivos, productos y catalizadores están todos en solución acuosa.
Un ejemplo de hidrólisis de éster es la descomposición catalizada por ácido del acetato de metilo para formar ácido acético y metanol. El mecanismo de reacción se muestra en la Figura 1.
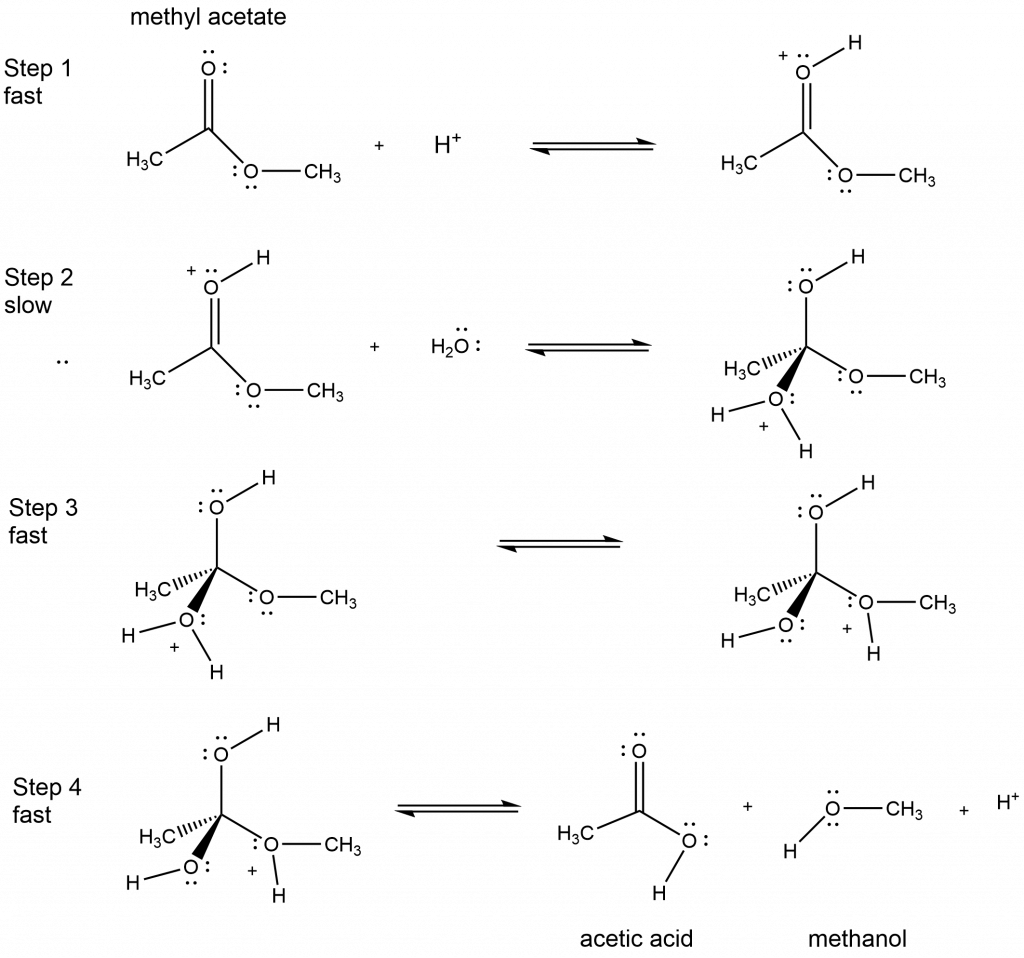 Figura 1. Mecanismo de hidrólisis catalizada por ácido del acetato de metilo para formar ácido acético y metanol.
Figura 1. Mecanismo de hidrólisis catalizada por ácido del acetato de metilo para formar ácido acético y metanol.
Actividad 1: Análisis de un Mecanismo de Reacción
Catalizadores heterogéneos D25.2
Un catalizador heterogéneo está presente en una fase diferente de los reactivos. Tales catalizadores son usualmente sólidos, y a menudo funcionan proporcionando una superficie activa sobre la cual pueden ocurrir una o más etapas en la reacción.
Una reacción catalítica heterogénea tiene al menos cuatro etapas en su mecanismo de reacción:
- Adsorción del (de los) reactivo (s) sobre la superficie del catalizador
- Activación del (de los) reactivo (s) adsorbido (s)
- Reacción del reactivo o reactivos adsorbidos
- Difusión del (de los) producto (s) de la superficie a la fase gaseosa o líquida (desorción)
Cualquiera de estos pasos puede ser lento y, por lo tanto, puede servir como el paso de determinación de la velocidad. Pero la velocidad general de la reacción sigue siendo más rápida de lo que sería sin el catalizador. La Figura 1 ilustra la reacción de alquenos con hidrógeno sobre un catalizador de níquel.
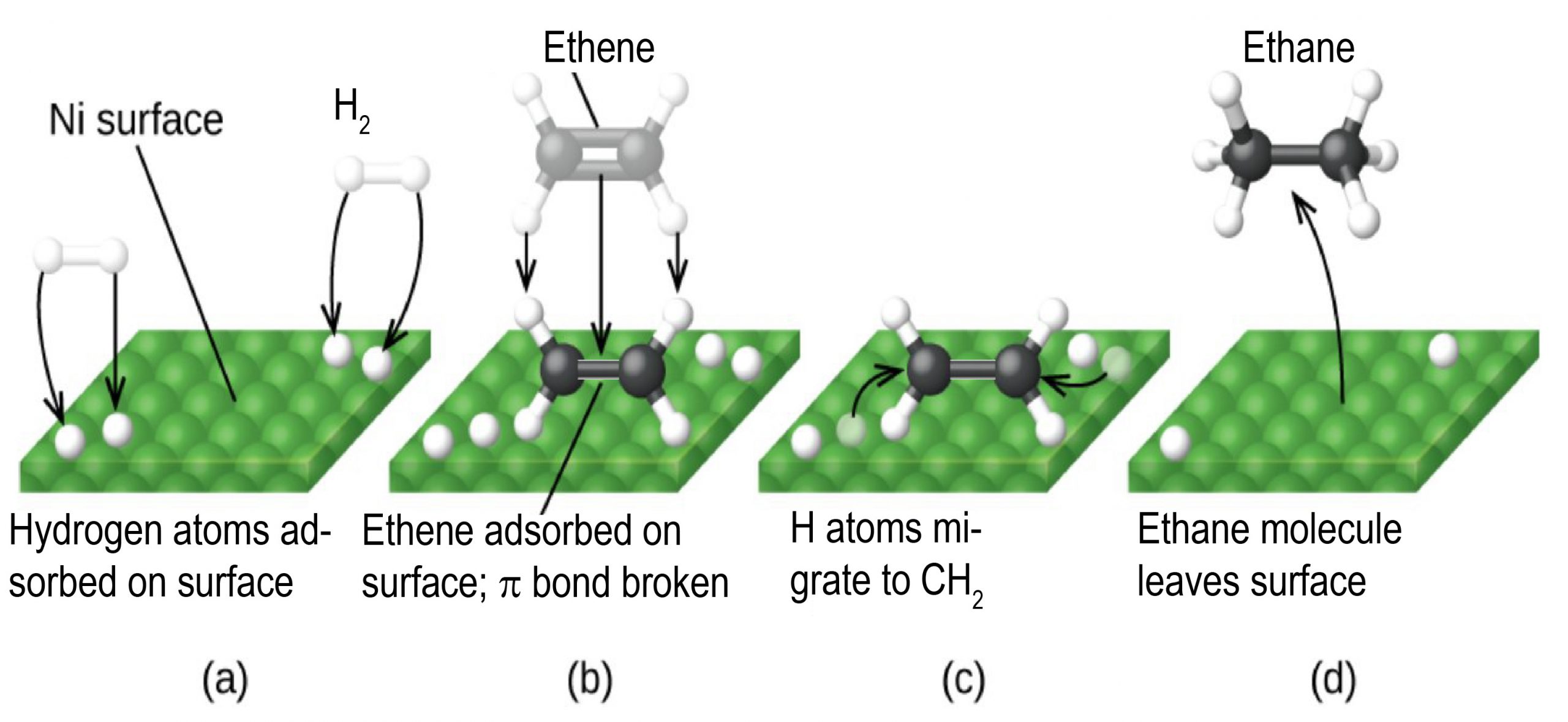
La reacción no catalizada de C 2 H 4 (g) + H 2 (g) ⟶ C 2 H 6 (g) requeriría un estado de transición donde el enlace C=C π y el enlace H-H σ se están rompiendo mientras se forman los enlaces C-H σ. Tal estado de transición es tan alto en energía que sin un catalizador, H 2 se considera como no reactivo hacia los alquenos en la mayoría de las condiciones.
El níquel es un catalizador de uso frecuente en la hidrogenación de grasas y aceites poliinsaturados para producir grasas y aceites saturados. Otros procesos industriales significativos que implican el uso de catalizadores heterogéneos incluyen la preparación de ácido sulfúrico, la preparación de amoníaco, la oxidación del amoníaco a ácido nítrico y la síntesis de metanol. Los catalizadores heterogéneos también se utilizan en los convertidores catalíticos que se encuentran en la mayoría de los automóviles a gasolina.
Pregunta Podia
El platino metálico es un catalizador heterogéneo para esta reacción:
2 NO (g) → N 2 (g) + O 2 (g)
La velocidad de reacción varía con la concentración de NO como se muestra en la gráfica.

Explique cada una de estas observaciones. Incluya en su explicación una descripción a nivel atómico de las moléculas de NO, la superficie de platino y cómo interactúan las dos.
- La gráfica es lineal con pendiente positiva a bajas concentraciones de NO.
- La gráfica es horizontal a altas concentraciones de NO.
Sugiera un experimento que pudiera hacerse para apoyar o contradecir su explicación de la gráfica horizontal. Describa la hipótesis que propone para lo que sucederá en el experimento si su explicación es correcta; también describa qué resultados experimentales contradicen su hipótesis.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


