1.6: El Estado Sólido Imperfecto
- Page ID
- 80088
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
INTRODUCCIÓN
Los cristales reales nunca son perfectos: siempre contienen una densidad considerable de defectos e imperfecciones que afectan sus propiedades físicas, químicas, mecánicas y electrónicas. La existencia de defectos también juega un papel importante en diversos procesos y fenómenos tecnológicos como el recocido, la precipitación, la difusión, la sinterización, la oxidación y otros. Cabe señalar que los defectos no necesariamente tienen efectos adversos sobre las propiedades de los materiales. Hay muchas situaciones en las que un control juicioso de los tipos y cantidades de imperfecciones puede traer consigo características específicas deseadas en un sistema. Esto se puede lograr mediante técnicas de procesamiento adecuadas. De hecho, la “ingeniería de defectos” está emergiendo como una actividad importante.
Todos los defectos e imperfecciones se pueden considerar convenientemente bajo cuatro divisiones principales: defectos puntuales, defectos de línea o dislocaciones, defectos planos o defectos interfaciales o de contorno de grano, y defectos de volumen. También podemos agregar aquí defectos macroscópicos o a granel como poros, grietas e inclusiones extrañas que se introducen durante la producción y procesamiento del estado sólido. Los defectos puntuales son inherentes al estado de equilibrio y por lo tanto determinados por la temperatura, presión y composición de un sistema dado. La presencia y concentración de otros defectos, sin embargo, depende de la forma en que el sólido se formó originalmente y posteriormente se procesó.
Considerar brevemente los efectos de las imperfecciones o defectos cristalinos sobre algunas propiedades importantes de los sólidos. El comportamiento eléctrico de los semiconductores, por ejemplo, está controlado en gran medida por imperfecciones cristalinas. La conductividad del silicio puede alterarse así en tipo (n o p) y en más de ocho órdenes de magnitud mediante la adición de cantidades diminutas de elementos dopantes eléctricamente activos. En este caso, cada átomo de dopante, incorporado sustitucionalmente, representa un defecto puntual en la red de silicio. El hecho de que cantidades tan pequeñas de átomos de impurezas puedan alterar significativamente las propiedades eléctricas de los semiconductores es responsable del desarrollo del transistor y ha abierto todo el campo de la tecnología de dispositivos de estado sólido. Prácticamente ninguna de las propiedades semiconductoras que llevaron a estos logros de ingeniería se encuentran en un cristal “perfecto”. Son propiedades propias del estado sólido defectuoso.
La existencia de dislocaciones (defectos de línea) en los cristales proporciona un mecanismo por el cual se puede producir un cambio permanente de forma o deformación mecánica. Un sólido cristalino libre de dislocaciones es quebradizo y prácticamente inútil como material de ingeniería. Si bien la existencia de dislocaciones en los cristales asegura la ductilidad (capacidad de deformación), la fuerza teórica de los sólidos cristalinos se reduce drásticamente por su presencia.
Debemos reconocer que las dislocaciones juegan un papel central en la determinación de propiedades tan importantes como la fuerza y la ductilidad. De hecho, prácticamente todas las propiedades mecánicas de los sólidos cristalinos están controladas en gran medida por el comportamiento de las imperfecciones de la línea.
La capacidad de un material ferromagnético (como hierro, níquel u óxido de hierro) para magnetizarse y desmagnetizarse depende en gran parte de la presencia de imperfecciones bidimensionales conocidas como paredes Bloch. Estas interfaces son límites entre dos regiones del cristal que tienen un estado magnético diferente. A medida que ocurre la magnetización, estos defectos migran y por su movimiento proporcionan al material un momento magnético neto. Sin la existencia de las paredes Bloch todos los materiales ferromagnéticos serían imanes permanentes. De hecho, los electroimanes no existirían si no fuera por este tipo de defecto.
La presencia de defectos superficiales como grietas hace que los materiales frágiles como el vidrio se rompan a pequeñas tensiones aplicadas. Este hecho es familiar para cualquiera que haya roto un tubo de vidrio al llenar primero una pequeña muesca (o grieta) en la superficie. La eliminación de grietas de la superficie del vidrio ya sea por grabado en ácido fluorhídrico o por pulido a la llama casi siempre eleva la resistencia a la fractura. Por ejemplo, el vidrio en ausencia de grietas superficiales tiene una resistencia a la fractura de\(\sim 10^{10} \mathrm{Newton} / \mathrm{m}^2\) (a diferencia del vidrio real que tiene una resistencia a la fractura de\(\sim 0^7\) Newton\(/ \mathrm{m}^2\)).
DEFECTOS PUNTUALES
Formación de defectos puntuales
Una ley incontrovertible de la naturaleza establece: “Nada es perfecto”. Esta ley se aplica tanto a los humanos como al mundo inorgánico de los sólidos cristalinos y puede formularse como la 2ª ley de la termodinámica:
\[\mathrm{F}=\mathrm{H}-\mathrm{TS} \tag{1}\]
donde\(\mathrm{F}\) está la energía libre de un sistema dado,\(\mathrm{H}\) es el contenido de calor o entalpía y TS es la entropía, o trastorno, término. Si una reacción tiene lugar a una temperatura\(T\), encontramos el cambio en\(\mathrm{F}(\Delta \mathrm{F})\) relacionado con un cambio en\(\mathrm{H}(\Delta \mathrm{H})\), el contenido de calor, y posiblemente también un cambio en el TS\((T \Delta S)\). Tal es el caso cuando los defectos se forman en un sólido perfecto: La distribución de energía en un sólido (Maxwell-Boltzmann) sugiere que varios átomos individuales pueden adquirir suficiente energía térmica para ser desplazados del sitio de la red de equilibrio a una posición intersticial. Este proceso de formación de defectos puntuales requiere energía y conduce a una deformación reticular que constituye, como se discutió anteriormente, un aumento en el contenido de calor del sistema (\(\Delta H\)es positivo y aumenta linealmente con el número de defectos formados). El alejamiento de la perfección por la generación de defectos conduce al desorden (\(\Delta S\)es positivo). La magnitud del trastorno generado (\(\Delta S\)) es muy grande durante el paso inicial desde la perfección hasta el ligero desorden, pero el aumento del trastorno (con un número dado de defectos generados) disminuye a medida que aumenta el trastorno general.
Correspondientemente el término\(T \Delta S\) baja rápidamente al principio y luego se aplana. El resultado neto (fig. 1), energía libre, exhibe un mínimo para un cierto número de defectos en el

sólido [densidad de defecto de equilibrio = f (temperatura)]; el\(F_{\text{minimum}}\) sugiere también que la transición de la perfección a la estructura de defecto de equilibrio es espontánea: ¡ocurre naturalmente!
Si bien los mecanismos detallados para la formación de vacantes atómicas en sólidos siguen siendo objeto de una extensa investigación, las energéticas de equilibrio asociadas son claras: los cálculos de la energía térmica de los átomos en una red muestran que la energía vibratoria promedio de los átomos de la red es mucho menor que \(1 \mathrm{eV}\)(el cambio aproximado de energía asociado a la formación de vacantes, es decir, la menor cantidad de energía requerida para formar una vacante) a temperatura ambiente. Por lo tanto, un átomo de celosía solo adquirirá la energía\(\Delta \mathrm{H}_{\mathrm{d}}\), la energía requerida para formar el defecto, al producirse una gran fluctuación energética. Dado que la probabilidad relativa de que un átomo tenga una energía\(\Delta \mathrm{H}_d\) o más en exceso de la energía del estado fundamental es\(e^{-\Delta H_d / k T}\), la probabilidad de que un sitio atómico esté vacante varía de la misma manera. En un cristal (molar) que contiene sitios\(\mathrm{N}\) atómicos, el número\(\mathrm{n}_{\mathrm{d}}\) de sitios vacantes es, por lo tanto,
\[\mathrm{n}_{\mathrm{d}}=\mathrm{ANe}^{-\Delta \mathrm{H}_{\mathrm{d}} / \mathrm{kT}} \tag{2}\]
donde
- \(\mathrm{n}_{\mathrm{d}}\)es el número de defectos (en equilibrio a\(\mathrm{T}\))
- \(\mathrm{N}\)es el número total de sitios atómicos por mol
- \(\Delta \mathrm{H}_{\mathrm{d}}\)es la energía necesaria para formar el defecto
- \(\mathrm{T}\)es la temperatura absoluta\((\mathrm{K})\)
- \(\mathrm{k}\)es la constante de Boltzmann
- \(\mathrm{A}\)es una constante de proporcionalidad
Defectos puntuales en sistemas metálicos “puros”
Los defectos puntuales en los metales cristalinos “puros” son defectos de dimensiones atómicas, como los átomos de impurezas, la ausencia de un átomo de matriz y/o la presencia de un átomo de matriz en el lugar equivocado. Algunos de estos defectos puntuales se muestran en la fig. 2. Un átomo de impureza que ocupa un sitio reticular normal se denomina átomo de impureza sustitucional y un átomo de impureza que se encuentra en el intersticio entre los átomos de la matriz se denomina átomo de impureza intersticial. Si un átomo extraño ocupará un sustitutivo

o sitio intersticial depende en gran medida del tamaño del átomo en relación con el tamaño del sitio. Los átomos pequeños suelen ser impurezas intersticiales, mientras que los átomos más grandes suelen ser impurezas sustitucionales.
Una vacante es un sitio atómico, normalmente ocupado en el cristal perfecto, del que falta un átomo. A menudo, el término “vacante” se usa para denotar un llamado defecto de Schottky, que se forma cuando un átomo o un ion deja un sitio de celosía normal y se reposiciona en un sitio de celosía en la superficie del cristal. Esto puede ser el resultado de un reordenamiento atómico en un cristal existente a alta temperatura cuando la movilidad atómica es alta debido al aumento de las vibraciones térmicas. Una vacante también puede originarse en el proceso de cristalización como resultado de perturbaciones locales durante el crecimiento de nuevos planos atómicos en la superficie cristalina. Las vacantes son defectos puntuales de un tamaño casi igual al tamaño del sitio original (ocupado); la energía de la formación de una vacante es relativamente baja, generalmente inferior a 1 eV.
El número de vacantes en equilibrio a cada temperatura en un cristal se puede determinar a partir de la ecuación (2), en la que\(\Delta \mathrm{H}_{\mathrm{d}}\) se encuentra la energía necesaria para tomar un átomo de un sitio regular del cristal y colocarlo en la superficie para un defecto de tipo Schottky. Cuando se calienta un sólido, se establece una nueva concentración de vacantes de equilibrio más alta, generalmente primero en las superficies cristalinas y luego en las proximidades de dislocaciones y límites de grano que proporcionan sitios para los átomos que han salido de su sitio normal de red. Las vacantes se extienden gradualmente por todo el cristal (de las superficies a la masa). Al enfriarse la concentración de vacantes se baja por “difusión de vacantes” a límites de grano o dislocaciones, que actúan como sumideros. En ambos casos, la nueva concentración de vacantes de equilibrio se establece sólo después de un tiempo finito. La velocidad a la que las vacantes se mueven de punto a punto en la red disminuye exponencialmente con la disminución de la temperatura. Por lo tanto, en enfriamiento muy rápido (enfriamiento) desde una temperatura alta cerca del punto de fusión la mayoría de las vacantes no tienen tiempo para difundirse a los sumideros y se dice que están “congeladas”. Esto da una concentración considerablemente mayor (“no equilibrio”) de vacantes en especímenes templados que la indicada por el valor de equilibrio térmico.
La concentración de sitios de celosía vacantes en materiales puros es muy pequeña a bajas temperaturas, aproximadamente una vacante por cada sitio de\(10^8\) átomo, y aumenta con el aumento de la temperatura a aproximadamente una vacante en cada\(10^3\) sitio a la temperatura de fusión. Las vacantes son importantes porque controlan la tasa de difusión de átomos matriciales (o sustitutivos), es decir, los átomos son capaces de moverse en un sólido cristalino principalmente por la presencia de vacantes. (El mecanismo por el que se mueven es el mismo que el asociado con mover un automóvil en un estacionamiento lleno a la salida). Esto se muestra esquemáticamente en la fig. 3. Los autointersticiales generalmente no se encuentran en un paquete cerrado
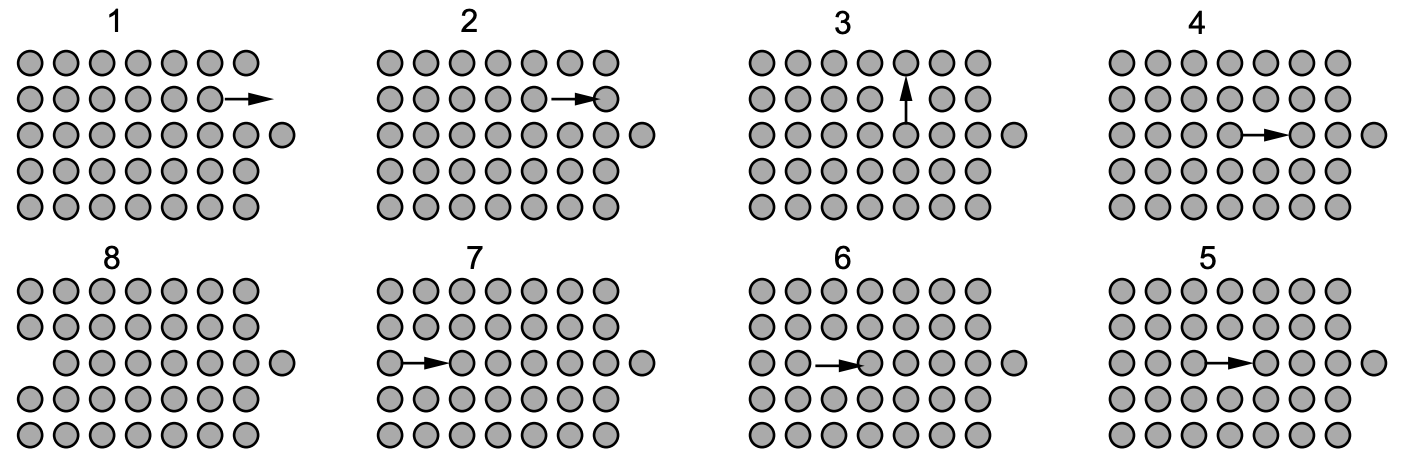
sistemas metálicos, pero pueden ser introducidos por irradiación. Por ejemplo, los neutrones de alta energía de la fisión atómica pueden golpear los átomos metálicos de sus sitios regulares a sitios intersticiales, creando pares vacancia-intersticial.
Defectos puntuales en sólidos iónicos
Los defectos puntuales en las estructuras iónicas difieren de los encontrados en los elementos puros debido al requisito de neutralidad de carga. Por ejemplo, en un material iónico monovalente puro una vacante catiónica debe tener asociada con él ya sea una vacante intersticial catiónica o una vacante aniónica para mantener la neutralidad de carga. Se mantienen requisitos similares para vacantes de aniones. Un defecto de par vacante (migración de un catión y un anión a la superficie) generalmente se llama imperfección Schottky, y un defecto de par vacancia-intersticial se conoce como imperfección de Frenkel (un anión o catión ha dejado su posición de celosía, que se convierte en vacante, y se ha movido a una posición intersticial). Estos dos tipos de imperfecciones se muestran en la fig. 4. Los autointersticiales son mucho más comunes en las estructuras iónicas que en los elementos puros porque muchos compuestos iónicos tienen sitios intersticiales relativamente grandes disponibles. Es decir, a menudo hay sitios intersticiales en la celda unitaria que tienen casi el

mismo entorno que los sitios atómicos normales. (Por ejemplo, en BeO los átomos Be llenan solo la mitad de los sitios tetraédricos disponibles, dejando cuatro posibles sitios intersticiales catiónicos por celda unitaria. Así, un átomo Be podría pasar de un sitio reticular regular a un sitio intersticial casi equivalente con poca distorsión de la red).
Los átomos extraños en los cristales iónicos producen defectos que también deben mantener la neutralidad de carga. Por ejemplo, en NaCl un catión monovalente, como el litio, puede simplemente reemplazar uno de los iones sodio como impureza sustitutiva. Pero un catión divalente, como el calcio, que sustituye a un ion sodio debe ir acompañado de una vacante catiónica o un anión intersticial si se quiere mantener la neutralidad de carga. Correspondientemente, los cationes de impurezas monovalentes en una estructura divalente (por ejemplo, Na en MgO) deben ir acompañados de un número apropiado de intersticiales catiónicos o vacantes aniónicas.
Defectos puntuales en sólidos unidos covalentemente
Las impurezas sustitutivas en los materiales unidos covalentemente pueden crear una imperfección única en la estructura electrónica si el átomo de impureza es de un grupo en la tabla periódica distinto de los átomos de la matriz. Por ejemplo, ya consideró elementos del Grupo V y Grupo III en una matriz del Grupo IV, como As o B en Si.
Cuando se incorporan átomos extraños a una estructura cristalina, ya sea en sitios sustitucionales o intersticiales, decimos que la fase resultante es una solución sólida del material de la matriz (disolvente) y los átomos extraños (soluto). El término “solución sólida”, sin embargo, no se limita a los bajos contenidos de solutos de los sistemas semiconductores dopados; existen muchas soluciones sólidas, como las aleaciones metálicas, que comprenden un amplio rango de composición.
DEFECTOS DE LÍNEA
Las imperfecciones de línea, o dislocaciones, en los sólidos cristalinos son defectos que producen distorsiones reticulares centradas alrededor de una línea. Una dislocación es simplemente el borde de un plano fraccional extra insertado de átomos (fig. 5). Normalmente el símbolo\(\perp\) se usa para representar un positivo

dislocación (plano extra fraccional) y\(\top\) se utiliza para representar una dislocación negativa (plano fraccional faltante).
La importancia de las dislocaciones se demuestra fácilmente en la deformación de materiales cristalinos. El plano en el que una dislocación se mueve a través de la celosía se llama plano de deslizamiento. Con un esfuerzo cortante aplicado, la dislocación se mueve, fila atómica por fila atómica, y una parte del cristal se desplaza con relación a la otra. Cuando la dislocación ha pasado a través del cristal, la porción del cristal por encima del plano de deslizamiento se ha desplazado una distancia atómica con respecto a la porción debajo del plano de deslizamiento. Es decir, el movimiento de la dislocación ha provocado que el cristal cambie de forma, se deforme permanentemente (fig. 6).

Tenga en cuenta: a cada lado de la dislocación la celosía cristalina es esencialmente perfecta, pero en las inmediaciones de la dislocación la celosía está severamente distorsionada. Para una dislocación de borde positiva, la presencia del medio plano adicional hace que los átomos por encima del plano de deslizamiento se pongan en compresión, mientras que los que están debajo del plano de deslizamiento se ponen en tensión. En consecuencia, la dislocación del borde tendrá un campo de tensión a su alrededor que es compresivo por encima del plano de deslizamiento y tracción por debajo del plano de deslizamiento.
Deformación Plástica por Deslizamiento:
Cuando los cristales individuales de metal (o semiconductor) son estirados en tensión, comenzarán a deformarse (alargarse) plásticamente a niveles de tensión relativamente bajos, y los “bloques” de los cristales se deslizan unos sobre otros debido al movimiento de dislocación. Simultáneamente, aparecen en su superficie las llamadas líneas de deslizamiento. Se encuentra que la deformación por deslizamiento ocurre más fácilmente en planos con alta densidad atómica y con gran espaciamiento interplanar, mientras que la dirección de deslizamiento es en todos los casos una “dirección atómica empaquetada”. Por lo tanto, para las estructuras FCC observamos como el sistema de deslizamiento primario {111} planos en dirección, mientras que en las estructuras BCC el deslizamiento primario ocurre en planos {110} en direcciones. (Cabe señalar que un mecanismo de deformación alternativo es el “hermanamiento por deformación”, actualmente no debe considerarse).
Escalada por dislocación:
Subir es el nombre que se le da al movimiento de las dislocaciones cuando el plano extra “medio” se extiende más lejos en un cristal o se retira parcialmente de él. Claramente, el proceso de ascenso no es un movimiento del plano, sino su crecimiento o contracción como consecuencia de la adición de átomos o “vacantes” respectivamente del entorno de la dislocación (fig. 7).
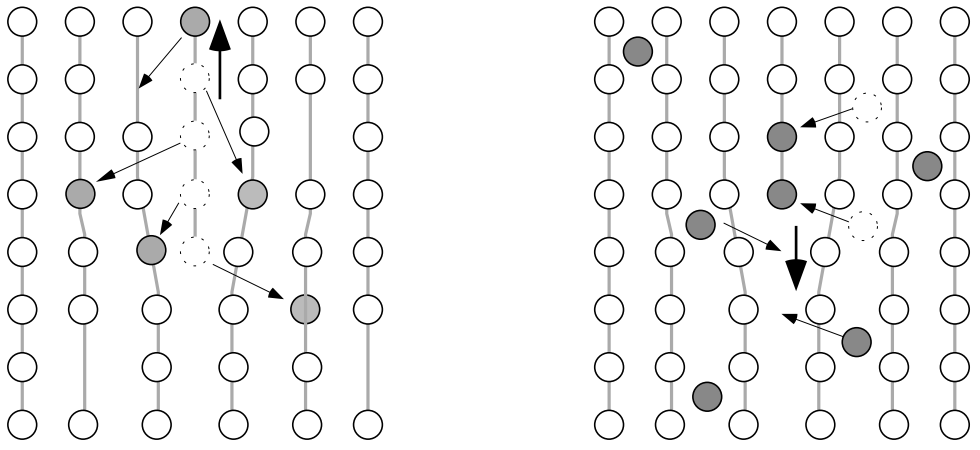
Multiplicación de Dislocaciones:
Dado que durante el deslizamiento cada dislocación sale de la matriz, la deformación macroscópica no pudo ocurrir dadas las densidades normales de dislocación en el rango de\(10^6-10^8 / \mathrm{cm}^3\). El examen de los cristales deformados indica que la multiplicación de las dislocaciones se produce durante la deformación. Si bien existen multitud de mecanismos de multiplicación, el más estudiado es el Frank-Read Source (no se discutirá en detalle).
Interacciones de dislocación:
La relativa facilidad con la que las dislocaciones se mueven a través de una matriz sólida puede atribuirse a los severos desplazamientos de átomos en el núcleo de las dislocaciones. Si se reducen estas tensiones locales, se reduce la movilidad de las dislocaciones -y por lo tanto la facilidad de deslizamiento-. Se encuentra que las impurezas en las proximidades de núcleos de dislocación tienden a reducir la energía de distorsión local de las dislocaciones y así estabilizar el sistema contra el deslizamiento. En muchos sistemas se añaden intencionadamente impurezas (por ejemplo, endurecimiento en solución sólida) para aumentar la resistencia de los materiales. De manera similar, los microprecipitados tienden a impedir el movimiento de dislocación (por ejemplo, endurecimiento por precipitación).
IMPERFECCIONES INTERFACIALES
Los diferentes tipos de imperfecciones interfaciales o planas en sólidos se pueden agrupar en las siguientes categorías:
- Interfaces entre sólidos y gases, que se llaman superficies libres;
- Interfaces entre regiones donde hay un cambio en la estructura electrónica, pero no cambio en la periodicidad de la disposición atómica, conocidas como límites de dominio;
- Interfaces entre dos cristales o granos de la misma fase donde hay una diferencia de orientación en la disposición de los átomos a través de la interfaz; estas interfaces se denominan límites de grano;
- Interfaces entre diferentes fases, llamadas límites de fase, donde generalmente hay un cambio de composición química y disposición de átomos a través de la interfaz.
Los límites de grano son peculiares de los sólidos cristalinos, mientras que las superficies libres, los límites de dominio y los límites de fase se encuentran tanto en sólidos cristalinos como
Superficies Libres
Debido a su tamaño finito, todos los materiales sólidos tienen superficies libres. La disposición de los átomos en una superficie libre difiere ligeramente de la estructura interior porque los átomos superficiales no tienen átomos vecinos en un lado. Por lo general, los átomos cerca de la superficie tienen la misma estructura cristalina pero un parámetro de celosía ligeramente mayor que los átomos interiores.
Quizás el aspecto más importante de las superficies libres es la energía superficial\((\gamma)\) asociada con las superficies de cualquier sólido. La fuente de esta energía superficial puede verse considerando el entorno de los átomos en la superficie y en el interior de un sólido. Para llevar un átomo del interior a la superficie, debemos romper o distorsionar algunos enlaces, aumentando así la energía. La energía superficial se define como el incremento de energía por unidad de área de nueva superficie formada. En los sólidos cristalinos, la energía superficial depende de la orientación cristalográfica de la superficie - aquellas superficies que son planos de empaquetamiento atómico más denso son también los planos de menor energía superficial. Esto se debe a que los átomos en estas superficies tienen menos de sus enlaces rotos o, de manera equivalente, tienen un mayor número de vecinos más cercanos dentro del plano de la superficie. Los valores típicos de las energías superficiales de los sólidos varían de aproximadamente\(10^{-1}\) a\(1 \mathrm{~J} / \mathrm{m}^2\). Generalmente, cuanto más fuerte es la unión en el cristal, mayor es la energía superficial.
Las energías superficiales se pueden reducir mediante la adsorción de átomos extraños o moléculas de la atmósfera circundante. Por ejemplo, en la mica la energía superficial del material recién dividido en vacío es mucho mayor que la energía superficial de la misma superficie dividida en el aire. En este caso, el oxígeno es adsorbido del aire para satisfacer parcialmente los enlaces rotos en la superficie. La adsorción de átomos de impurezas hace que sea casi imposible mantener superficies atómicamente limpias. Como resultado, las propiedades superficiales como la emisión de electrones, las velocidades de evaporación y las tasas de reacciones químicas son extremadamente dependientes de la presencia de cualquier impureza adsorbida. Estas propiedades serán diferentes si las mediciones se realizan bajo condiciones que dan diferente adsorción superficial.
Límites de grano
Los límites de grano separan regiones de diferente orientación cristalográfica. La forma más simple de un límite de grano es una interfaz compuesta por una matriz paralela de dislocaciones de borde. Este tipo particular de límite se denomina límite de inclinación porque la desorientación es en forma de una simple inclinación alrededor de un eje, paralelo a las dislocaciones. Los límites de inclinación se conocen como límites de ángulo bajo porque el ángulo de desorientación es generalmente menor que\(10^{\circ}\).
Cuando un límite de grano tiene una desorientación mayor que\(10^{\circ}\) o\(15^{\circ}\), ya no es práctico pensar que el límite está constituido por dislocaciones porque el espaciamiento de las dislocaciones sería tan pequeño que perdería su identidad individual. El límite de grano representa una región de unos pocos diámetros atómicos de ancho donde hay una transición en la periodicidad atómica entre cristales o granos adyacentes.
Los límites de grano tienen una energía interfacial debido a la interrupción en la periodicidad atómica en las proximidades del límite y los enlaces rotos que existen a través de la interfaz. La energía interfacial de los límites de grano es generalmente menor que la de una superficie libre porque los átomos en un límite de grano están rodeados por todos lados por otros átomos y tienen solo unos pocos enlaces rotos o distorsionados.
Los sólidos con límites de grano se denominan policristalinos, ya que la estructura está compuesta por muchos cristales, cada uno con una orientación cristalográfica diferente. En el caso del hierro la estructura del límite del grano puede ser revelada por ataque químico preferencial (grabado) en los límites del grano, mientras que la estructura del grano en polietileno se revela por el uso de luz polarizada. La estructura del grano generalmente se especifica dando un diámetro promedio de grano o usando un esquema desarrollado por la Sociedad Americana de Pruebas y Materiales (ASTM). En el procedimiento ASTM el tamaño de grano se especifica mediante un “número de tamaño de grano” (n) donde
\[N=2^{n-1}\]
con\(\mathrm{N}\) igual al número de granos por pulgada cuadrada cuando la muestra se ve con un aumento de 100X. Por ejemplo, a un aumento de\(X=100\), un material con tamaño de grano número 8 mostrará 128 granos por pulgada\({ }^2\); este material en efecto tiene (at\(X=1\))\(1.28 \times 10^6\) granos por pulgada cuadrada. Si los granos son aproximadamente cuadrados en sección transversal, esto corresponde a una dimensión promedio de grano de\(8.8 \times 10^{-4} \mathrm{in}^*\).
En muestras policristalinas, los granos individuales suelen tener una orientación cristalográfica aleatoria entre sí, y la estructura del grano se conoce como orientada aleatoriamente. En algunos casos, sin embargo, todos los granos tienen la misma orientación dentro de unos pocos grados. En este caso se dice que el material tiene una orientación o textura preferida.
Límites de fase
Una fase se define como una porción homogénea, físicamente distinta y mecánicamente separable del material con una composición química y estructura dadas. Las fases pueden ser soluciones sólidas sustitutivas o intersticiales, aleaciones o compuestos ordenados, sustancias amorfas o incluso elementos puros; una fase cristalina en estado sólido puede ser policristalina o existir como monocristal.
Los sólidos compuestos por más de un elemento pueden -y a menudo lo hacen- consistir en varias fases. Por ejemplo, el taladro de un dentista, algo dolorosamente familiar para todos nosotros, consiste en una mezcla de pequeños cristales individuales de carburo de tungsteno rodeados por una matriz de cobalto. Aquí el cobalto forma una fase continua. Los materiales polifásicos, como el taladro del dentista, generalmente se denominan materiales compuestos. Los materiales compuestos tienen gran importancia en el mundo de la ingeniería porque tienen muchas propiedades atractivas que los distinguen de los materiales monofásicos. Por ejemplo, la broca del dentista tiene buenas características abrasivas (debido a las partículas de carburo duro) y buena tenacidad y resistencia al impacto (debido a la matriz continua de cobalto). Ni el carburo de tungsteno ni el cobalto tienen resistencia a la abrasión y resistencia al impacto, sin embargo, la combinación adecuada de las dos fases produce una estructura compuesta con las propiedades deseadas.
- *
-
¡ASTM aún no ha emitido especificaciones en unidades SI!
La naturaleza de la interfaz que separa varias fases es muy parecida a un límite de grano. Los límites entre dos fases de diferente composición química y diferente estructura cristalina son similares a los límites de grano, mientras que los límites entre diferentes fases con estructuras cristalinas similares y orientaciones cristalográficas pueden ser análogos a los límites de grano de bajo ángulo tanto en energía como en estructura.
El concepto de un sólido consistente en una fase continua y una fase discontinua (o fases) conduce a una clasificación simple de los diversos tipos de materiales compuestos. En el Cuadro 1 se da esta clasificación, la cual se basa en la estructura (ya sea amorfa o cristalina) de las fases continua y discontinua.
CUADRO 1
Clasificación de materiales compuestos o multifásicos
\ (\ begin {array} {lll}
\ text {Fase Continua} &\ begin {array} {l}
\ text {Fase Discontinua}\\
\ text {(o Fases)}
\ end {array} &\ text {Ejemplos}\\ hline
\ text {Cristalino} &\ text {Cristalino} &\ begin { array} {l}
\ texto {Todos los sistemas metálicos como el fundido}\
\\ texto {hierro, acero, soldadura blanda, etc.; la mayoría}
\\\ texto {rocas naturales como granito y}\
\\ texto {mármol.}
\ end {array}\\\
\ texto {cristalino} &\ text {Amorfo} &\ text {Ninguno de significado práctico.}\\\\
\ text {Amorfo} &\ text {Cristalino} &\ begin {array} {l}
\ text {La mayoría de las cerámicas hechas por el hombre como}
\\\ text {como ladrillos de construcción y eléctricos}
\\\ texto {aislante porcelana, hormigón,}\\
\ texto {polímeros parcialmente cristalinos,}\\
\ texto {alguna partícula polímero-cristalina}\\
\ texto {compuestos.}\ end {array}
\\\\ text {amorfo} &
\ text {amorfo} &\ text {amorfo} &\ begin {array} {l}
\ text {Fibra de vidrio, asfalto, madera,}\\
\ texto {cemento hidratado, otros geles.}
\ end {array}\ end {array}
\ end {array}\)


