4.2: Examen 2
- Page ID
- 80042
Problema 1 (17 PUNTOS)
a. Usa el hecho de que\(\mathrm{SeOF}_2\) es piramidal trigonal para escribir la Estructura Lewis Dot, incluyendo pares solitarios, para\(\mathrm{SeOF}_2\). (3 puntos)
b. A continuación se muestra un dibujo de dos aminoácidos diferentes, Metionina y Lisina, sin ningún par solitario dibujado.
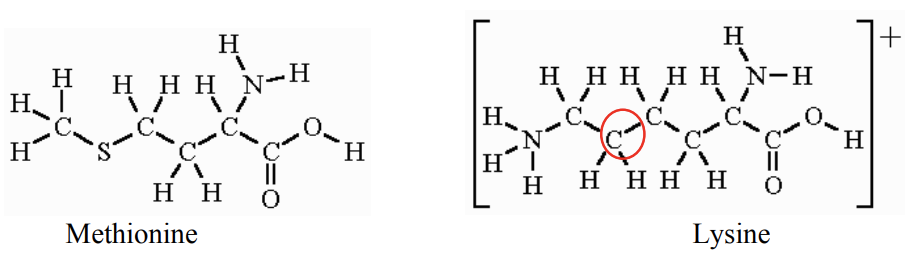
Nombra la geometría VSEPR alrededor de los siguientes átomos centrales:
i.El azufre en metionina (2 puntos)
II.El carbono en un círculo en lisina. (2 puntos)
III. ¿Cuál de estos ángulos es más pequeño? Explique por qué o por qué no en UNA frase. (2 puntos)
\[\mathrm{CH}_2-\mathrm{S}-\mathrm{CH}_2 \quad \mathrm{OR} \quad \mathrm{CH}_2-\mathrm{CH}_2-\mathrm{CH}_2 \nonumber\]
c. A continuación se muestra una estructura para la molécula\(\left[\mathrm{CH}_6 \mathrm{~N}_3\right]^{+}\)
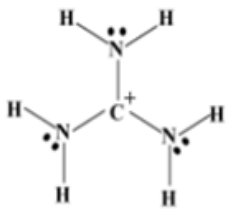
i. Hay otras tres estructuras resonantes para esta molécula; ¿qué son? (6 puntos)
ii. La estructura por la que te dimos\(\left[\mathrm{CH}_6 \mathrm{~N}_3\right]^{+}\) contribuye menos a la unión general de la molécula (es la menos estable). ¿Por qué? (2 puntos)
Problema 2 (23 PUNTOS)
\(\mathrm{NaCl}\)es un compuesto que forma una estructura de sal de roca (celda unitaria a continuación). El radio de los\(\mathrm{Na}^{+}\) átomos es\(1.16 \AA\); el radio de los\(\mathrm{Cl}^{-}\) átomos es\(1.67 \AA\left(1 \AA=10^{-10} \mathrm{~m}\right)\).
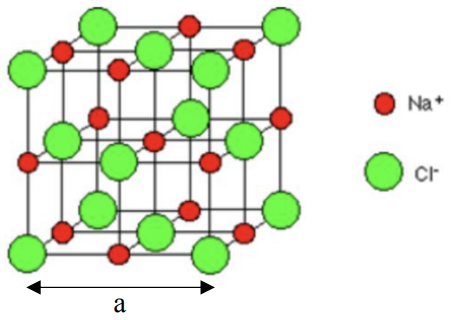
a. Nombrar la celosía Bravais (tipo celosía) de\(\mathrm{NaCl}\). ¿Cuál es la base? (2 puntos)
b. ¿Cuántos\(\mathrm{Na}^{+}\) iones hay en la celda unitaria? ¿Cuántos\(\mathrm{Cl}^{-}\) iones? (4 puntos)
c. Determinar la dirección de empaquetamiento cerrado de esta estructura y utilizarla para calcular el parámetro de celosía, a. (3 puntos)
d. Empate (211), [0\(\bar{2}\) 1], [301], y (1\(\bar{1}\) 0) en las casillas siguientes. Asegúrese de etiquetar cuál es cuál. (8 puntos)
e. ¿Cuál de los planos de la parte d está más cerca en distancia de su plano equivalente en una celda vecina? Muestra cómo llegaste a esta respuesta. (4 puntos)
f. Usando el factor de empaque atómico, explique por qué el calcio es más denso que el potasio. (2 puntos)
Problema 3 (18 PUNTOS)
a. Clasificar las siguientes fuerzas intermoleculares en términos de su resistencia relativa promedio: dispersión de Londres, enlaces de hidrógeno, dipolo-dipolo y dipolo inducido por dipolo. (4 puntos)
1. ___________________ (más fuerte)
2. ___________________
3. ___________________
4. ___________________ (más débil)
Tienes las cuatro moléculas siguientes en forma líquida en tu gabinete de laboratorio.
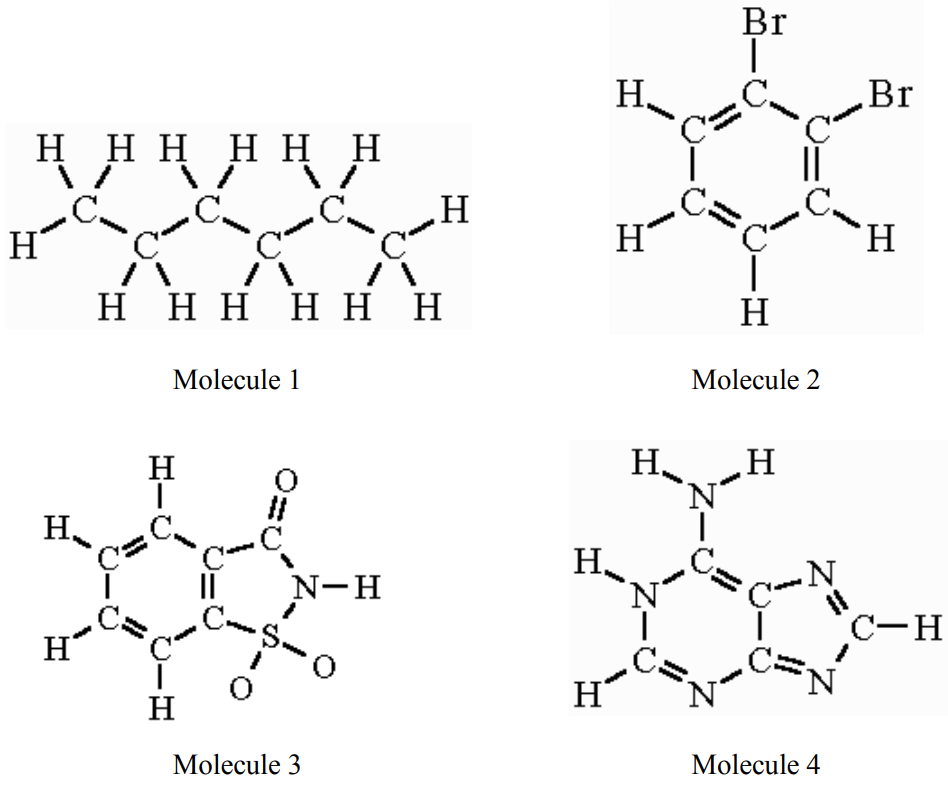
b. ¿Cuál tiene el punto de ebullición más alto? (2 puntos)
c. Haces una mezcla de dos de los líquidos.
i. Si quisieras que tu mezcla tuviera el punto de ebullición más bajo posible, ¿cuáles dos de las cuatro moléculas elegirías? (4 puntos)
ii. Si quieres que tu mezcla tenga el punto de ebullición MÁS ALTO posible, ¿cuáles dos de las cuatro moléculas elegirías? (4 puntos)
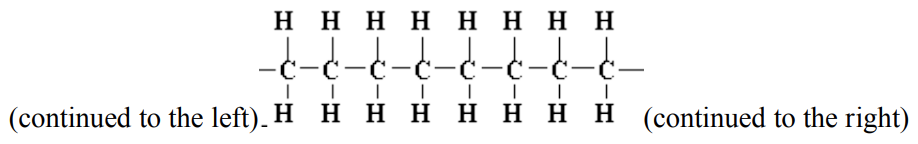
d. tiene dos muestras de polietileno, un polímero hecho de cadenas de carbono e hidrógeno, como se muestra a continuación. Para una muestra, cada cadena molecular tiene 50 unidades de longitud y en la siguiente muestra, cada cadena tiene 500 unidades de longitud. ¿Qué muestra de plástico será más fuerte? ¿Por qué? (4 puntos)
Problema 4 (21 PUNTOS)
a. En esta figura se muestran los orbitales moleculares de una molécula diatómica de segunda fila. Etiquételos cada uno como\(\sigma, \sigma^*, \pi\), o\(\pi^*\) rellenando las cajas provistas. (Los orbitales\(2 \mathrm{p}\) y\(2 \mathrm{~s}\) atómicos están etiquetados como referencia). (6 puntos)
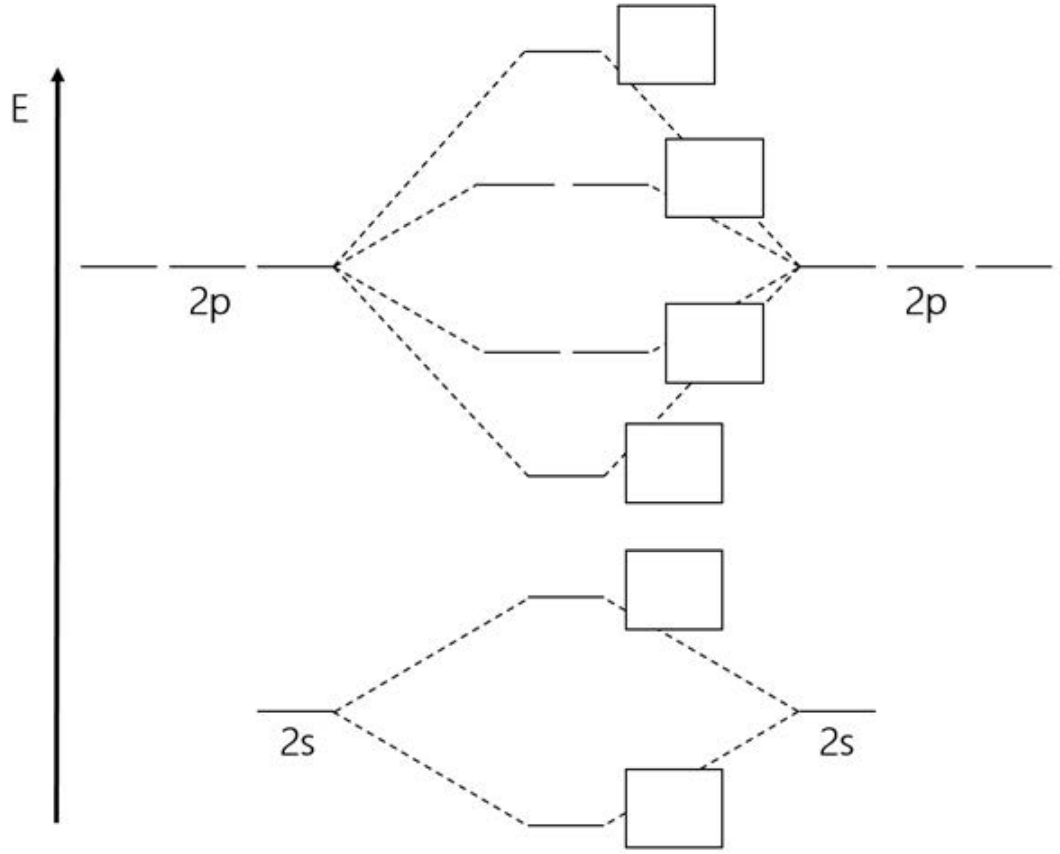
b. Círculo a cuál de los siguientes esquemas de diagrama MO podría corresponder. (2 puntos)
\(\mathrm{C} - \mathrm{C}\)\(\mathrm{N} - \mathrm{O}\)\(\mathrm{H} - \mathrm{F}\)
c. Clasifique las siguientes moléculas en términos de estabilidad:\(\mathrm{Li}_2, \mathrm{Be}_2 \mathrm{~B}_2, \mathrm{C}_2\) Asegúrese de mostrar su trabajo (sin necesidad de mostrar diagramas MO). (8 puntos)
d. El acrilonitrilo es una materia prima química utilizada para la fabricación de polímeros de “nitrilo”. A continuación se muestra su estructura química. ¿Cuál es la hibridación de los átomos en un círculo? (3 puntos)
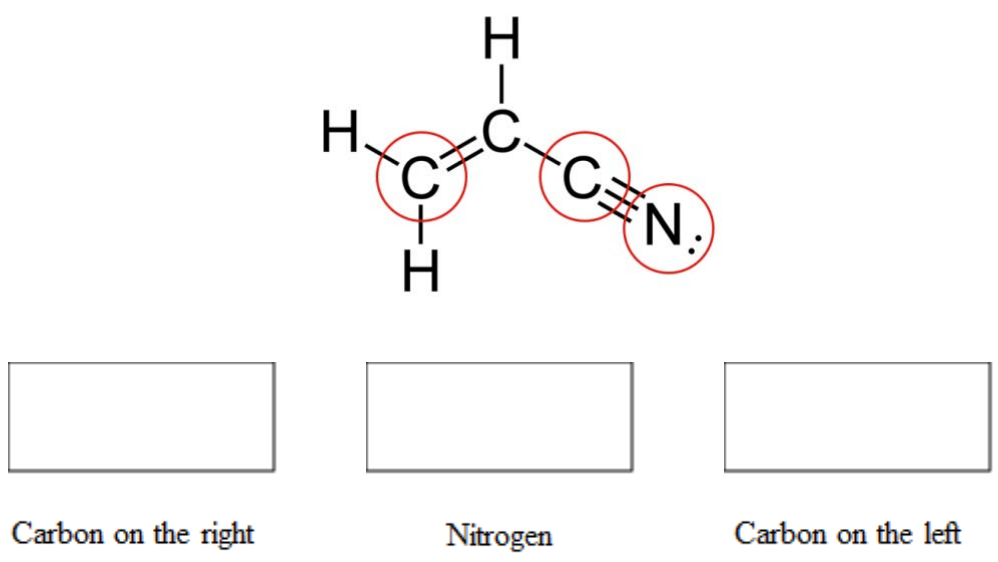
d. Dar el número total de\(\sigma\) enlaces y el número total de\(\pi\) enlaces en acrilonitrilo. (2 puntos)
Problema 5 (21 PUNTOS)
a. La luz UV corresponde a las longitudes de onda de\(10-400 \mathrm{~nm}\). ¿Cuál es el rango de bandas que corresponden a la luz UV? (3 puntos)
b. solo tienes dos materiales en el laboratorio para construir un LED: GaAs (banda gap\(1.42 \mathrm{eV}\) at\(300 \mathrm{~K}\)) y\(\mathrm{GaN}\) (banda gap\(3.2 \mathrm{eV}\) at\(300 \mathrm{~K}\)). ¿Cuál elegirías como emisor UV? (3 puntos)
c. La luz UV puede dañar los ojos, por lo que decide que por seguridad, su LED también debe emitir en el rango visible. Recuerdas que puedes afinar la brecha de banda aleando tu material. Determine la fracción\(\mathrm{x}\) de GaAs en su aleación de tal manera que\(\mathrm{GaA} \mathrm{s}_{\mathrm{x}} \mathrm{N}_{1-\mathrm{x}}\) emitirá luz roja (longitud de onda\(700 \mathrm{~nm}\)). Recuerde que el hueco de banda de una aleación es el promedio ponderado de los huecos de banda de sus componentes. (3 puntos)
d. Si coloca el\(\mathrm{GaAs}_{\mathrm{x}} \mathrm{N}_{1-\mathrm{x}}\) adyacente a su respuesta de (B), su LED emitirá tanto luz UV como luz roja. No obstante, observas que es muy tenue: decides doparlo con\(\mathrm{Mg}\).
i. ¿Está\(\mathrm{Mg}\) un dopante\(\mathrm{n}\) - o\(\mathrm{p}\) tipo adentro\(\mathrm{GaAs}_{\mathrm{x}} \mathrm{N}_{1-\mathrm{x}}\)? (2 puntos)
ii. Si se droga\(1 \mathrm{~g} \mathrm{GaN}\) con\(\mathrm{Mg}\) tal que el\(1 \mathrm{Mg}\) átomo reemplaza a 1 en cada\(10^6 \mathrm{Ga}\) átomo, ¿cuántos portadores adicionales se producen? ¿Qué tipo de transportistas son estos? (4 puntos)
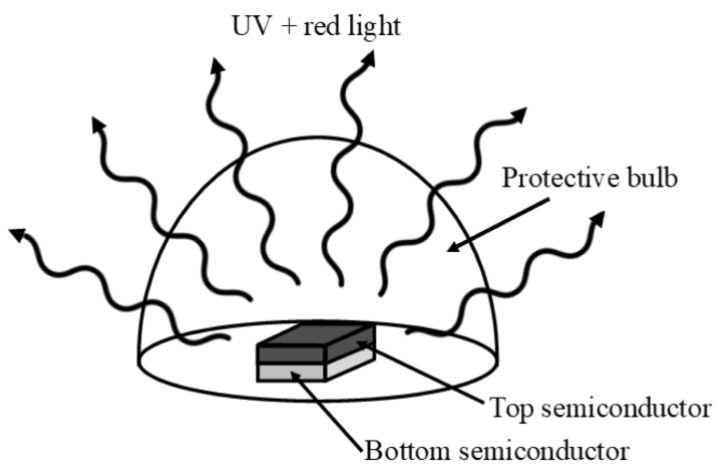
e. para obtener suficiente corriente\(\mathrm{GaAs}_{\mathrm{x}} \mathrm{N}_{1-\mathrm{x}}\) y su respuesta de (B) el procesamiento requiere que los dos estén apilados. ¿Cuál debería estar en la parte superior para garantizar que no se bloquee la luz? (3 puntos)
f. ¿Se espera una mayor dependencia de la temperatura de la conductividad en el dopado o en el no dopado\(\mathrm{GaAsN}\), a temperaturas moderadas? (3 puntos)


