6.23: Ácidos, Bases y Disociación
- Page ID
- 79884
Ácidos y bases
En conferencia, hablamos sobre ácidos y bases de Brønsted-Lowry así como ácidos y bases de Lewis. La definición de BrønstedLowry de ácidos y bases es más estrecha: un ácido de Brønsted-Lowry es un donante de protones, mientras que una base de Brønsted-Lowry es un aceptor de protones: para ser claros aquí, el protón es un ion hidrógeno,\(\mathrm{H}^{+}\). Más generalmente, un ácido de Lewis es un aceptor de electrones, mientras que una base de Lewis es un donador de electrones. El agua es anfótera: puede ser un ácido o una base. El agua sirve como disolvente para muchas reacciones ácido-base. Considere agregar un ácido genérico al agua:
\[H A(a q)+H_2 O(l) \rightarrow H_3 O^{+}(a q)+A^{-}(a q) \nonumber\]
Del mismo modo, considere agregar una base genérica al agua:
\[B^{-}(a q)+H_2 O(l) \rightarrow H B(a q)+O^{-}(a q) \nonumber\]
Éstas sirven como reacciones ácido-base prototípicas: podemos identificar pares ácido-base conjugados para relacionar especies que perdieran/ganaron un protón (o electrón) a cada lado de la reacción.
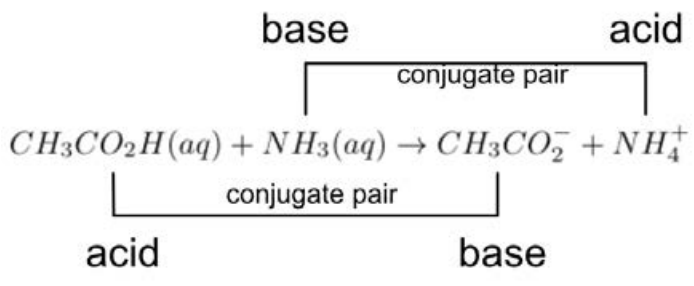
Ejemplo: Identificar los pares ácido-base conjugados en la siguiente reacción:
\(\mathrm{CH}_3\mathrm{CO}_2\mathrm{H} (aq) + \mathrm{NH}_3 (aq) \rightarrow \mathrm{CH}_3\mathrm{CO}_2^{-} + \mathrm{NH}_4^{+}\)
- Contestar
-
Disociación
De la misma manera escribimos una constante de equilibrio general, podemos escribir un equivalente específico de ácido/base. La constante de equilibrio para nuestra reacción de disociación ácida anterior sería
\(K_{e q}=\dfrac{\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{A}^{-}\right]}{\left[\mathrm{H}_2 \mathrm{O}\right][\mathrm{HA}]}\)
Sin embargo, dado que el agua actúa como disolvente y está presente en exceso, tiene una concentración constante: por lo tanto definimos la constante ácida como
\(K_a=K_{e q}\left[H_2 O\right]=\dfrac{\left[H_3 O^{+}\right]\left[A^{-}\right]}{[H A]}\)
Del mismo modo, la constante de dissocación de la base es
\(K_b=\dfrac{[H B]\left[O H^{-}\right]}{[B-]}\)
Cuanto más fuerte es el ácido o la base, más fácilmente se disuelve en solución, y mayor es la magnitud de\(K_a\) o\(K_b\). Solo hay unos pocos ácidos- ácidos fuertes que se disocian completamente en sus iones constituyentes. Estos incluyen\(\mathrm{HCl}, \mathrm{HBr}, \mathrm{HI}, \mathrm{HNO}_3, \mathrm{HClO}_3, \mathrm{HCLO}_4\), y\(\mathrm{H}_2 \mathrm{SO}_4\). Las bases fuertes son en su mayoría sales alcalinas, incluyendo\(\mathrm{LiOH}, \mathrm{NaOH}, \mathrm{KOH}, \mathrm{RbOH}, \mathrm{CsOH}, \mathrm{Ca}(\mathrm{OH})_2, \mathrm{Sr}(\mathrm{OH})_2, \mathrm{Ba}(\mathrm{OH})_2\). Por supuesto, la fuerza de un ácido o base está relacionada con su energía de enlace: los ácidos polares con grandes diferencias en la electronegatividad tienen una baja energía de enlace que se disocian rápidamente cuando se colocan en agua, por ejemplo.
Ejemplo: Escribir una expresión para la disociación y para las constantes de disociación ácida o base para estos ácidos\(\left(\mathrm{HF}, \mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right)\) y bases\(\left(\mathrm{NH}_3, \mathrm{NaOH}\right)\).
- Contestar
-
El ácido fluorhídrico,\(\mathrm{HF}\), es un ácido fuerte. En el agua, el protón se disocia:
\[H F(a q)+H_2 O(l) \rightarrow H_3 O^{+}(a q)+F^{-}(a q) \nonumber\]
Su constante de disociación ácida es
\[K_a=\dfrac{\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{F}^{-}\right]}{[H F]} \nonumber\]
Podemos tomar un enfoque similar para el ácido acético, un ácido débil.
\[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}(a q)+\mathrm{H}_2 \mathrm{O}(l) \rightarrow \mathrm{H}_3 \mathrm{O}^{+}(a q)+\mathrm{CH}_3 \mathrm{CO}_2^{-}(a q) \nonumber\]
La constante de disociación ácida es
\[K_a=\dfrac{\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{CH}_3 \mathrm{CO}_2^{-}\right]}{\left[\mathrm{CH}_3 \mathrm{CO}_2 \mathrm{H}\right]} \nonumber\]
Para el amoníaco, la base gana protón cuando se coloca en agua:
\[\mathrm{NH}_3(a q)+\mathrm{H}_2 \mathrm{O}(l) \rightarrow \mathrm{NH}_4^{+}(a q)+\mathrm{OH}^{-}(a q) \nonumber\]
La constante de disociación de bases para el amoníaco es
\[K_b=\dfrac{\left[\mathrm{NH}_4^{+}\right]\left[\mathrm{OH}^{-}\right]}{\left[\mathrm{NH}_3\right]} \nonumber\]
Finalmente, el hidróxido de sodio disocia completamente:
\[\mathrm{NaOH}(a q)+\mathrm{H}_2 \mathrm{O}(l) \rightarrow \mathrm{Na}^{+}(a q)+\mathrm{OH}^{-}(a q) \nonumber\]
La constante de disociación de bases es
\[K_b=\dfrac{[N a+]\left[\mathrm{OH}^{-}\right]}{[N a O H]} \nonumber\]
Ejemplo: ¿Cuál de estos ácidos es el más fuerte? ácido sulfuroso\(\left(\mathrm{H}_2 \mathrm{SO}_3 ; \mathrm{K}_a=1.54 \times 10^{-2}\right)\), fosfórico\(\operatorname{acid}\left(\mathrm{H}_2 \mathrm{PO}_4^{-} ; \mathrm{K}_a=6.23 \times 10^{-8}\right)\), ácido cítrico\(\left(\mathrm{H}_3 \mathrm{C}_6 \mathrm{H}_5 \mathrm{O}_7 ; \mathrm{K}_a=8.4 \times 10^{-4}\right)\)
- Contestar
-
Los ácidos más fuertes tienen constantes de disociación ácida más grandes, por lo que el ácido sulfuroso es más fuerte que el ácido cítrico y el ácido fosfórico.

