6.25: Polímeros, Polimerización por radicales, Polimerización por condensación y
- Page ID
- 79874
Polímeros
Un polímero es una molécula larga compuesta por muchas (poli) iteraciones de una célula unitaria molecular (mer). Hay muchas perillas disponibles para girar para diseñar un polímero con las propiedades adecuadas. En 3.091, nos centraremos en dos tipos de reacción de polimerización: radical y condensación.
Polimerización radical
Un mecanismo para lograr la polimerización es la polimerización por radicales, una reacción en cadena que se inicia con la introducción de un iniciador con un radical libre. El iniciador se muestra a continuación como\(\mathrm{R}\); más importante que su química es el radical libre, un solo electrón altamente reactivo. La polimerización radicalaria del polietileno se muestra a continuación:
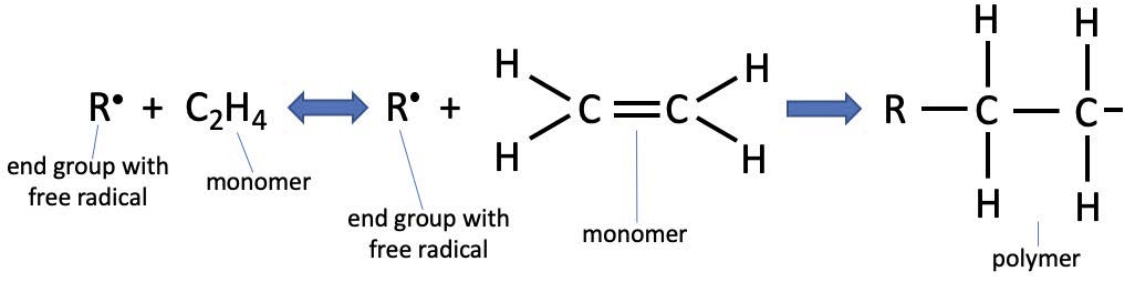
El radical libre introduce un electrón extra al monómero, rompiendo el doble enlace entre los átomos de carbono y propagándose para reaccionar con otro monómero cercano (mostrado como medio enlace en el polímero anterior). Siempre y cuando haya monómero cerca del final de la cadena, la reacción procederá. Por supuesto, como con cualquier reacción, es crítico que se conserve la masa. Podemos verificar dos veces que este es el caso contando electrones. El monómero de polietileno tiene 12 electrones, y con el radical, el sistema tiene 13 electrones. En el cuadro polimerizado, todavía quedan 13 electrones.
La polimerización radical funciona para todo tipo de grupos estéricos, donde estérico se refiere a la disposición espacial de los átomos en una molécula o grupo lateral. Para el polietileno, los grupos laterales estéricos son simplemente átomos de hidrógeno; en general, hay opciones ilimitadas para los grupos laterales. A continuación, la reacción genérica muestra que lo que es realmente importante para que se lleve a cabo una polimerización radical es la presencia de un doble enlace carbono=carbono. El
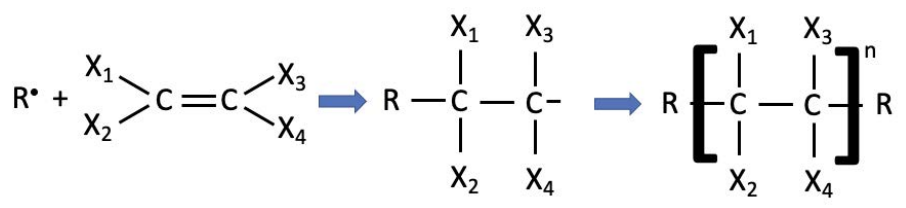
La parte más a la izquierda de la figura muestra una representación generalizada de un polímero: hay grupos en el extremo (simbolizados como\(\mathrm{R}\), pero no necesariamente tienen que ser los mismos), y\(\mathrm{n}\) repiten unidades que conforman la columna vertebral del polímero.
Polimerización
La polimerización por condensación es un tipo de reacción de crecimiento escalonado que ocurre entre unidades monoméricas con grupos terminales que reaccionan para formar agua como subproducto. Los monómeros que reaccionan podrían ser todos iguales, o podrían ser diferentes: esta distinción impacta en el tamaño de la unidad repetida en el polímero que resulta.

Aquí, el mecanismo de reacción de polimerización es que el grupo hidroxilo en el extremo de un monómero reacciona con el hidrógeno que termina el otro monómero. Cada vez que ocurre esta reacción, el polímero resultante crece. La polimerización se puede detener de muchas maneras; por supuesto, cuando se consume todo el monómero o no hay monómeros cerca del final de la cadena para reaccionar, deja de crecer. En este caso, el grupo hidroxilo en un extremo del monómero proviene del monómero terminado en hidroxilo. El otro extremo podría terminar siendo un\(\mathrm{OH}\) grupo o un\(\mathrm{H}\) grupo, dependiendo de cuál sea el monómero terminal- aquí, se dibuja asumiendo que reaccionaron un número par de monómeros. Para cada uno de los\(2n\) monómeros que se suman a la cadena, se forma una molécula de agua como subproducto: esto le da el nombre de reacción de condensación. Alternativamente, podría tener lugar un proceso similar si todas las unidades monoméricas están terminadas con grupos hidroxilo:

Aquí se aplican las mismas advertencias: no hay nada especial en tener dos monómeros diferentes; podría ser fácilmente un solo monómero o muchos más. La diferencia clave en este caso es que hay un oxígeno extra en el extremo de uno de los monómeros cuando el agua se condensa: esto se integra en la cadena principal como se muestra, y da como resultado un polímero que es terminado por un grupo hidroxilo en ambos extremos.
Estos ejemplos se entienden simplemente como ilustraciones. Con tanta flexibilidad en cuanto a la elección de grupos monómeros, mezclas y condiciones de reacción, realmente hay todo un mundo de propiedades que se pueden diseñar.
Propiedades del polímero
La tesis de muchos esfuerzos en la ciencia de los materiales es que la estructura dicta propiedades, y los polímeros no son la excepción. Tenemos que observar tanto la química de los monómeros como las condiciones específicas de polimerización y procesamiento para comprender la estructura electrónica y molecular, lo que a su vez proporciona información sobre las propiedades micro y macroscópicas del material que resulta.
Composición monomérica: el tamaño y la composición de los grupos laterales pueden desempeñar un papel importante en la fuerza con la que se empaqueta un polímero. Si hay grupos grandes (con mucho volumen estérico), las cadenas principales de las cadenas poliméricas no pueden sentarse muy juntas, lo que resulta en un menor grado de cristalinidad.
IMF: así como el tamaño de los grupos laterales juega un papel, la composición puede afectar lo estrechamente unidas que están las cadenas vecinas entre sí. Por ejemplo, las cadenas de polietileno, con solo\(\mathrm{H}\) para grupos laterales, se deslizan entre sí mucho más fácilmente que las cadenas con grupos laterales que son polares o pueden formar enlaces de hidrógeno.
Estructura de la cadena principal: dependiendo de cómo se lleve a cabo la reacción específica, las cadenas poliméricas resultantes pueden terminar siendo lineales o ramificadas. Los polímeros ramificados se empaquetan menos densamente: se puede pensar en los polímeros ramificados como un lío enredado de ramas de árboles, mientras que los polímeros lineales son ramas que se han cortado en trozos rectos y apiladas.
Longitud de la cadena: las cadenas más cortas pueden deslizarse más fácilmente entre sí y moverse, mientras que las cadenas largas se enredan. Es más difícil separar un polímero compuesto por cadenas largas. Si las cadenas largas de polímero son un lío enredado de espaguetis cocidos, las cadenas cortas son como los macarrones. La longitud de cadena que resulta de una reacción de polimerización dada se denomina grado de polimerización, y a menudo es ventajoso tratar de diseñar la distribución resultante de longitudes de cadena para que sea lo más estrecha posible.
Tacticidad: la tacticidad de un polímero se refiere a cómo se disponen los grupos laterales: si todos en el mismo lado, es isotáctico. Si los grupos alternan posiciones, el polímero es sindiotáctico, y si están dispuestos aleatoriamente, es atáctico.

