4.8: Problemas
- Page ID
- 72241
1. Equilibrar las siguientes reacciones redox, añadiendo H 2 O y H + (u OH -) según sea necesario. Predecir para cada uno si la reacción se volvería más o menos espontánea a pH más alto.
(a)\(\ce{MnO4^{-}_{(aq)} + N2O_{(g)} = Mn^{2+}_{(aq)} + NO3^{-}_{(aq)}}\) (en ácido)
b)\(\ce{Cr2O7^{2-}_{(aq)} + S2O3^{2-}_{(aq)} = Cr2O3_{(s)} + SO4^{2-}_{(aq)}}\) (en base)
c)\(\ce{H2O2_{(aq)} + HI_{(aq)} = I3^{-}_{(aq)}}\) (en ácido)
d)\(\ce{HOBr_{(aq)} = HBr_{(aq)} + HBrO2_{(aq)}}\) (en ácido)
e)\(\ce{C12H22O11 (sucrose, aq) + ClO3^{-}_{(aq)} = HCO3^{-}_{(aq)} + Cl^{-}_{(aq)}}\) (en base)
2. El metal plateado no se oxida fácilmente y no reacciona con agua saturada de oxígeno. Sin embargo, cuando se agrega exceso de NaCN a una suspensión de partículas de plata, algo de plata se disuelve. Si se elimina el oxígeno (por ejemplo, burbujeando nitrógeno a través de la solución), la reacción de disolución se detiene. Escribir una ecuación equilibrada para la reacción de disolución (pista: es una reacción redox).
3. Los potenciales estándar para los pares Fe 3+ /Fe 2+ y Cl - /Cl 2 son +0.77 y +1.36 V. Calcular el potencial celular de una batería de flujo redox que tiene soluciones Fe 3+ /Fe 2+ y Cl - /Cl 2 en los dos lados (ambos que contiene HCl 1.0 M como electrolito). La presión del gas Cl 2 en el lado del cloro es de 0.2 atm, y las concentraciones de Fe 2+ y Fe 3+ en el lado de hierro son ambas de 0.10 M.
4. El diagrama de potencial de Latimer para yodo (en soluciones ácidas) se da a continuación.

a) ¿Cuál es el potencial de la pareja IO 3 - /I - redox?
(b) Construir un diagrama de escarcha e identificar cualquier especie que sea inestable con respecto a la desproporción.
5. El diagrama Latimer para nitrógeno en soluciones ácidas se muestra a continuación:
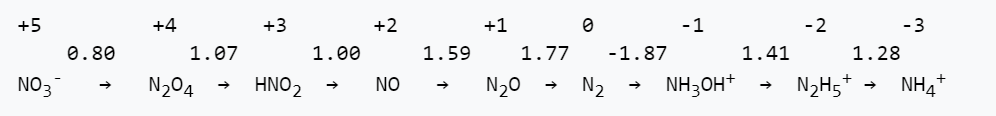
(a) Escribir una media reacción equilibrada para la reducción de NO a NH 4 + en ácido.
b) ¿Cuál es el valor de E o para la media reacción en la parte a)?
c) ¿Esta media reacción es más favorable termodinámicamente en ácido o en base? Explique.
(d) Todas las moléculas e iones que contienen nitrógeno enumerados anteriormente son cinéticamente estables, pero sólo tres son termodinámicamente estables con respecto a la desproporción en ácido. ¿Cuáles son ellos?
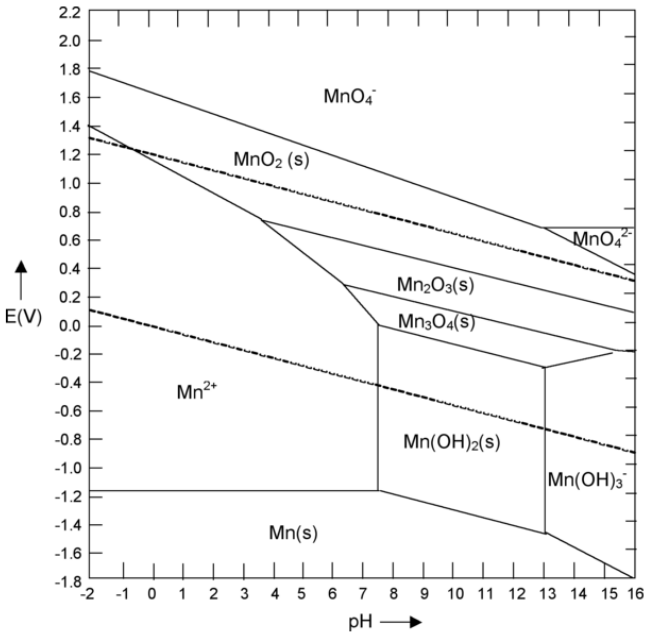
6. Refiriéndose al diagrama de Pourbaix para Mn a continuación:
(a) Escribir la media reacción equilibrada correspondiente a la línea que separa Mn 2+ y Mn 2 O 3. Usa tu respuesta para calcular la pendiente de la línea (dar unidades).
(b) ¿El metal Mn es estable en agua a algún pH? Si es así, ¿en qué rango de pH?
(c) ¿Qué reacción espontánea esperaría de una solución acuosa de MnO 4 - a pH 6?
(d) Describir un procedimiento electroquímico (especificando pH y potencial) para hacer Mn 3 O 4 (s) a partir de Mn 2+ acuoso.
e) Etiquetar las regiones del diagrama que corresponden a la corrosión y pasivación del metal Mn.
7. A continuación se muestra el diagrama de Pourbaix para cobre.
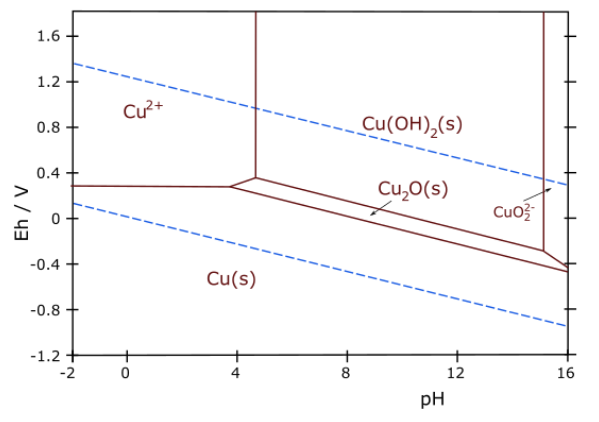
(a) Escribir una media reacción equilibrada que corresponda al límite entre las regiones Cu 2 O (s) y Cu (OH) 2 (s) del diagrama.
(b) Cuál es la pendiente de la línea (¡no intentes medirla a partir de la gráfica!) que conecta las regiones Cu 2+ (aq) y Cu 2 O (s)? Explica tu razonamiento.
c) ¿Sobre qué rango de pH (si lo hay) es estable el cobre metálico en contacto con agua pura?
d) Termodinámicamente, la reacción entre coppper y oxígeno es espontánea a pH 7. ¿Esperaría que el cobre se corroa o se pasivara contra la corrosión en agua aireada a pH neutro? Explica tu razonamiento.
e) Algunos estudios recientes han sugerido el uso de Cu 2 O como fotocatalizador de división de agua. ¿Esperaría que Cu 2 O sea estable ante la presencia del oxígeno formado en la reacción? Explica tu razonamiento.


