5.1: Preludio a la Química de Coordinación y Teoría del Campo Cristalino
- Page ID
- 72334
Los compuestos de coordinación (o complejos) son moléculas y sólidos extendidos que contienen enlaces entre un ion de metal de transición y uno o más ligandos. Al formar estos enlaces covalentes coordinados, los iones metálicos actúan como ácidos de Lewis y los ligandos actúan como bases de Lewis. Típicamente, el ligando tiene un par solitario de electrones, y el enlace se forma por superposición del orbital molecular que contiene este par de electrones con los orbitales d del ion metálico. Los ligandos que se encuentran comúnmente en los complejos de coordinación son moléculas neutras (H 2 O, NH 3, bases orgánicas como piridina, CO, NO, H 2, etileno y fosfinas PR 3) y aniones (haluros, CN -, SCN -, ciclopentadienuro (C 5 H 5 -), H -, etc.). Los complejos resultantes pueden ser catiónicos (e.g., [Cu (NH 3) 4] 2+), neutros ([Pt (NH 3) 2 Cl 2]) o aniónicos ([Fe (CN) 6] 4-). Como veremos a continuación, los ligandos que tienen una fuerza débil o insignificante como bases de Brønsted (por ejemplo, CO, CN -, H 2 O y Cl -) aún pueden ser potentes bases de Lewis en la formación de complejos de metales de transición.
Con ligandos que son bases de Lewis, los enlaces covalentes coordinados (también llamados enlaces dativos) se dibujan típicamente como líneas, o a veces como flechas para indicar que el par de electrones “pertenece” al ligando X:
\(M \leftarrow :X\)
Al contar electrones sobre el metal (descrito a continuación), la convención es asignar ambos electrones en el enlace dativo al ligando, aunque en realidad los enlaces son típicamente covalentes polares y los electrones se comparten entre el metal y el ligando.
|
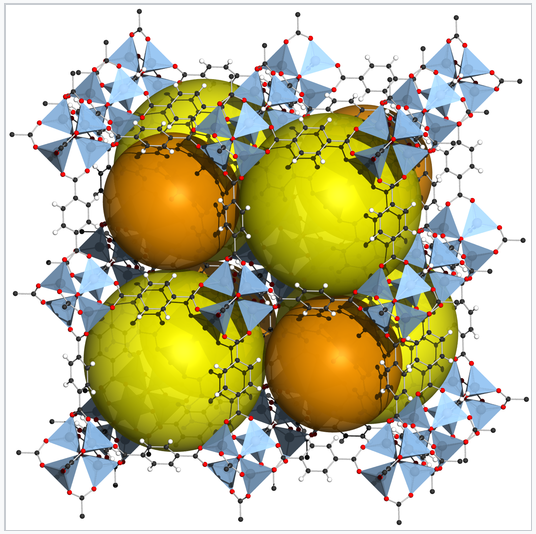
El Zn 4 O (BDC) 3, también llamado MOF-5, es una estructura metal-orgánica en la que aniones 1,4-bencenodicarboxilato (BDC) se unen entre grupos catiónicos de Zn 4 O. [1] El marco rígido contiene grandes huecos, representados por esferas anaranjadas. Los MOF se pueden hacer a partir de muchos iones de metales de transición y ligandos de puente diferentes, y se están desarrollando para aplicaciones prácticas en el almacenamiento de gases, especialmente H 2 y CO 2. MOF-5 tiene una densidad volumétrica de almacenamiento de 66 g H 2 /L, cercana a la del líquido H 2. |
Al escribir las fórmulas de los compuestos de coordinación, utilizamos corchetes [... ] alrededor de los iones metálicos y ligandos que están directamente unidos entre sí. Así, el compuesto [Co (NH 3) 5 Cl] Cl 2 contiene iones octaédricos [Co (NH 3) 5 Cl] 2+, en los que cinco moléculas de amoníaco y un ión cloruro se unen directamente al metal, y dos aniones Cl - que no están coordinados al metal.
Historia
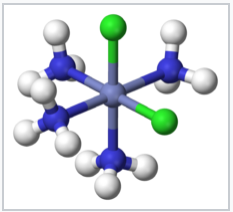
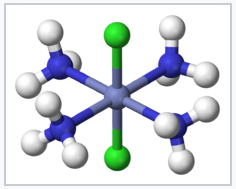
Los compuestos de coordinación se conocen desde hace siglos, pero sus estructuras inicialmente no se entendieron. Por ejemplo, el Azul Prusia, que tiene una fórmula empírica Fe 7 (CN) 18 •xH 2 O, es un sólido insoluble de color azul profundo que ha sido utilizado como pigmento desde su descubrimiento accidental por Diesbach en 1704. El azul prusiano en realidad contiene cationes Fe 3+ y aniones [Fe (CN) 6] 4-, y una formulación más descriptiva es (Fe 3+) 4 ([Fe (CN) 6] 4-) 3 •xH 2 O. Compuestos más simples como el complejo de amoníaco de Los químicos conocían el Co 3+ pero no se ajustaban al comportamiento esperado de los sólidos iónicos. Por ejemplo, cloruro de cobalto (III) hexammina, [Co (NH 3) 6] Cl 3 se formuló como CoCl 3 •6NH 3. Tenía propiedades misteriosas, ya que se disolvía en agua como un sólido iónico, pero retuvo sus seis moléculas de amoníaco cuando se recristalizó. Aún más intrigante fue la observación de que se podían hacer formas químicamente diferentes (isómeros) de complejos de metales de transición como [Co (NH 3) 4 Cl 2] Cl. El rompecabezas fue resuelto por Alfred Werner, quien propuso en 1893 que estos complejos de Co contenían iones metálicos coordinados octaédricamente que hacían enlaces primarios (covalentes) a seis ligandos. Werner mostró a través de mediciones de conductividad que las soluciones de CoCl 3 •6NH 3 contenían tres aniones Cl - libres y un catión [Co (NH 3) 6] 3+ por unidad de fórmula. Las mediciones de susceptibilidad magnética confirmaron posteriormente la presencia de Co 3+ diamagnético tanto en la sal como en sus soluciones. La teoría de Werner también explicó la existencia de dos (y sólo dos) isómeros estructurales para [Co (NH 3) 4 Cl 2] +.
|
cis - [Co (NH 3) 4 Cl 2] + |
|
trans - [Co (NH 3) 4 Cl 2] + |
Al igual que los compuestos orgánicos, los complejos de metales de transición pueden variar ampliamente en tamaño, forma, carga y estabilidad. Veremos que los enlaces formados a partir de los orbitales d del metal controlan en gran medida estas propiedades.
|
Alfred Werner fue un químico suizo que recibió el premio Nobel en 1913 por dilucidar la unión en los compuestos de coordinación. |