3.3: Examen 3
- Page ID
- 74710
1. (29 pts) A continuación se muestra el sulfuro de fósforo estable más simple, trisulfuro tetraposforoso, P 4 S 3. Se listan las bandas observadas en los espectros IR y Raman de P 4 S 3 en fase gaseosa, fusión y solución.
|
Datos infrarrojos: ν/cm -1 |
Gas (550 °C) |
Datos Raman: Δ/cm -1 Fundido (250 °C) CS 2 (25 °C) |
|
| 142 | |||
|
184 |
187 | ||
| 218 | 221 | 218 | 223 |
| 286 | 292 | 287 | 291 |
| 339 | 347 | 339 | 343 |
| 414 | 420 | 420 | 423 |
| 438 | 446 | 440 | 444 |
a. (20 pts) Determinar los modos normales de vibración para P 4 S 3 y cómo se transforman.
b. (9 pts) ¿Cuáles son Raman e IR activos?
2. (41 pts) Un análisis orbital molecular de complejos de dihidrógeno de metales de transición proporciona una visión crítica de las interacciones de enlace entre metales e hidrógeno y estableció un marco elegante en el que se puede interpretar la reactividad entre H 2 y complejos de metales de transición.
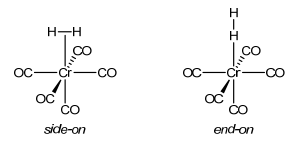
a. (10 pts) Construir el diagrama orbital molecular de un Cr (CO) 5 (H 2) unido de lado a partir de orbitales de fragmentos grupales.
b. (6 pts) Ilustrar pictóricamente las interacciones σ y π que estabilizan la formación del complejo de dihidrógeno.
c. (15 pts) Estas interacciones pueden ser utilizadas de manera efectiva para racionalizar varios aspectos de la química del dihidrógeno TM. Al respecto, expliquen las siguientes observaciones:
i. (5 pts) d 6 metales parecen formar los complejos de dihidrógeno TM más estables
ii. (5 pts) muchos complejos de dihidrógeno TM sintetizados hasta la fecha tienen ligandos auxiliares aceptores de p
iii. (5 pts) los metales de transición de la primera fila estabilizan los compuestos de dihidrógeno mientras que los metales de la tercera fila tienden a promover compuestos
d. (10 pts) Construir el diagrama MO para un complejo H 2 unido al extremo; y explicar por qué (usando los diagramas MO de extremo y lado) los complejos finales no son favorecidos energéticamente en relación con los complejos laterales.
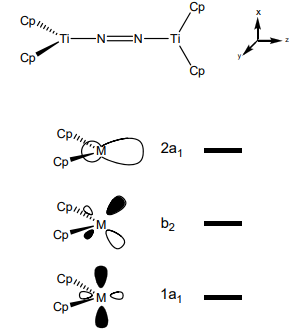
3. (30 pts) La química del nitrógeno de los metales de transición temprana se estableció con la preparación de los complejos de Ti del grupo Bercaw en Caltech a mediados de la década de 1970. A continuación se muestra uno de los compuestos. Construir el diagrama orbital molecular cualitativo para el complejo dinuclear de titanio a partir de los orbitales fronterizos del fragmento Cp 2 Ti doblado (en simetría C 2v) y los orbitales moleculares fronterizos apropiados de nitrógeno. Marcar el MO con etiquetas de simetría apropiadas, identificar la naturaleza del enlace (es decir, σ, σ*, π, π*) y llenar el MO con el número apropiado de electrones.