5.4: Grupo 13 Metales
- Page ID
- 71647
El aluminio, Al, entre los metales del Grupo 13 (Cuadro\(\PageIndex{4}\)) existe como aluminosilicatos en la corteza terrestre y es más abundante que el hierro. El mineral más importante para la metalurgia es la bauxita, AlO x (OH) 3-2x (0 < x < 1). Si bien el metal Al era tan valioso como los metales nobles en el siglo XIX, el precio bajó drásticamente después de que llegó a fabricarse en grandes cantidades por electrólisis de alúmina, Al 2 O 3, fundida en criolita, Na 3 AlF 6. Sin embargo, debido a que su producción requiere el consumo de una gran cantidad de energía eléctrica, la metalurgia del aluminio es económicamente factible solo en países donde el precio de la energía eléctrica es bajo. Por lo tanto, Japón se ha retirado de la fundición de aluminio, pero el consumo del metal por parte de Japón es el segundo después de Estados Unidos. Las propiedades del aluminio son bien conocidas ya que es ampliamente utilizado y encontrado en la vida cotidiana, por ejemplo en monedas de un yen, papel de aluminio, sartenes para cocinar, fajas de aluminio para ventanas, etc. El metal de aluminio suele superar el 99% de pureza, y el metal en sí y sus aleaciones, como el duraluminio, son ampliamente utilizados.
| mp (°C) |
bp (°C) |
d (20 °C) (g cm -3) |
E 0 (V) M 3+ +3e - |
Yo primero |
(kJ mol -1) segundo |
tercero |
|
|---|---|---|---|---|---|---|---|
| Al | 660 | 2519 | 2.70 | -1.66 | 577 | 1816 | 2744 |
| Ga | 29.8 | 2204 | 5.90 | -0.55 | 579 | 1979 | 2962 |
| En | 157 | 2072 | 7.31 | -0.34 | 558 | 1820 | 2704 |
| Tl | 304 | 1473 | 11.9 | +0.74 | 589 | 1971 | 2877 |
El aluminio metálico se disuelve en ácidos minerales, excepto el ácido nítrico concentrado, y en soluciones acuosas de hidróxidos de metales alcalinos que producen hidrógeno. El aluminio forma compuestos con la mayoría de los elementos no metálicos y muestra una rica química, pero a diferencia del boro, no se conocen hidruros de racimo. Como ya se han descrito óxidos y haluros (4.3 (c), 4.5 (d)), aquí se mencionarán los compuestos de órgano-aluminio.
Compuestos organoalumínicos
Los compuestos de organoaluminio se utilizan en grandes cantidades para la polimerización de olefinas, y se fabrican industrialmente a partir de aluminio metálico, hidrógeno y una olefina de la siguiente manera.
\[\ce{2 Al + 3 H2 + 6 CH2 = CHR \rightarrow Al_{2} (CH2CH2R)6}\]
Son dímeros excepto aquellos con grupos hidrocarbilos voluminosos. Por ejemplo, el trimetilaluminio, Al 2 (CH 3) 6, es un dímero en el que los grupos metilo unen átomos de aluminio por enlaces deficientes en electrones (Figura\(\PageIndex{2}\)).
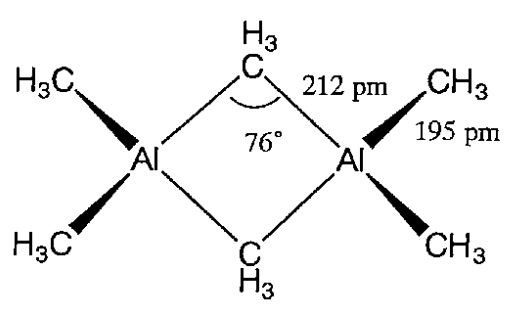
Los compuestos de organanoaluminio son muy reactivos y se queman espontáneamente en el aire. Reaccionan violentamente con el agua y forman hidrocarburos saturados, cambiando el aluminio a hidróxido de aluminio de la siguiente manera.
\[\ce{Al(CH2CH3)3 + 3 H2O \rightarrow 3 C2H6 9 Al(OH)3}\]
Por lo tanto, deben manejarse en el laboratorio bajo una atmósfera perfectamente inerte. El catalizador Ziegler-Natta, que comprende un compuesto de organoaluminio y un compuesto de metal de transición, fue un catalizador de polimerización de olefinas de época desarrollado en la década de 1950, por lo que se otorgó el premio Nobel (1963).
Se forma un compuesto de alquilo de metal de transición cuando un compuesto de organoaluminio reacciona con un compuesto de metal de transición. El compuesto alquilo de metal de transición así formado puede aislarse cuando los ligandos de estabilización se coordinan con el centro metálico.
El galio, Ga, tiene la mayor diferencia de temperatura entre el punto de fusión y el punto de ebullición entre todos los metales. Al fundirse ligeramente por encima de una temperatura ambiente, el rango de temperatura del estado líquido es muy amplio y se utiliza como termómetro de alta temperatura. En los últimos años, el metal se utiliza para la fabricación de los semiconductores compuestos arseniuro de galio, GaAs, y fosfuro de galio, GaP.
Indio, In, es un metal blando también con un bajo punto de fusión. Es la materia prima para los semiconductores compuestos InP, INAs, etc. El indio tiene dos estados estables, In (I) o In (III), e In (II) los compuestos se consideran compuestos de valencia mixta de In monovalentes y trivalentes.
El talio, Tl, también tiene dos estados estables, Tl (I) y Tl (III), y Tl (II) es un compuesto de valencia mixta de Tl monovalente y trivalente. Dado que el elemento es muy venenoso el metal y sus compuestos deben manejarse con cuidado. Al tratarse de un reductor débil en comparación con Na (C 5 H 5), el ciclopentadienuro de talio, Tl (C 5 H 5), a veces se utiliza para la preparación de compuestos de ciclopentadienilo, siendo un reactivo útil en química organometálica.
Ejercicio\(\PageIndex{3}\)
Demos el ejemplo de los metales para los que existen iones estables que difieren en los números de oxidación.
- Contestar
-
En (I), En (III), Tl (I), Tl (III), Sn (II), Sn (IV).
La reacción de los compuestos organoalumínicos
Los compuestos de organoaluminio se sintetizaron por primera vez en 1859, pero no se consideraron tan importantes como los reactivos de Grignard o los compuestos de organolitio como reactivos sintéticos durante algún tiempo. Esto se debe en parte a la baja reactividad de los aductos de éter, R 3 Al: OEt 2, que estuvieron presentes por el uso frecuente de éter como disolvente. Los estudios de K. Ziegler cambiaron esta situación. K. Ziegler también descubrió la oligomerización de etileno por compuestos de organoaluminio y la formación de compuestos de organoaluminio superiores por la inserción de etileno en enlaces aluminio-carbono. Dado que los alcoholes se formaron por hidrólisis de compuestos organoalumínicos, estos descubrimientos fueron importantes para la síntesis orgánica.
El descubrimiento de la acción de trazas de níquel en el recipiente de reacción para dar solo buteno a partir del etileno condujo a la investigación del efecto de los metales de transición sobre esta reacción. Se examinaron muchas sales de metales de transición y Ziegler descubrió que los compuestos de titanio daban el mayor grado de polimerización del etileno. Este fue el nacimiento de los llamados catalizadores Ziegler. Cabe recordar que este gran descubrimiento de la década de 1950 ocurrió cuando la industria petroquímica comenzaba a desarrollarse y revolucionó la industria química de polímeros superiores.

