11.2.1: Encontrar microestados y símbolos de término
- Page ID
- 81119
Construyendo símbolos de término “iones libres” y sus energías relativas
Los diferentes estados electrónicos de un átomo o ion se describen mediante\(L\) y\(S\) en forma de símbolo de término (Figura\(\PageIndex{1}\)). Tenga en cuenta que\(M_l\) está relacionado con\(L\), y\(M_s\) está relacionado con\(S\), y en algunos casos sus valores son iguales.
Un símbolo de término puede describir uno o más microestados con la misma energía. Los términos de iones libres son útiles en la interpretación de espectros electrónicos. Estos símbolos de término también se denominan comúnmente términos de iones libres (o términos Russell-Saunders) porque describen el estado atómico o iónico, libre de cualquier ligante. El término símbolo indica el momento angular orbital total del átomo, (\(L\)), y la multiplicidad\((2S+1)\),, del estado. La multiplicidad se puede encontrar con la fórmula\((2S+1)\), pero también es igual al número de electrones desapareados más uno.
\[\text{Multiplicity } = \left( 2S+1 \right) = \left( \text{# of unpaired electrons }+1 \right)\]
La forma genérica de un símbolo de término de iones libres se muestra en la Figura\(\PageIndex{1}\). Recordemos que\(L=0,1,2, 3...\) se denota con una letra mayúscula\(S, P, D, F...\), respectivamente. Esta última designación para\(L\) se utiliza en el término símbolo.
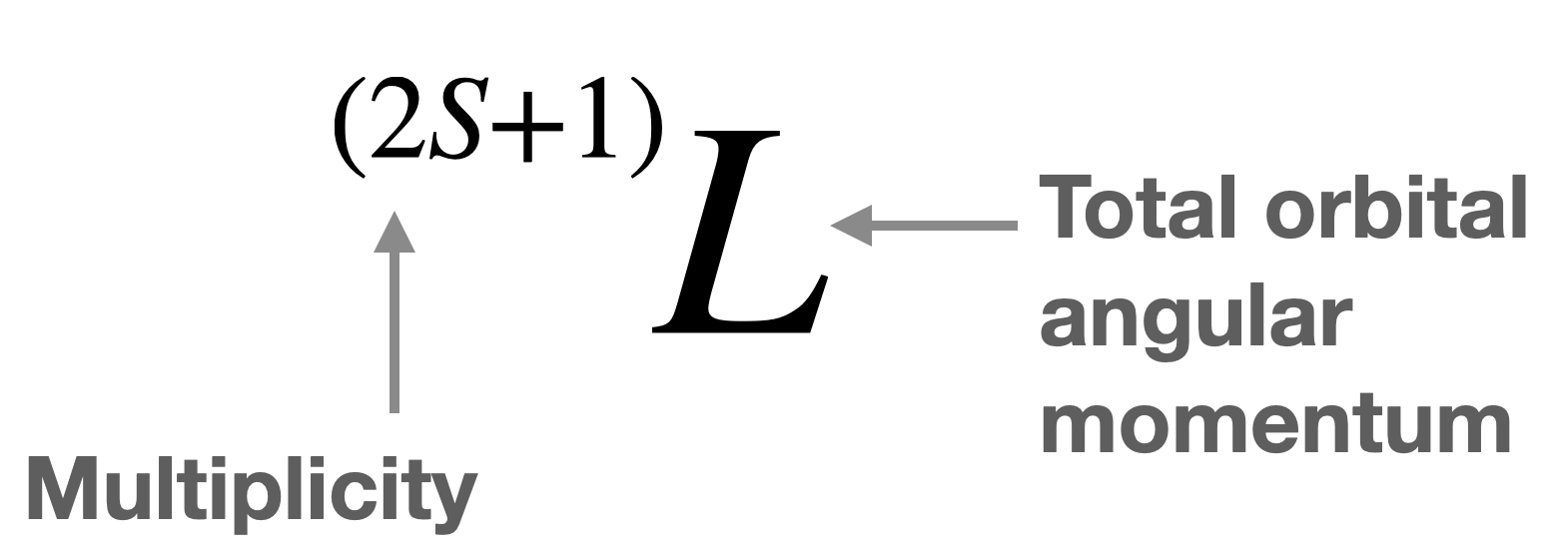
¿Cuál es el símbolo de término ión libre de un átomo de H en el estado fundamental (\(1s^1\))? ¿Cuántos microestados hay para el átomo de hidrógeno del estado fundamental? Comentar sobre la degeneración y multiplicidad del estado.
Solución
Sólo hay un electrón en un\(s\) orbital. Ese electrón debe tener\(l=0\), y\(s\) podría ser cualquiera\(+\frac{1}{2}\) o\(-\frac{1}{2}\). Se trata de dos posibles microestados, uno con spin “up” y otro con spin “down”. En cualquier caso solo hay un valor del número cuántico de espín intrínseco total,\(S=+\frac{1}{2}\). Por lo tanto, el único valor posible de la multiplicidad de espín es Multiplicidad\(=2\times (+\frac{1}{2})+1 = 2\). El\(s\) orbital corresponde a\(l =0\), así\(L=0\), o\(S\). Así el término símbolo es\(^2S\).
Hay dos posibles microestados del estado fundamental (ambos representados por el término estado fundamental). Un microestado tiene\(m_s=+\frac{1}{2}\) y el otro tiene\(m_s=-\frac{1}{2}\).
La pregunta sobre la degeneración se pregunta específicamente sobre la degeneración del estado. Demos la respuesta más completa posible. En cuanto a los niveles de energía (el estado básico en este caso), existen dos microestados con energía aproximadamente igual (degenerada), por lo que la degeneración del estado es dos (2) y es la misma que la multiplicidad (\(2S+1=2\)). Sin embargo, a veces también nos referimos a la “degeneración” de las configuraciones electrónicas. Es importante reconocer que la configuración electrónica del estado fundamental con\(M_s=m_s=+\frac{1}{2}\) es degenerada individualmente, y lo mismo es cierto para\(M_s=m_s=-\frac{1}{2}\). Reconocer la degeneración de las configuraciones electrónicas será útil más adelante en este capítulo porque la degeneración de una configuración electrónica puede ser útil para interpretar símbolos de término en un campo octaédrico.
Encuentra los símbolos del término para los siguientes casos:
- \(L=0, \ S=0\)
- \(L=0, \ S=\frac{1}{2}\)
- \(L=1, \ S=1\)
- \(L=2, \ S=\frac{3}{2}\)
- \(L=3, \ S=2\)
- Contestar
-
a)\(^1S\)
b\(^2S\)
) c\(^3P\)
) d\(^4D\)
) e\(^5F\)
Encontrar todos los microestados posibles para un átomo o ion
¿Cuáles son los posibles microestados y el número total de microestados para un ion libre con configuración\(d^2\) de electrones? Esto lo podemos expresar en una llamada tabla de microestados (\(\PageIndex{2}\)).
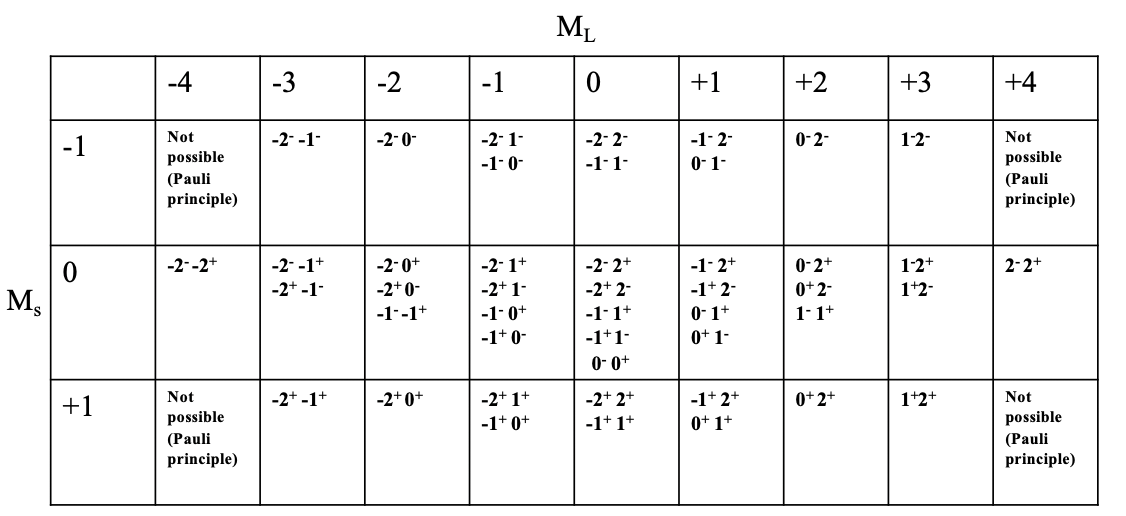
Puede ver la tabla de microestados para la configuración\(d^2\) electrónica representada anteriormente. Cada columna representa un valor posible\(M_l\). Para la\(d^2\) configuración,\(M_l\) se pueden adoptar valores de -4 a +4, de ahí que existan 9 columnas. Cada fila representa el\(M_s\) valor posible. Para la configuración\(d^2\) electrónica,\(M_s\) puede variar entre +1 y -1. \(M_s=+1\)significa que ambos electrones tienen el espín\(+\frac{1}{2}\),\(M_s=0\) significa que un electrón tiene el espín\(+\frac{1}{2}\) y el otro tiene el giro\(-\frac{1}{2}\). El\(M_s=-1\) valor se adopta cuando ambos electrones tienen el giro\(-\frac{1}{2}\). Ahora podemos combinar cada\(M_s\) valor con cada\(M_l\) valor, lo que define un campo particular en la tabla. Se puede ver que algunos campos están vacíos debido al principio Pauli. Por ejemplo, el campo para\(M_l=-4\) y no\(M_s=-1\) se llena porque en este caso ambos electrones tendrían los mismos números cuánticos, es decir\(m_l=2\), y\(m_s=-\frac{1}{2}\). Podemos ver además que para algunos campos sólo es posible una combinación de electrones, mientras que para otros hay múltiples microestados posibles. Por ejemplo, para el campo con\(M_l=4\) y solo\(M_s=0\) hay una combinación de electrones posible. Se puede ver la notación “\(2^- 2^+\)” en este campo. Esto significa que el primer electrón tiene un\(m_l\) valor de 2 y un espín de\(-\frac{1}{2}\) y el segundo electrón también tiene un\(m_l\) valor de 2 y un\(m_s\) valor de\(+\frac{1}{2}\). El campo más poblado es el campo para\(M_l=0\) y\(M_s=0\); en general hay cinco microestados con esa combinación de\(M_l\) y\(M_s\) valores. Si contamos el número total de microestados en la tabla entonces llegamos al número 45. Esto es consistente con lo que esperaríamos de acuerdo con la siguiente fórmula. \[\text{#microstates} = (2L+1)(2S+1)\]
En nuestro ejemplo L=4 y S = 1, y así el número de microestados es:\(((2x4)+1)((2x1)+1)=45\). En general para una configuración de\(d^n\) electrones con\(n\) electrones d, el número de microestados es\((10!)/((10-n)!n!)\).
Una propiedad útil de una tabla de microestados es que podemos derivar todos los términos y símbolos de términos posibles para una configuración de electrones particular a partir de ella. En aras de la simplificación, indicamos un posible microestado en la tabla de la Figura\(\PageIndex{5}\) solo por una “x”. Luego dibujamos la caja rectangular más grande posible en la tabla de microestados que contiene solo campos con al menos una posible combinación de electrones (Figura\(\PageIndex{5}\)).
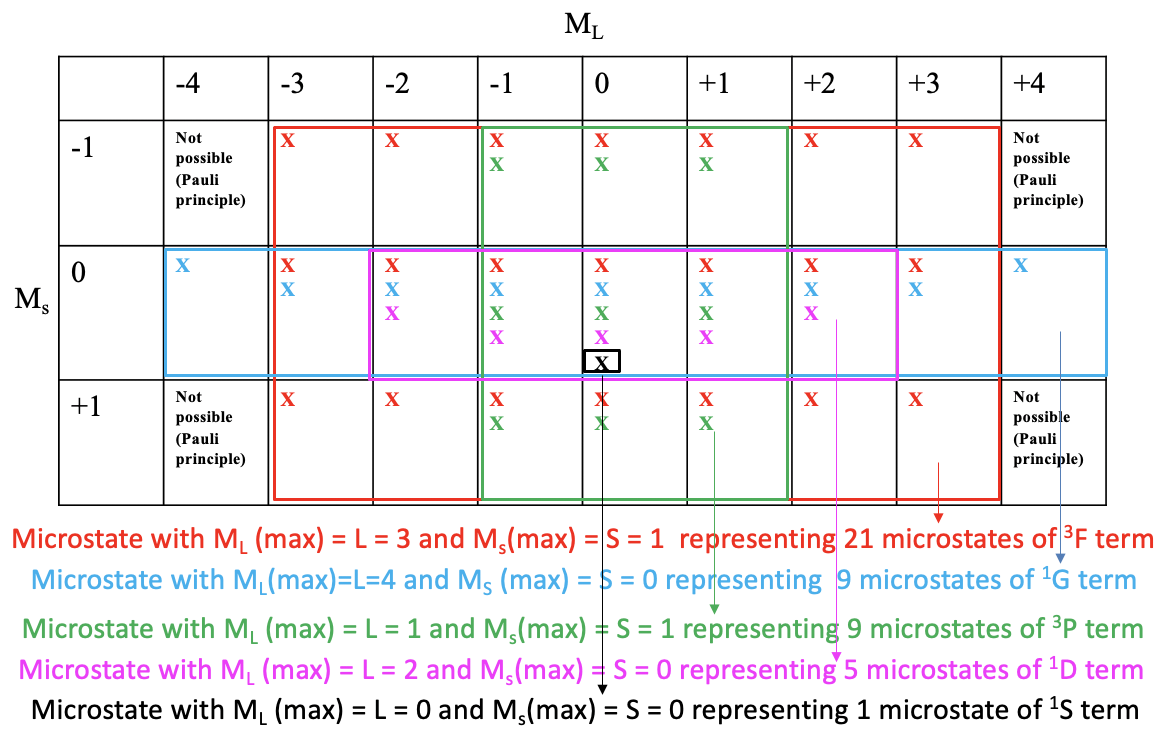
Se puede ver que la caja más grande posible es la caja roja dibujada (Figura\(\PageIndex{5}\)). Esta caja contiene los microestados que pertenecen al primer término de la configuración electrónica\(d^2\). El número de microestados es igual al número de campos dentro del cuadro rojo. Eso hace\(7\times 3=21\) microestados. ¿Cuál es el término símbolo para este término? Para poder responder a esta pregunta necesitamos encontrar el microestado en la caja roja que tiene el\(M_s\) valor más alto\(M_l\) y el más alto. Se puede ver que es el que tiene\(M_l=3\) y\(M_s=2\). Así, L=3 y S=1. Esto define el término como un término 3 F porque 2S+1 = 3, y L=3 corresponde al término símbolo F. Este término es un término triplete. Tenga en cuenta que un término triplete también incluye microestados con giros opuestos. En general siete de los 21 microestados tienen\(M_s=0\).
A continuación, miramos cuál es la siguiente caja rectangular más grande que podemos dibujar, y que contiene microestados que aún no consideramos. Podemos ver que la caja azul contiene nueve campos que equivalen a nueve microestados. El microestado dentro de esta caja que tiene los\(M_s\) valores más altos\(M_l\) y es el que tiene\(M_l=4\) y\(M_s=0\). Esto define un término de 1 G. Este es un término singlete. Tenga en cuenta que un término singlete SOLAMENTE tiene microestados con espines emparejados (M s =0).
Hay otra caja rectangular que también contiene nueve microestados. Es el verde. El microestado con los\(M_s\) valores más altos\(M_l\) y es el que tiene\(M_l=1\) y\(M_s=1\). Así,\(L =1\), y\(2S+1=3\), que define un\(^3P\) término. Obsérvese que a pesar de ser un término triplete, que indica dos electrones desapareados (\ S=1\), el término también contiene tres microestados que tienen espines opuestos con un total\(M_s=0\).
La siguiente caja más grande es la morada que contiene cinco campos y cinco microestados. ¿Cuál es el término con los más altos\(M_l\) y\(M_s\) valores? Es el que tiene\(M_l=2\) y\(M_s=0\). Esto significa que L=2 y S=0, que define un término de 1 D, un término singlete con solo microestados con giros emparejados. Queda un microestado que no consideramos hasta ahora, el que tiene\(M_l=0\) y\(M_s=0\). Estos son los más altos\(M_l\) y\(M_s\) valores porque no hay otro microestado. Así, este término contiene sólo un microestado y el término símbolo es\(^1S\). Ahora hemos encontrado todos los términos y símbolos de término.
¿Cuáles son los posibles símbolos de término para la configuración\(1s^2 2s^2 2p^1\) electrónica del boro? ¿Cuál es el estado base?
Solución
Solo necesitamos considerar el electrón en el\(2p\) orbital, ya que ese es el único electrón de caparazón abierto. Para un electrón, sólo hay un valor de\(S = ½\), por lo que la multiplicidad debe ser\(2S+1=2\). Los valores posibles de\(L\) para un electrón en un\(p\) orbital son\(L=0,1\) (o términos S y P). Esto le da al término de iones libres símbolos\(^2P\) y\(^2S\). Ambos términos tienen multiplicidad de 2, por lo que el estado base sería el de mayor valor para\(L\). El término estado base es\(^2P\).
¿Cuáles son los términos símbolos para la configuración electrónica de\(1s^2 2s^1 2p^1\) estado excitado del berilio?
Solución
El término símbolos será de la forma\(^1P\) y\(^3P\). Para el\(^1 P\) estado,\(L=1\) y\(S=0\), por lo tanto, el momento angular total\(J=1\). Para el segundo estado,\(L=1\) y\(S=1\), así los posibles valores de\(J=2,1,0\). Hay cuatro microestados para esta configuración con símbolos de término de\(^1 P_1\) y\(^3 P_2\),\(^3P_1\), y\(^3P_0\).
Encontrar el término del estado base
... de una lista de microestados
Cada símbolo de término representa un estado atómico con un nivel de energía asociado. Si has encontrado todos los microestados posibles usando una tabla de microestados, y has identificado sus términos, entonces el término con la energía más baja (es decir, el estado básico) se puede encontrar usando las dos primeras reglas de Hund. En forma abreviada, las reglas de Hund establecen...
- La configuración de electrones de menor energía tiene la multiplicidad máxima (el número máximo de electrones desapareados).
- Para una multiplicidad dada, la configuración con el mayor valor de momento angular orbital total (\(L\)) tiene la energía más baja.
En el caso del átomo de\(p^2\) carbono (ver Figura\(\PageIndex{1}\)), el estado de energía más bajo tendría una multiplicidad de 3 (dos electrones desapareados). De los estados con una multiplicidad de 3, el mayor valor de\(L\) es 1 (y así,\(P\)). Así, el término estado fundamental para el carbono es\(^3P\). Estas reglas son confiables para identificar el término de estado básico para cualquier átomo, pero tienen un uso limitado para ordenar energías relativas fuera del estado básico para iones metálicos 3d y otros átomos de luz. Para los átomos más pesados (e.g., 4d metales) se debe considerar otro tipo de interacción, llamado acoplamiento jj, pero esto está fuera del alcance de esta discusión. Consejo: Hay una profunda simetría que conecta diferentes configuraciones electrónicas. Resulta que una\(p^1\) configuración tiene los mismos símbolos de término que a\(p^5\). De igual manera,\(p^2 = p^4\). Una relación similar se puede utilizar para determinar símbolos de término de alto número de electrones para los\(f\) orbitales\(d\) y.
... si solo quieres el término Find Ground State
Para asignar transiciones en un espectro electrónico, debemos conocer el término estado fundamental, así como todos los demás términos y sus energías relativas para un átomo o ion dado. Sin embargo, la identificación de todos los términos posibles se vuelve tediosa con más de uno o dos electrones en los\(d\) orbitales. Afortunadamente, existen herramientas (como diagramas de correlación) que pueden ayudarnos a encontrar todos los términos para un átomo o ion, siempre y cuando se pueda identificar el término estado fundamental. Aquí hay un atajo rápido para encontrar el término de estado fundamental para el complejo de metal de transición con\(d\) carcasa parcialmente llena.
En este caso, nos centraremos en los orbitales d de metales de transición. Para comenzar, necesitarás conocer la identidad del ion metálico y su estado de oxidación. Estas instrucciones suponen que el\(d\) orbital es el único caparazón que está parcialmente lleno.
- Determinar el número de electrones d.
- Luego, rellena estos electrones en un diagrama orbital de electrones de cinco orbitales degenerados, poniendo electrones en el valor más alto de\(m_l\) primero, y llenando orbitales con electrones individuales antes de emparejarlos (tal como habrás hecho en un curso introductorio de química).
- Calcuar el giro intrínseco total (\ S\) y la multiplicidad de espín usando el diagrama dibujado en #2.
- Calcular\(L\) usando el diagrama dibujado a partir de #2.
- Escriba el símbolo del término para el estado base.
Usemos el ejemplo del ion\(\ce{[Cr(NH3)6]^3+}\) complejo, y determinemos su término de estado fundamental siguiendo el atajo descrito anteriormente.
- Determinar el número de\(d\) -electrones.
\(\ce{[Cr(NH3)6]^3+}\)contiene\(\ce{Cr^3+}\), que es un ion\(d^3\) metálico. Hay tres\(d\) electrones. - Dibuja un diagrama de cinco\(d\) orbitales degenerados, con\(m_l\) valores etiquetados. Rellene los electrones para maximizar\(m_s\) y\(m_l\).
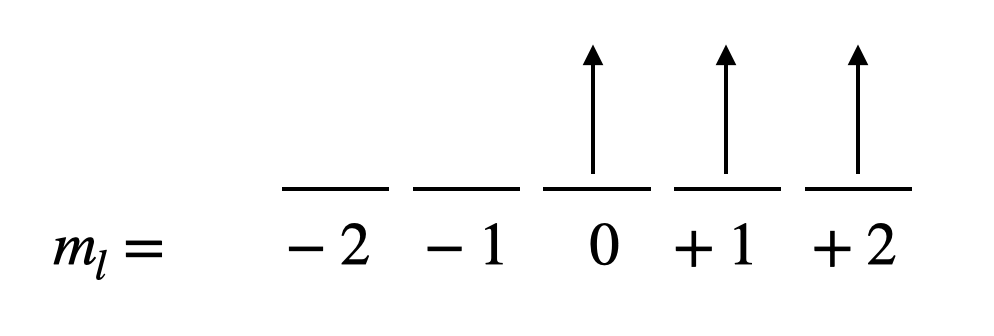
- Calcular la multiplicidad de giro (¡debe ser el valor máximo posible!).
\(S= m_{s_1} + m_{s_2} + m_{s_3} = +\frac{1}{2} + +\frac{1}{2} + +\frac{1}{2} = \frac{3}{2}\)
Multiplicidad de giro =\(2S+1 = 2 \frac{3}{2} + 1 = 4\) - Calcular\(L\) (debe ser el valor máximo posible después de que se maximice el giro.
\(L = m_{l_1}+ m_{l_2} + m_{l_3} = 2 + 1 + 0 = 3\) - Escriba el término de iones libres del estado fundamental:
\(^{(2S+1)}L = \; ^4F\)
Anteriormente en esta página, encontraste todos los términos para un ion\(d^2\) metálico. Utilice ambos métodos (regla de Hund, y el método de atajo) descritos aquí para identificar el término de estado fundamental para\(d^2\).
- Contestar
-
Usando la regla de Hund: Los términos identificados para\(d^2\) son\(^3F, \; ^1G, \; ^3P, \; ^1D,\) y\(^1S\). La primera regla de Hund nos dice que cualquiera\(^3F\) o\(^3P\) podría ser el estado base porque estos dos términos tienen la mayor multiplicidad. La segunda regla de Hund nos dice que\(^3F\) debe ser el estado base porque tiene el mayor valor de\(L\).
Usando el atajo: El dibujo se muestra a continuación, con un electrón adentro\(m_l=+2\) y el segundo electrón adentro\(m_l=+1\). Ambos electrones están desapareados con\(m_s=+\frac{1}{2}\). Esto da\(L=3\) o un término F. Y,\(S=1\) con una multiplicidad de 3. El término estado base es\(^3F\).
Encuentre los términos de iones libres de estado fundamental para los iones metálicos en los siguientes casos:
(a)\(\ce{[Ti(H2O)6]Cl2}\)
b)\(\ce{[Ti(NH3)6]Cl3}\)
c)\(\ce{[Cu(H2O)6]Cl2}\)
- Contestar
-
(a)\(\ce{Ti^2+}\) es un ion\(d^2\) metálico,\(^3F\)
b)\(\ce{Ti^3+}\) es un ión\(d^1\) metálico,\(^2D\)
(c)\(\ce{Cu^1+}\) es un ion\(d^9\) metálico,\(^2D\). Nótese que\(d^9\) y\(d^1\) están relacionados por la simetría de sus estados electrónicos.


