12.1: Introducción a las Reacciones de Complejos Metálicos
- Page ID
- 81429
Aunque hay una amplia gama de reacciones que ocurren en los centros de metales de transición, tocaremos solo un subconjunto de las posibilidades. Este capítulo se centrará en las reacciones de los complejos metálicos octaédricos y planos cuadrados, y las reacciones se dividirán en tres tipos:
- Reacciones de sustitución en el centro metálico: son reacciones en las que un ligando es reemplazado por otro ligando dentro de la esfera de coordinación interna del metal.
- Redox: son reacciones en las que el estado de oxidación del metal cambia formalmente al ganar o perder electrones.
- Reacciones de ligandos: son reacciones que ocurren principalmente en los ligandos que están unidos a iones metálicos.
Revisión de diagramas y términos de coordenadas de reacción
Antes de comenzar nuestra discusión sobre las reacciones, revisemos algunos de los vocabulario y modelos que utilizan los químicos para comprender las reacciones.
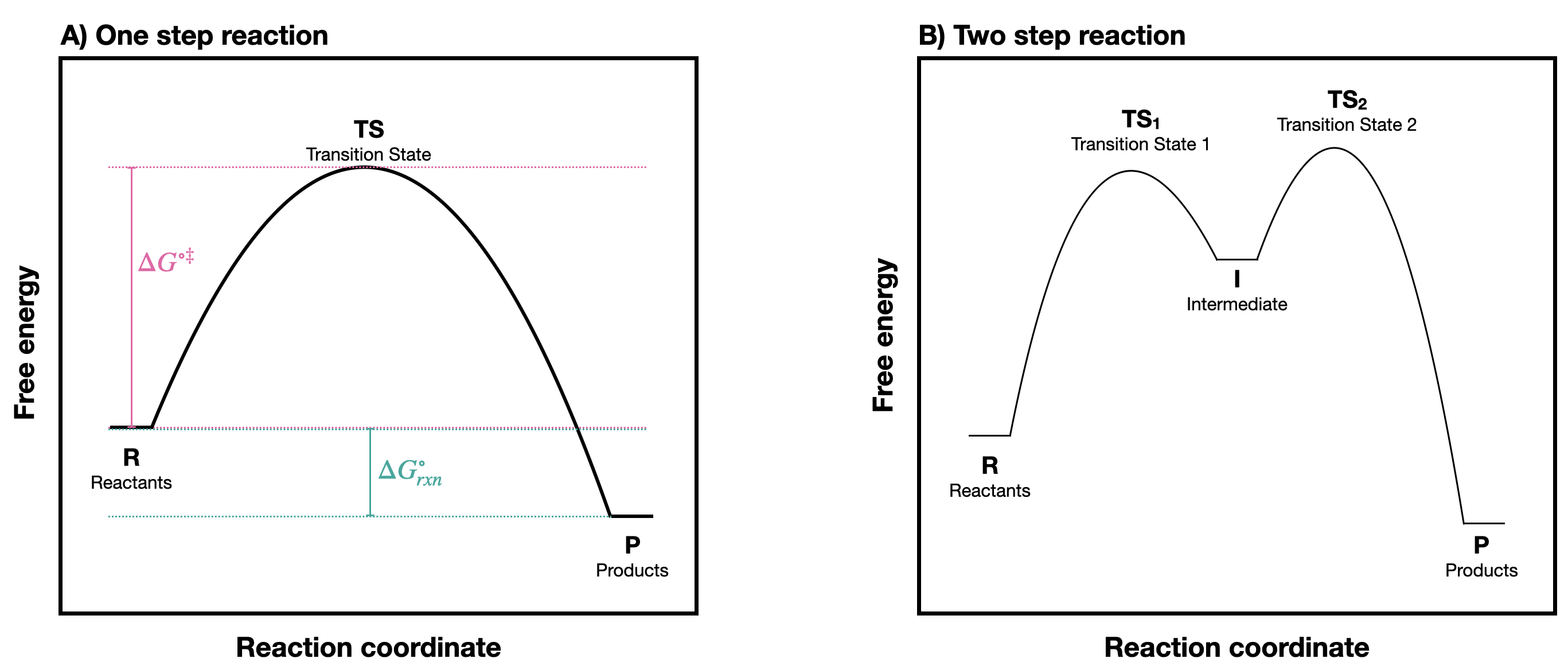
Una reacción química se puede representar con un diagrama de coordenadas de reacción en el que la energía potencial total de un estado se representa en el\(y\) eje vertical, y la "coordenada de reacción" (a veces también denominada “progreso de la reacción”, o “extensión de la reacción”) se representa en el \(x\)eje horizontal. La coordenada de reacción a menudo se dibuja como el progreso de una reacción desde los reactivos (R) a la izquierda hasta los productos (P) a la derecha.* En la Figura se muestran ejemplos de diagramas de coordenadas de reacción para una reacción de una etapa y una de dos etapas\(\PageIndex{1}\). Observe la diferencia en el perfil de reacción que depende del número de etapas de reacción. Una reacción de un solo paso tiene una forma de “colina”, mientras que una reacción de dos pasos adquiere una forma de “silla de montar”.
*Muchos estudiantes encuentran útil visualizar el eje horizontal en un diagrama de coordenadas de reacción como análogo a la barra de progreso en la parte inferior de un video de youtube.
Termodinámica
La diferencia de energía entre los reactivos (R) y los productos (P) indica si los reactivos o productos dominarán en el equilibrio termodinámico. En condiciones estándar, esta diferencia es la Energía Libre de Gibbs estándar de la reacción (\(\Delta G^{\circ}_{rxn}\)o\(\Delta G^{\circ}\)). El cambio de energía libre de Gibbs es una combinación de cambio de entalpía (\(\Delta H^{\circ}\)) y cambio de entropía (\(\Delta S^{\circ}\)):
\[\Delta G^{\circ} = \Delta H^o - T\Delta S^o \nonumber \]
donde
- \(T\)es la temperatura en Kelvin (recordemos que la temperatura Kelvin es simplemente la temperatura Celsius más 273.15).
- El cambio de entalpía (\(\Delta H^{\circ}\)) es el calor liberado o absorbido por la reacción.
- El cambio de entropía (\(\Delta S^{\circ}\)) es el cambio en el trastorno de los reactivos a los productos. En una reacción en la que una molécula se escinde en dos moléculas más pequeñas, por ejemplo, el trastorno aumenta, por lo que\(\Delta S^{\circ}\) es positivo.
El cambio estándar de energía libre de Gibbs para una reacción puede estar relacionado con la constante de equilibrio de la reacción\(K_{eq}\) por la ecuación:
\[\Delta G^{\circ} = -RT \ln K_{eq} \nonumber \]
donde\(R\) está la constante del gas (8.314 J/mol×K) y\(T\) es la temperatura en Kelvin (K).
Un valor negativo para\(\ce{\Delta G_{rnx}^{\circ}}\) (una reacción exergónica) corresponde a\(\ce{K_{eq}}\) ser mayor de 1, una constante de equilibrio que favorece la formación del producto. Por el contrario, una reacción endergónica tiene un valor positivo de\(\ce{\Delta G ^{\circ}}\), y a\(\ce{K_{eq}}\) entre 0 y 1.
Cinética
El punto más alto entre dos mínimos de energía es un estado de transición (TS). La diferencia en energías del reactivo y el TS de mayor energía es la energía libre estándar de activación (\(\ce{\Delta G^{\circ \ddagger}}\)). La energía de activación, en combinación con la temperatura a la que se está llevando a cabo la reacción, determina la velocidad de una reacción: cuanto mayor es la energía de activación, más lenta es la reacción. La constante de velocidad (\(k\)) es la constante de proporcionalidad que relaciona la velocidad de la reacción con las concentraciones de reactivos. La relación entre la energía de activación y la constante de velocidad\(k\),, viene dada por la ecuación de Arrhenius:
\[k = Ae^{-\frac{E_a}{RT}} \quad \quad \text{or} \quad \quad \ln k=\ln A-\frac{E_{A}}{R T} \nonumber \]
Una ley de velocidad es una expresión que muestra la relación de la velocidad de reacción con las concentraciones de cada reactivo. La tasa se define como el cambio en los reactivos o productos a lo largo del tiempo. Por ejemplo, en una reacción de dos reactivos (\(R_1\)y\(R_2\)) para formar el producto (P), una ley de tasa podría escribirse de la siguiente manera:
\[\frac{d\ce{[P]}}{dT}=\ce{k[R_1][R_2]} \nonumber \]
La ley de tasa anterior es de segundo orden general, y de primer orden con respecto a ambos\(R_1\) y\(R_2\). El orden indica el poder de las concentraciones de reactivos para reactivos individuales o en general para la reacción.
En una reacción de una etapa, el producto se forma en un solo paso. Hay una barrera energética que superar para que este proceso pueda suceder. A la altura de esa barrera energética se encuentra el TS. En una reacción de un solo paso, hay un estado de transición. En contraste, en una reacción de dos etapas, hay dos estados de transición y un intermedio (denotado por la letra I). El primer paso de R a I, pasa por encima del estado de transición\(TS_1\), es endergónico. El segundo paso que pasa por el estado de transición\(TS_2\) es exergónico. El intermedio (I) se representa así como un 'valle' de energía (un mínimo de energía local) situado entre los dos máximos de energía;\(TS_1\) y\(TS_2\).
En la Figura\(\PageIndex{1}\) B, observe que la barrera de energía para el primer paso es mayor que la barrera de energía para el segundo paso. Esto quiere decir que el primer paso es más lento que el segundo. En una reacción de varios pasos, el paso más lento, el paso con la mayor barrera de energía, se conoce como el paso de limitación de velocidad o de determinación de la velocidad. El paso de determinación de la velocidad puede considerarse como el “cuello de botella” de la reacción: un factor que afecta el paso determinante de la velocidad afectará la velocidad general de la reacción. Por el contrario, un factor que afecta solo a un paso mucho más rápido no afectará significativamente la velocidad de la reacción general.
Resumen y términos clave
Los diagramas de coordenadas de reacción transmiten algunas ideas muy importantes sobre cómo puede proceder la reacción, y sobre la termodinámica y cinética de la reacción. En las secciones que siguen, se utilizarán los siguientes términos clave:
Reactivos (R): Las especies moleculares que son los materiales de partida para una reacción química. Estos suelen estar escritos en el lado izquierdo de un diagrama de coordenadas de reacción.
Productos (P): Las especies moleculares que resultan de una reacción química. Estos suelen estar escritos en el lado derecho de un diagrama de coordenadas de reacción.
Estado de transición (TS): un estado de transición es la especie transitoria que existe a un máximo de energía. En otras palabras, los TS son estructuras de mayor energía a lo largo de una vía de reacción. El postulado de Hammond sugiere que la estructura de un estado de transición debe parecerse a las especies de menor energía (R, P o I) adyacentes a él a lo largo de la coordenada de reacción, y se parece más a la estructura de la especie más cercana en energía.
Intermedio (I): un intermedio es una estructura de alta energía a un mínimo local. A veces se considera que los intermedios son estados de transición de larga duración. A diferencia de los estados de transición, los intermedios a veces existen el tiempo suficiente y en una concentración lo suficientemente alta como para ser detectables
Reversión microscópica: si una reacción puede proceder en la dirección de avance de R a P, entonces en principio, también puede proceder en la dirección inversa de P a R. Puede haber muchas posibilidades de cómo podría ocurrir una reacción, pero la vía de menor energía en el avance dirección es también la vía de energía más baja en la dirección inversa. En otras palabras, las reacciones pasan por la misma I y TS de menor energía en las direcciones hacia adelante y hacia atrás.
Aproximación en estado estacionario: se supone que la concentración de un intermedio reacciona tan rápido como se forma. Esta aproximación permite suponer que la concentración de un intermedio permanece “estable” a lo largo del progreso de la reacción. Esta aproximación es útil para el análisis de la cinética de reacción.
Orden: El orden de una reacción indica el poder de concentración total de reactivos en una ley de velocidad cinética. El orden de un reactivo indica el poder de ese reactivo en la ley de velocidad. Por ejemplo, es una ley de velocidad es decir\(\ce{Rate = k [A]^2[B]}\), la reacción es de segundo orden en A, primer orden en B y tercer orden general. Si también hubiera un reactivo, C, que no fuera parte de la ley de velocidad, la reacción sería de orden cero con respecto al C.
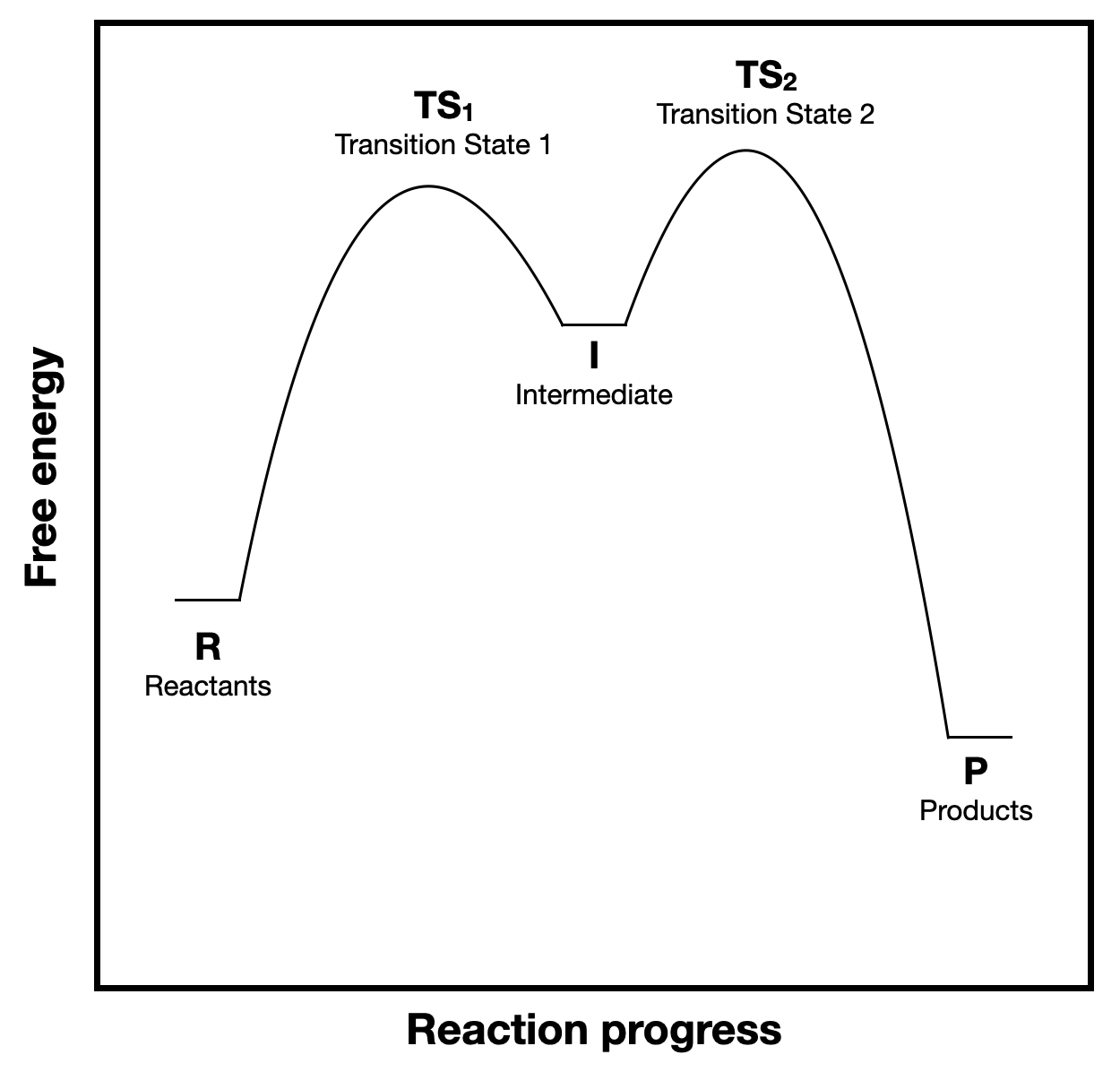
La figura\(\PageIndex{1}\) se replica a continuación por conveniencia. Esta figura muestra un diagrama de coordenadas de reacción para una reacción de dos etapas.
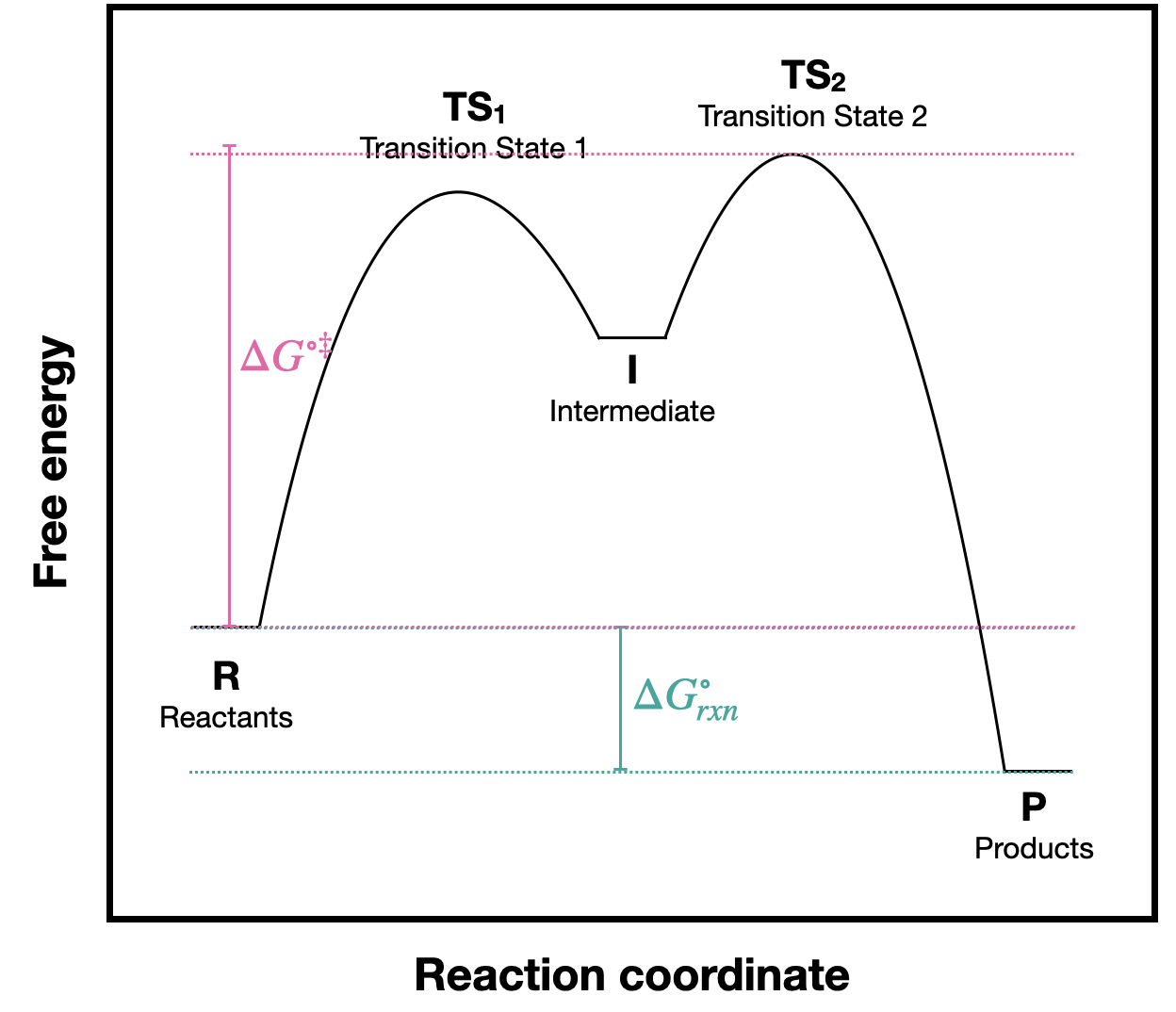
a. (\(\Delta G^{\circ}\)) y\(\Delta G^{\circ \ddagger}\)) están etiquetados en la Figura\(\PageIndex{1}A\), pero no en la Figura\(\PageIndex{1}B\). Agregue las etiquetas apropiadas al diagrama B. (copiado a continuación para mayor comodidad).
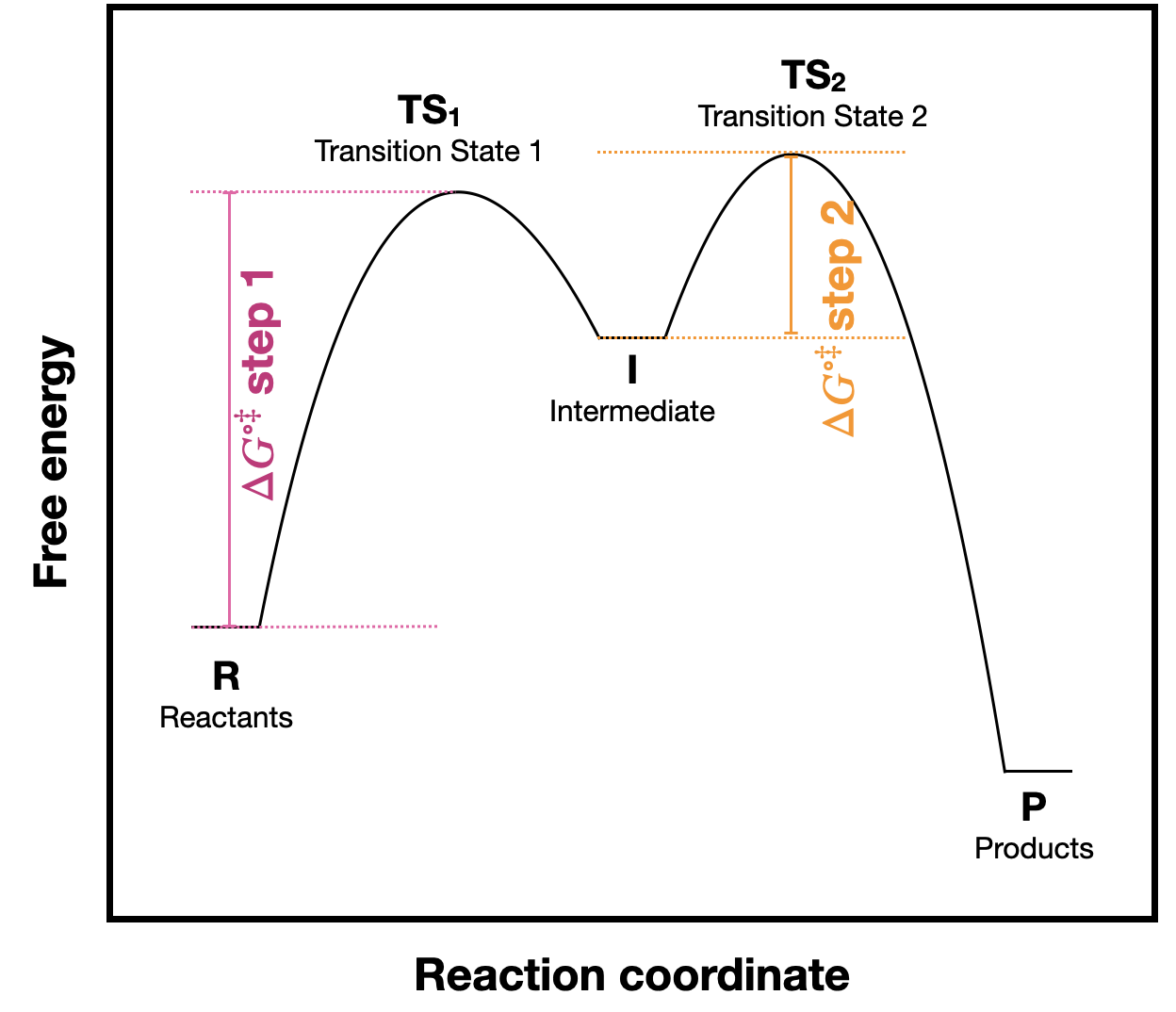
b. considerar las barreras energéticas para el primer y segundo paso y explicar por qué la aproximación del estado estacionario es una suposición válida.
- Contestar
-
a) La energía de activación para esta reacción es la diferencia entre R y\(TS_2\) porque\(TS_2\) es la energía más alta a lo largo de la vía de reacción.
b) La energía de activación para el paso 2 es mucho menor que para el paso 1. Esto nos dice que el paso 2 ocurre más rápido que el paso 1. Entonces, la concentración de intermedio no debe aumentar en el transcurso de la reacción, y debe reaccionar al menos tan rápido como se forme. El hecho de que la barrera de activación para el paso 2 sea menor que para el paso uno nos permite suponer que [I] no cambia en el transcurso de la reacción. Esto generalmente debería ser cierto para todos los intermedios.
Utilice el diagrama de coordenadas de reacción a continuación para responder a las preguntas.
- ¿La reacción general es endergónica o exergónica en la dirección hacia adelante (A a D)?
- ¿Cuántos pasos tiene el mecanismo de reacción?
- ¿Cuántos intermedios tiene el mecanismo de reacción?
- Vuelva a dibujar el diagrama si es necesario. Agregue una etiqueta que muestre la barrera de energía para el paso determinante de la velocidad de la reacción hacia adelante.
- Añadir una etiqueta que muestre\(\ce{\Delta G^{\circ}_{rxn}}\) la reacción inversa (D a A).
- ¿Cuál es el paso de reacción más rápido, considerando tanto las direcciones hacia adelante como hacia atrás?
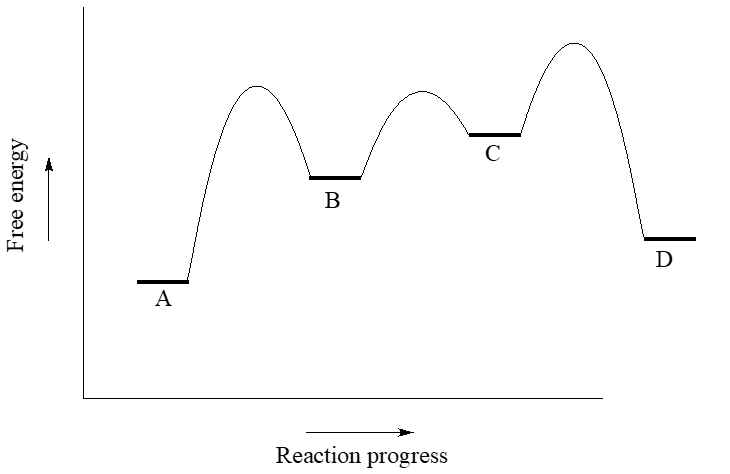.docx_%255BCompatibility_Mode%255D_-_Word_(Product_Activation_Fai.png)
- Contestar
-
- ¿La reacción general es endergónica o exergónica en la dirección hacia adelante (A a D)?
- ¿Cuántos pasos tiene el mecanismo de reacción?
- ¿Cuántos intermedios tiene el mecanismo de reacción?
- El primer paso es determinar la velocidad ya que tiene la mayor barrera de activación.
- \(\ce{\Delta G^{\circ}_{rxn}}\)para la reacción inversa (D a A) es la misma que para la dirección hacia adelante, con un retroceso de su signo.
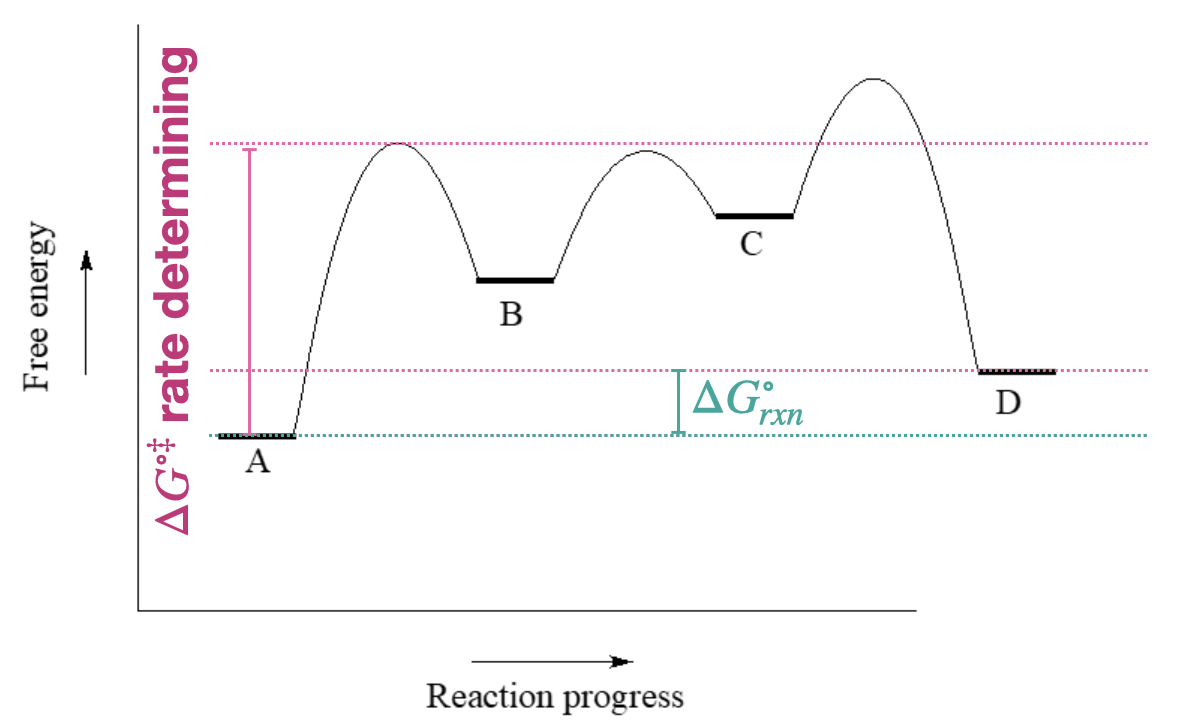
- El paso más rápido tiene las barreras más bajas: este sería el paso hacia/desde B y C.
Modified by Kathryn Haas (khaaslab.com)


