12.4.1: Disociación
- Page ID
- 81507
Considere lo que debe suceder para el caso más simple de un mecanismo de reacción puramente disociativo (D) para un complejo metálico octaédrico. El primer paso y el paso limitante de la velocidad deben ser la disociación de un ligando para formar un intermedio con un número de coordinación menor. Tal situación, donde un complejo octaédrico pierde un ligando, X, para convertirse en un intermedio piramidal cuadrado se muestra a continuación en la Figura\(\PageIndex{1}\).
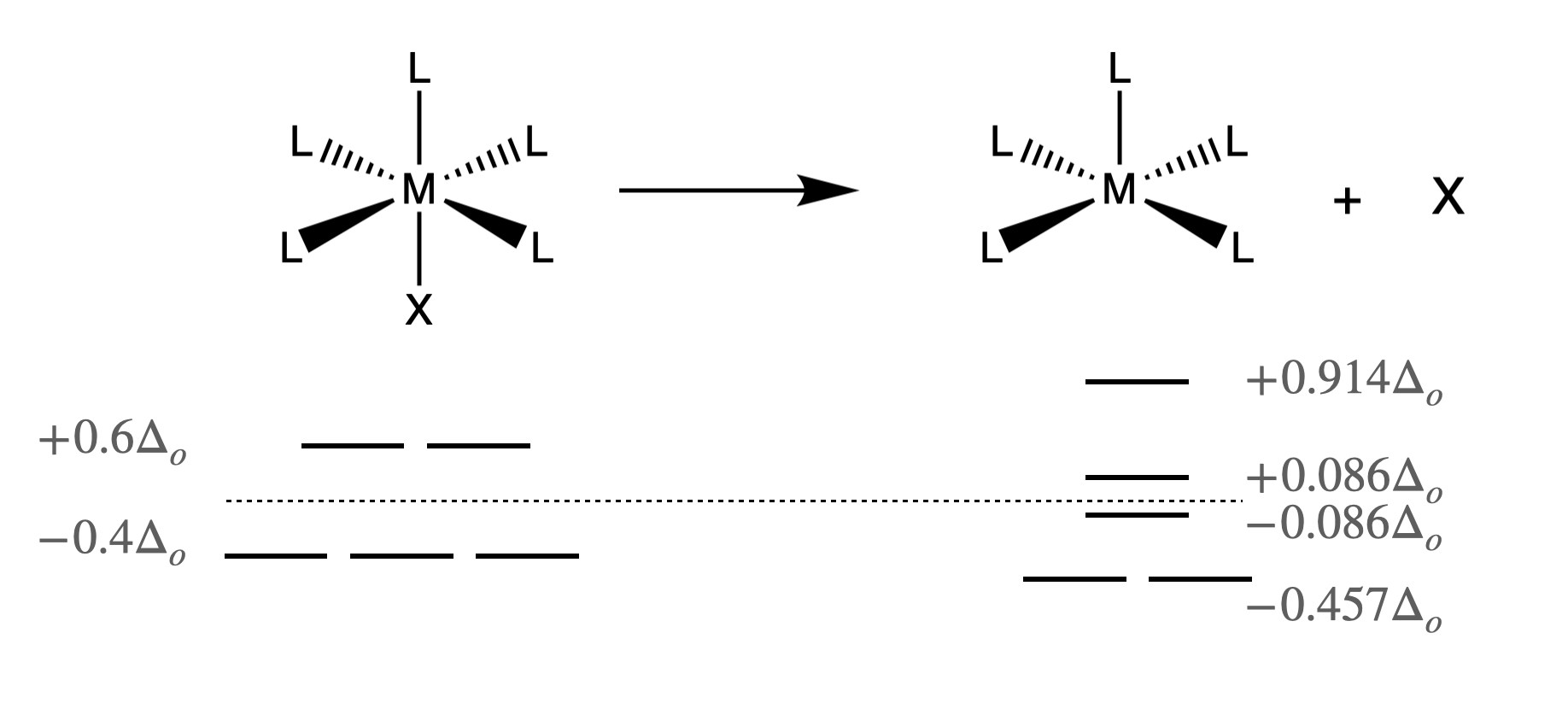
Si la disociación de un ligando es determinante de la velocidad, los factores que disminuyen la energía del estado de transición o estructuras intermedias acelerarán la velocidad de reacción. Aquí podríamos considerar las diferencias en la energía de estabilización de campo de ligando (LFSE). La diferencia entre el LFSE del reactivo octaédrico y el del intermedio se define como la energía de activación del campo del ligando (LFAE). El LFAE se puede calcular para un recuento\(d\) de electrones dado para un reactivo octaédrico y un intermedio piramidal cuadrado usando la información proporcionada en la Figura\(\PageIndex{1}\). Los iones metálicos con valores de LFAE particularmente bajos (más negativos) tienden a ser más lábiles, mientras que aquellos con valores particularmente altos (menos negativos) tienden a ser más inertes. Sin embargo, se espera que la mayoría de los complejos octaédricos reaccionen a través de mecanismos disociativos debido al hacinamiento estérico desfavorable que debe ocurrir durante una vía asociativa.
La facilidad con la que se rompe el enlace M-X también influirá en la velocidad de una reacción disociativa, y esto puede ser sondeado experimentalmente. Los siguientes experimentos pueden dar evidencia que sustentan el argumento de que una reacción ocurre por una vía disociativa, o que se activa disociativamente.
Evidencia experimental que apoya el mecanismo disociativo
1. La identidad del ligando entrante tiene poco efecto sobre la velocidad de reacción.
Si la disociación es la etapa determinante de la velocidad, la identidad del ligando entrante, Y, debería tener poco efecto sobre la velocidad de reacción. Por lo tanto, un experimento que varía Y mientras se mantiene constante X puede indicar si Y está involucrado o no en la etapa de determinación de velocidad. Si la identidad de Y tiene poco efecto sobre la tasa, entonces no debe estar involucrada en el paso determinante de la tasa. Dicha evidencia experimental puede tomarse como evidencia de un mecanismo disociativo. Por ejemplo, las constantes de velocidad para la reacción de\(\ce{[Cr(NH3)5H2O}]^3+}\) con diferentes ligandos entrantes, que se muestran a continuación, tienen constantes de velocidad de magnitud similar (están aproximadamente dentro de un orden de magnitud), lo que indica un mecanismo activado disociativamente. En este caso, otras líneas de evidencia sugieren que se trata de una reacción con un\(I_d\) mecanismo.
\[\ce{[Cr(NH3)5H2O]^3+ + Y^{-} <=> [Cr(NH3)5Y]^2+ + H2O} \nonumber \]
| Entrando en Ligando,\(\ce{Y^-}\) | Constante de velocidad,\(k_1 \; (10^{-4}M^{-1}s^{-1})\) |
|---|---|
| \ (\ ce {Y^-}\) ">\(\ce{NCS^-}\) | \ (k_1\; (10^ {-4} M^ {-1} s^ {-1})\) ">4.2 |
| \ (\ ce {Y^-}\) ">\(\ce{Cl^-}\) | \ (k_1\; (10^ {-4} M^ {-1} s^ {-1})\) ">0.7 |
| \ (\ ce {Y^-}\) ">\(\ce{Br^-}\) | \ (k_1\; (10^ {-4} M^ {-1} s^ {-1})\) ">3.7 |
| \ (\ ce {Y^-}\) ">\(\ce{CF3CO2^-}\) | \ (k_1\; (10^ {-4} M^ {-1} s^ {-1})\) ">1.4 |
2. Abolamiento Estérico del Complejo Metálico
El hacinamiento estérico del complejo metálico inhibiría una vía disociativa a través del apiñamiento estérico del ligando entrante. Sin embargo, el hacinamiento estérico puede aumentar la estabilidad del intermedio después de la disociación del ligando del complejo octaédrico abarrotado. Si la velocidad de reacción aumenta con el hacinamiento estérico del complejo reactivo, esto se toma como evidencia para apoyar un mecanismo disociativo.
3. Volumen de Activación
Una molécula generalmente ocupa menos espacio que dos moléculas de esperato. Esto suele ser cierto en la solución. La medición de la dependencia de una constante de velocidad de la presión se puede utilizar para determinar el volumen de activación (\(\Delta V_{act}\)) y dar una idea del mecanismo de esa reacción. En un mecanismo de disociación, la disociación hace que un complejo metálico se convierta en dos moléculas separadas. Así, el intermedio debería, en principio, ocupar más espacio que el complejo reactivo. En una situación como esta, esperamos que la velocidad de reacción disminuya al aumentar la presión, dando un valor positivo para\(\Delta V_{act}\). Sin embargo, la solvatación de iones puede influir en el volumen, y esto debe considerarse en la interpretación de los datos de dependencia de la presión.
4. El aumento de la atracción culombica con el grupo saliente disminuye la velocidad de reacción.
La atracción coulóbica (electrostática) entre el ligando disociante, X, y el complejo metálico debería ralentizar la disociación del ligando. La atracción coulómbica aumenta al aumentar la magnitud de las cargas y con la disminución de la distancia. Si la velocidad de reacción se ralentiza con el aumento de la carga del ión metálico o del propio ligando, esto se toma como evidencia de un mecanismo disociativo. Asimismo, si la velocidad disminuye a medida que disminuye el radio del ion metálico central, esto es evidencia para apoyar un mecanismo disociativo.
5. El aumento de la fuerza del enlace M-X disminuye la velocidad de reacción.
Las relaciones de energía libre entre la constante de formación de M-X y la constante de velocidad cinética de la reacción pueden proporcionar evidencia para apoyar un mecanismo disociativo (Discutido en la siguiente sección).


