12.4.2: Relaciones lineales de energía libre
- Page ID
- 81527
La relación lineal de energía libre (LFER) es una herramienta que puede indicar la importancia de la rotura del enlace o la formación de enlaces en la etapa de determinación de la velocidad. En el caso de un mecanismo disociativo, por ejemplo, la ruptura del enlace es crítica para el progreso de la reacción. Por lo tanto, la fuerza del enlace M-X influye no solo en el grado en que ocurrirá la reacción, sino también en la velocidad. Aunque la estabilidad termodinámica de un complejo no indica necesariamente la velocidad cinética a la que reaccionará, existe una relación entre la estabilidad del enlace y la velocidad de reacción si la ruptura o formación de ese enlace está involucrada en la etapa de determinación de la velocidad. La relación se puede afirmar de la siguiente manera:
\[ln \; k = ln \; K +c \nonumber \]
Y esta relación puede justificarse utilizando la ecuación de Arrhenius y la ecuación para la dependencia de la temperatura de la constante de equilibrio.
\[\ln k=\ln A-\frac{E_{A}}{R T} \quad \text { and } \quad \ln K=\frac{-\Delta H^{\circ}}{R T}+\frac{\Delta S^{\circ}}{R} \nonumber \]
En un experimento diseñado para probar la Relación Lineal de Energía Libre, se realizarían varias reacciones en condiciones casi idénticas, donde solo se varía la identidad del grupo saliente, X. En estos experimentos, la temperatura sería constante y la misma en cada caso. Si asumimos que el factor preexponencial,\(A\) es el mismo para cada condición de reacción (y debe estar a temperaturas idénticas para reacciones análogas), entonces el\(\ln K\) término de la ecuación de Arrhenius se vuelve proporcional a la energía de activación,\(E_a\) (y proporcional a La energía de activación de Gibb\(\Delta G^{\ddagger} \), y la energía de Gibb\(\Delta G\)). Y dado que la energía del Gibb está relacionada con la constante de equilibrio, K, por\(\Delta G = RT \ln K\), el valor de\(K\) y\(k\) debe correlacionarse. Asimismo, si\(T\) es constante sobre las condiciones de reacción y\(\Delta S^{\circ}\) es similar a través de las reacciones análogas (que debería ser), entonces\(\ln K\) se vuelve proporcional a la entalpía\(\Delta H^{\circ}\), que es proporcional a la energía libre de reacción de Gibb\(\Delta G^{\circ}\).
Si una gráfica de relación lineal de energía libre de\(\ln K\) vs\(\ln k\) es lineal, pero con una pendiente menor a uno, indica un mecanismo disociativo con cierto grado de carácter asociativo (por ejemplo, un\(I_d\) mecanismo o un mecanismo que implica la formación de complejo de preasociación). Si la gráfica de\(\log K\) vs\(\log k\) para las reacciones es lineal, esto es evidencia de que la reacción es disociativa. Un ejemplo para una gráfica lineal de energía libre se muestra en la Figura\(\PageIndex{1}\) para la hidrólisis de\(\ce{[Co(NH3)5X]^+2}\) (esta es la sustitución de\(\ce{X^-}\) con\(\ce{H2O}\)).
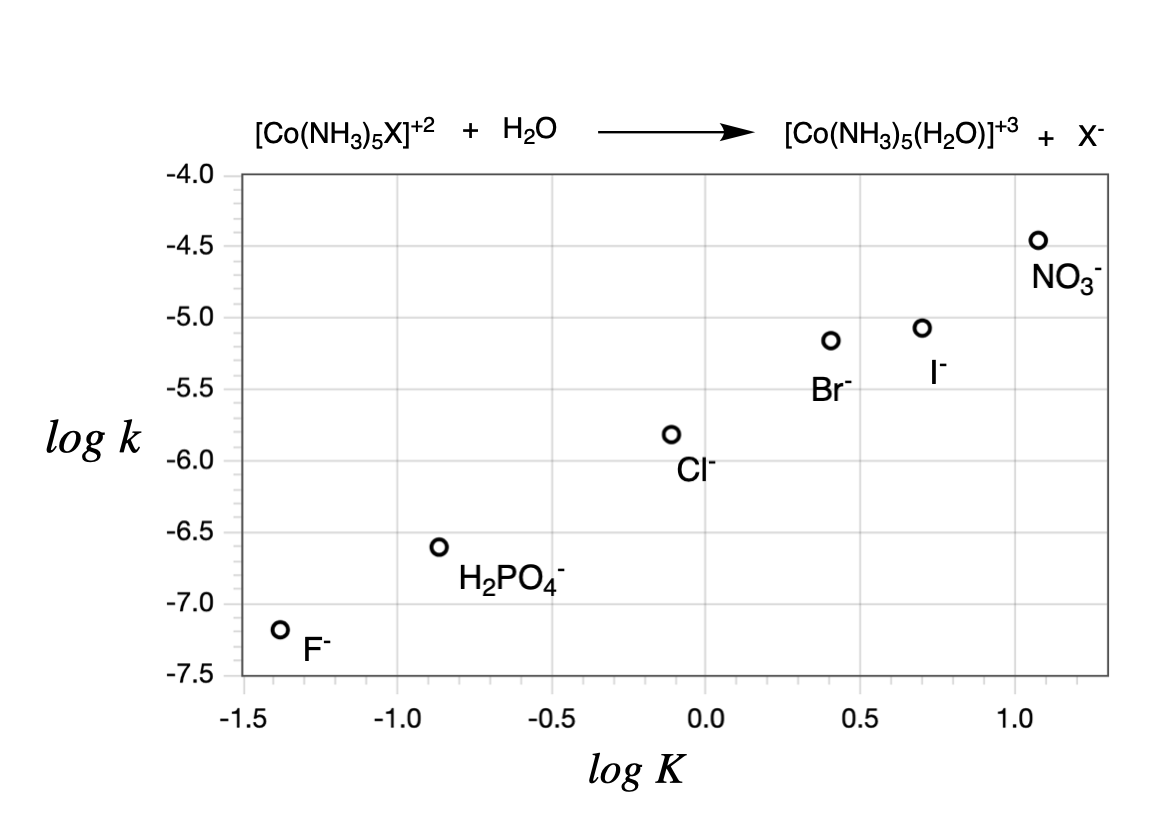
Cuando la pendiente es aproximadamente 1, como es en el caso de\(\ce{[Co(NH3)5X]^+2}\) la Figura\(\PageIndex{1}\), indica que la variación del grupo\(\ce{X^-}\) saliente tiene un efecto similar en la magnitud tanto de\(\Delta G\) (termodinámica, relacionada con\(K\)) como\(\Delta G^{\ddagger}\) (kinética, relacionada con\(k\)). En otras palabras, una pendiente cercana a 1 indica una vía puramente disociativa (D). Estos datos mostrados en la Figura\(\PageIndex{1}\), por ejemplo, son evidencia de un mecanismo disociativo para\(\ce{[Co(NH3)5X]^+2}\).
El argumento de que una reacción es disociativa también puede ser respaldado por evidencia que muestra poco efecto del ligando entrante sobre la velocidad de reacción. Por ejemplo, los datos que apoyan el argumento que\(\ce{[Co(NH3)5H2O]^+3}\) reacciona por una vía disociativa se muestran a continuación. Los datos muestran que la variación de la identidad del ligando entrante,\(\ce{Y^-}\), tiene poco efecto sobre la constante de velocidad (están aproximadamente dentro de un orden de magnitud).
\[ \text{For the reaction: }\ce{[Co(NH3)5H2O]^3+ + Y^{m-} <=> [Co(NH3)5Y]^{(3-m)+} + H2O} \nonumber \]
| Entrando en el ligando,\(\ce{Y^-}\) | Constante de velocidad,\(k_1 \; (10^{-6}s^{-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) |
|---|---|
| \ (\ ce {Y^-}\) ">\(\ce{H2O}\) | \ (k_1\; (10^ {-6} s^ {-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) ">100 |
| \ (\ ce {Y^-}\) ">\(\ce{N3^-}\) | \ (k_1\; (10^ {-6} s^ {-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) ">100 |
| \ (\ ce {Y^-}\) ">\(\ce{SO4^2-}\) | \ (k_1\; (10^ {-6} s^ {-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) ">24 |
| \ (\ ce {Y^-}\) ">\(\ce{Cl^-}\) | \ (k_1\; (10^ {-6} s^ {-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) ">21 |
| \ (\ ce {Y^-}\) ">\(\ce{NCS^-}\) | \ (k_1\; (10^ {-6} s^ {-1})\) (pseudo-primer orden con exceso\(\ce{[Y^{-}]}\)) ">16 |


