12.5.1: Sustitución en complejos octaédricos trans-en
- Page ID
- 81446
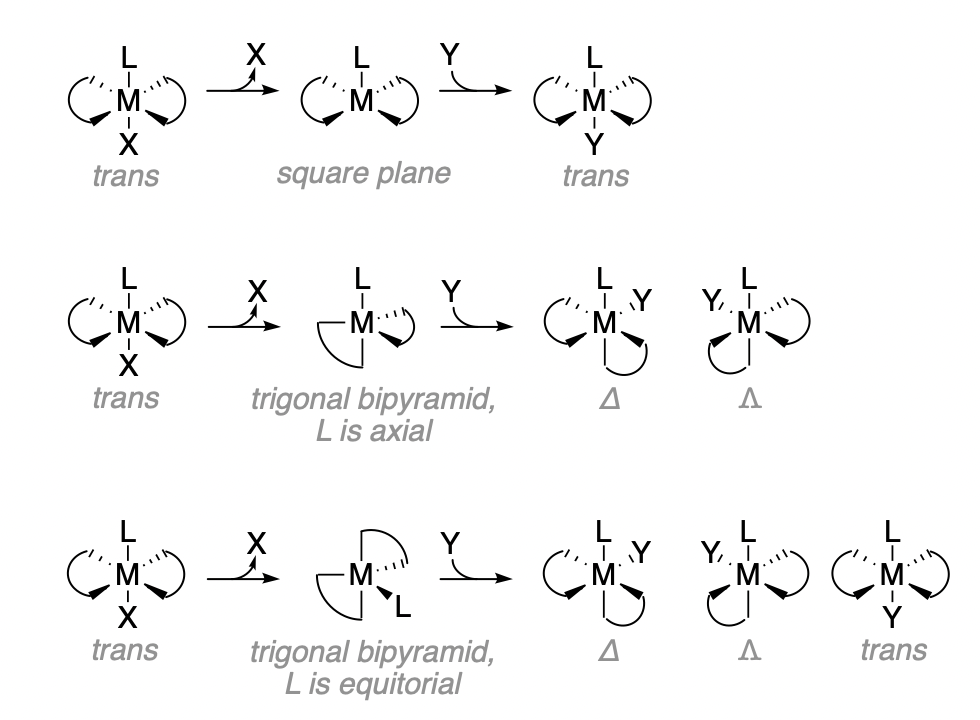
La reacción de los complejos metálicos de la forma\(\ce{[M(en)2LX]^{n+}}\) tienen múltiples vías posibles en términos de la estructura del intermedio.
Cuando el ligando X se aparta de un complejo trans, el caso más probable es que el ligando L permanezca en la posición axial. En ese caso, existe una estructura primaria para el intermedio piramidal cuadrado. La reacción de ese intermedio con el ligando entrante, Y, dará como resultado la retención de la estereoquímica trans.
Una posibilidad alternativa es que el intermedio adopte una estructura bipiramidal trigonal. En ese caso, el resultado de la reacción depende de cuál de las posibles estructuras bipiramidales trigonales existan y sus cantidades relativas. Hay dos posiciones químicamente distinguibles en la bipirámide trigonal; la axial y la ecuatorial. El ligando L restante puede ocupar ya sea la posición axial, que tiene un enlace ligeramente más largo, o las posiciones ecuatoriales, que están ligeramente más cercanas al metal y más impedidas estericamente en el espacio. Para adoptar cualquiera de las estructuras bipiramidales trigonales, es necesario un reordenamiento del complejo. Es más probable que el reordenamiento dé como resultado que el ligando trans esté en la posición ecuatorial, ya que eso requiere menos distorsión de las posiciones originales de cada ligando (esto no es obvio a partir de las estructuras de la Figura\(\PageIndex{1}\)). Una estructura trigonal con L axial requiere que uno de los nitrógenos del ligando en se mueva 90 grados, mientras que una estructura con L equitoral requiere solo 30 grados de movimiento de cualquier ligando. Como resultado, la bipirámide trigonal con L equitativa (parte inferior de la Figura\(\PageIndex{1}\)) es la estructura bipiramidal trigonal dominante. Esa estructura puede producir tres isómeros ópticos desde los tres ángulos diferentes del ligando Y entrando a lo largo del plano equitativo. Cuando Y entra trans a L, produce el producto trans. Cuando Y entra cis a L, produce cualquiera de los dos isómeros ópticos cis. Los isómeros cis\(\Lamda\) y\(cis-\Delta\) los isómeros son igualmente probables, y se producen como mitura racémica a partir de un reactivo trans de partida ópticamente inactivo. Las proporciones esperadas de cis a trans son 2:1.
En cuanto a los intermedios bipiramidales trigonales, la identidad de L influye en su preferencia por las posiciones axiales o ecuatoriales. Por ejemplo,\(\pi\) los ligandos donantes prefieren las posiciones ecuatoriales debido a las longitudes de enlace más cortas involucradas en las interacciones\(\pi\) -donante. Así, cuando L es un\(\pi\) donador fuerte, es más probable que los productos de reacción provengan del intermedio trigonal con una L. ecuatorial. Este último punto es relevante para reacciones donde los mecanismos de base conjugada están en juego. El ligando desprotonado que resulta del mecanismo de base conjugada es un\(\pi\) donador más fuerte, y tiene preferencia por la ocupación de las posiciones ecuatoriales de un intermedio bipiramidal trigonal. Incluso en los casos en los que normalmente se prefiere la pirámide cuadrada, el mecanismo de base conjugada puede resultar en preferencia por un intermedio trigonal.
La proporción real de productos de reacción de una estereoquímica dada depende de la medida en que cada uno de los posibles intermedios conduzca a los productos. Sin embargo, los porcentajes esperados de cis-trans de cualquier intermedio único rara vez se encuentran en los datos experimentales (Ver Tabla\(\PageIndex{1}\)).
La tabla\(\PageIndex{1}\) da el% de estereoquímica trans retenida en el desplazamiento de\(\ce{Cl^-}\) por cualquiera\(\ce{H2O}\) o\(\ce{OH^-}\) en una serie de\(\ce{trans-[Co(en)2LCl]^+}\) complejos donde se varía la identidad del ligando trans\(\ce{L^-}\),,.
Las reacciones ejecutadas en condiciones ácidas se muestran a continuación, y sus datos se muestran en la columna central en la Tabla\(\PageIndex{1}\):
\[\ce{trans-[Co(en)2LCl]^+ + H2O <==> [Co(en)2L(H2O)]^2+ + Cl^-} \nonumber \]
Las reacciones ejecutadas en condiciones básicas se muestran a continuación, y sus datos se muestran en la columna derecha en la Tabla\(\PageIndex{1}\):
\[\ce{trans-[Co(en)2LCl]^+ + OH^- <==> [Co(en)2L(OH)]^+ + Cl^-} \nonumber \]
| \(\ce{L^-}\) | % de producto trans en condiciones ácidas (se retiene la estereoquímica del reactivo) |
% de producto trans en condiciones básicas (se retiene la estereoquímica del reactivo) |
|---|---|---|
| \ (\ ce {L^-}\) ">\(\ce{OH^-}\) | 25 | 6 |
| \ (\ ce {L^-}\) ">\(\ce{NCS^-}\) | 30-50 | 24 |
| \ (\ ce {L^-}\) ">\(\ce{Br^-}\) | 50 | 100 |
| \ (\ ce {L^-}\) ">\(\ce{Cl^-}\) | 65 | 95 |
| \ (\ ce {L^-}\) ">\(\ce{NH3^-}\) | 100 | 24 |
| \ (\ ce {L^-}\) ">\(\ce{NO2^-}\) | 100 | 94 |
| Datos de Miessler, G. L.; Fischer, P. J.; Tarr, D. A. Inorganic Chemistry, 5 ª Ed. Pearson: Boston, 2014, p. 459. | ||

