12.6.1: Cinética y Estereoquímica de las Reacciones Planares Cuadradas
- Page ID
- 81469
Cinética
En general, la cinética de reacción de la sustitución asociativa cuadrado-planar toma la forma de la siguiente ley de velocidad, que tiene dos términos:
\[\frac {d \ce{[ML3Y]}}{dT} =k_1 \ce{[ML3X]} + k_2 \ce{[ML3X][Y]} \nonumber \]
Cada uno de los términos corresponde a una de las dos vías de reacción posibles. El término,\(k_2 \ce{[ML3X][Y]}\), es de segundo orden, y corresponde a una simple vía asociativa. El\( k_1 \ce{[ML3X]}\) término es de primer orden, aunque también corresponde a una vía asociativa. La razón por la que parece ser de primer orden es porque los complejos planos cuadrados pueden reaccionar a través de una vía asistida por disolvente donde el disolvente a granel reemplaza al grupo lábil, y luego es reemplazado por el grupo entrante (Figura\(\PageIndex{2}\)). Debido a que la concentración de disolvente no cambia apreciablemente a medida que avanza la reacción, no forma parte del término de la ley de velocidad aunque esté involucrada en la asociación determinante de la velocidad. La etapa en la que el disolvente es sustituido por el grupo entrante debe ocurrir más rápido que la sustitución asistida por disolvente de X.
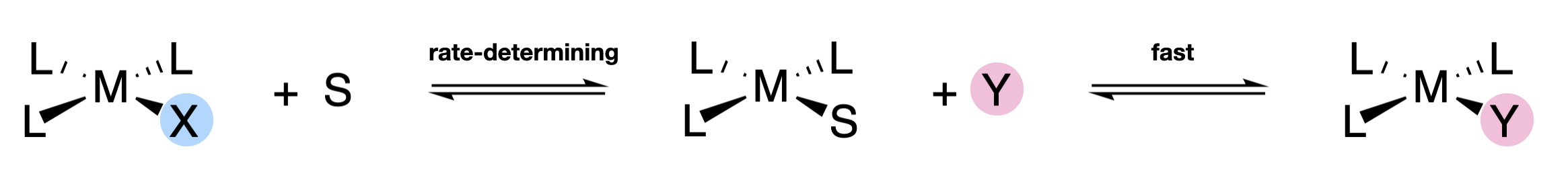
Los constatos de velocidad cinética en la sustitución plana cuadrada pueden depender de las identidades del grupo lábil, el ligando trans al grupo lábil y el grupo entrante. Los ligandos que están en las\(cis\) posiciones con respecto al grupo lábil no tienen un efecto significativo en la velocidad, y estos se denominan ligandos de espectador.
Estereoquímica
Los complejos planos cuadrados reaccionan para dar productos en los que se retiene la estereoquímica del reactivo. En otras palabras, un reactivo trans dará un producto trans, y un reactivo cis dará un producto cis (Figura\(\PageIndex{3}\)). La identidad del ligando trans tiene particular importancia en el resultado de las sustituciones planas cuadradas (discutidas más adelante en las siguientes secciones). Designaremos el ligando trans generalmente con el símbolo T para indicar su posición (Figura\(\PageIndex{3}\)), el grupo lábil como X, y el grupo entrante como Y. Los ligandos de espectador (ligandos que son\(cis\) a X) se desginarán L y L'. Para la discusión que sigue, el plano del complejo metálico se designará como el\(xy\) plano, mientras que el\(z\) eje es perpendicular al plano (Figura\(\PageIndex{3}\)). Los\(y\) ejes\(x\) y correrán colineales a los ejes de unión, con el\(x\) eje colineal a los enlaces T-M-X (Figura\(\PageIndex{3}\)).
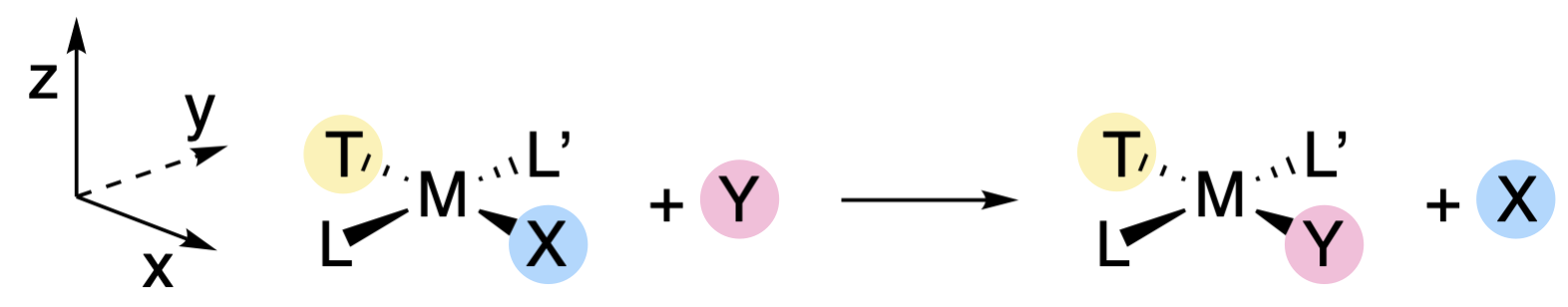
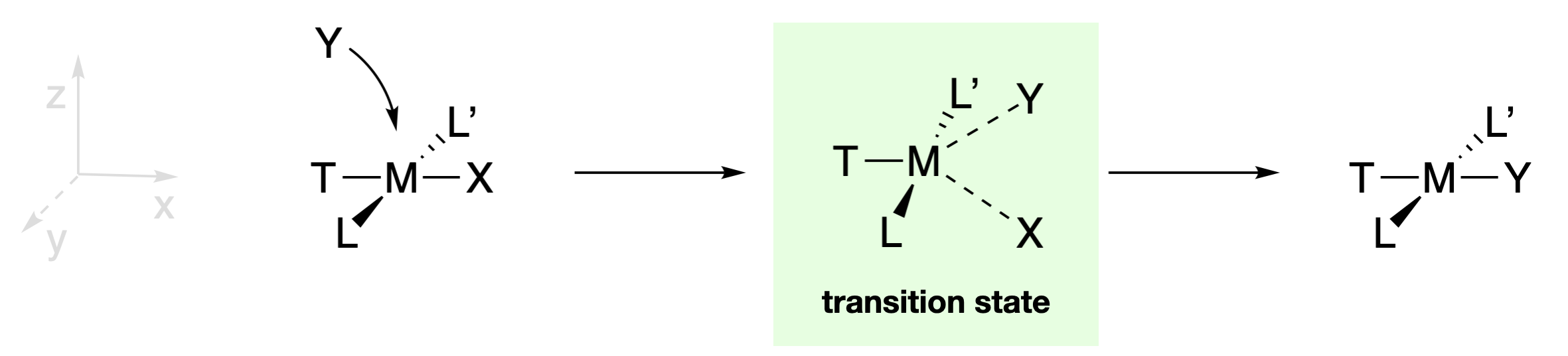
La retención de la estereoquímica y el hecho de que X, Y y T puedan influir en la velocidad de reacción proporcionan pistas sobre la naturaleza de los intermedios y/o estados de transición involucrados en estas reacciones. La existencia de estructuras piramidales cuadradas de cinco coordenadas, como las de\(\ce{[Ni(CN)5]^3-}\) y\(\ce{[Pt(SnCl3)5]^3-}\), sugiere que los intermedios de cinco coordenadas son posibles. Sin embargo, las sustituciones de complejos planos cuadrados generalmente se clasifican como mecanismos de intercambio asociativo (\(I_a\)) porque el aislamiento de un verdadero intermedio rara vez se logra. En cualquier caso, la retención de la estereoquímica se explica por un estado de transición bipiramidal trigonal de cinco coordenadas en el que X, Y y T están cada uno en el plano trigonal (junto con el centro metálico). A medida que el enlace M-X se está rompiendo, el enlace M-Y se está formando e Y reemplaza a X en la posición trans a T. Debido a que T, Y y X están en el plano trigonal en estado de transición, los tres ligandos son capaces de interactuar con los mismos\(d\) orbitales del ion metálico central. Así, las identidades de X, Y y T deben influir en la capacidad del enlace M-X para romperse y el enlace M-Y para formarse. Por otro lado, L y L' están en un plano perpendicular, e interactuarían con orbitales diferentes a X e Y. Esto explica por qué los ligandos de espectador L y L' tienen poco efecto sobre la velocidad de reacción, ya que están interactuando con orbitales diferentes a los involucrados en la ruptura de enlaces y la creación de enlaces.
La vía asistida por solvente puede ocurrir a través de estados de transición similares y etapas mecanicistas, excepto que hay etapas adicionales que involucran asociación y desplazamiento de solventes.
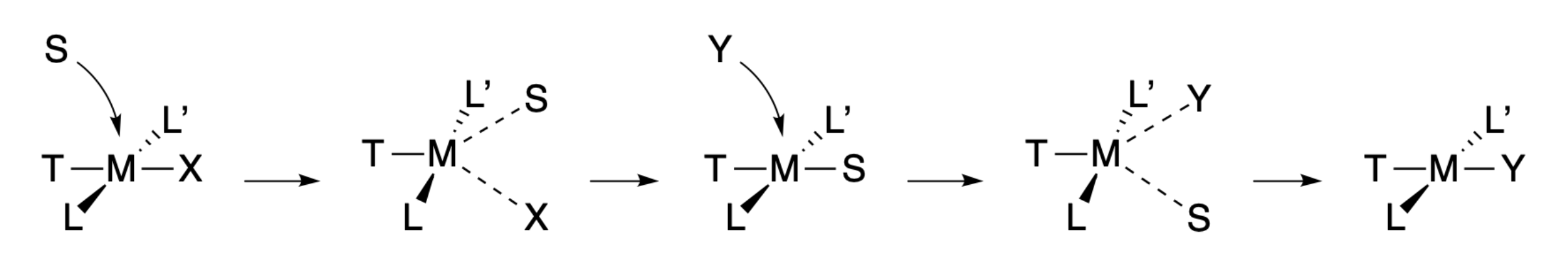
Aunque existe consenso general de que los complejos planos cuadrados reaccionan a través de vías asociativas, la caracterización de intermedios y/o estados de transición se ha mantenido esquiva, y todavía hay debate sobre los intrincados detalles de los mecanismos de reacción que involucran complejos planos cuadrados. Por ejemplo, hay argumentos de que puede existir un estado de transición de seis coordenadas en la vía solvente-asistente.


