14.3.5: Hidrogenación por Catalizador de Wilkinson
- Page ID
- 81673
Compuestos organometálicos como catalizadores de hidrogenación
Las inserciones migratorias juegan un papel importante en la catálisis.
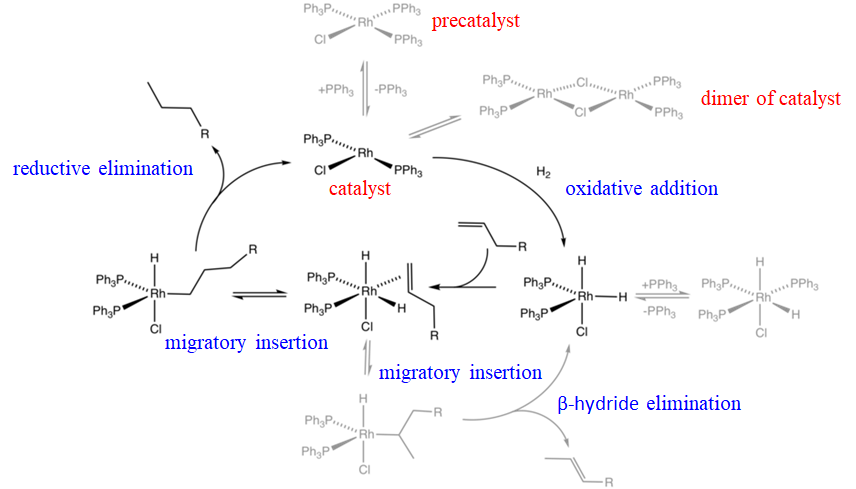
Por ejemplo, un catalizador Rh llamado catalizador de Wilkinson es un catalizador de hidrogenación eficaz para olefinas. El mecanismo de hidrogenación implica una combinación de adiciones oxidativas, inserciones migratorias de olefinas y eliminaciones reductoras (Fig. \(\PageIndex{1}\)). El catalizador de Wilkinson es el complejo plano cuadrado de cloro tris (trifenilfosfina) rodio (I). Esta molécula es en realidad un precatalizador que se convierte en el catalizador real cuando pierde estadísticamente un ligando de trifenilfosfina produciendo cloro bis (trifenilfosfina) rodio (I). La pérdida de este ligando es una reacción reversible, y así el catalizador está en equilibrio químico con el precatalizador. El catalizador realmente está en un segundo equilibrio químico con su dímero. El catalizador de cloro bis (trifenilfosfina) rodio (I) puede sufrir una adición oxidativa en presencia de hidrógeno para formar un complejo trigonal bipiramidal clorodihidrido bis (trifenilfosfina) (III) rodio. Esta especie se encuentra en equilibrio químico con una especie octaédrica clorodihidrido tris (trifenil fosfina) rodio (III) que se puede formar debido a la presencia de ligandos de trifenilfosfina libres en el sistema. La especie bipiramidal trigonal puede entonces añadir una olefina que se une de lado a la Rh. Debido a que la olefina está en posición cis-con respecto al ligando hidruro, puede sufrir una inserción de olefina. El enlace Rh-C puede formarse con el primer o el segundo carbono en la cadena carbonada de la olefina, dando un complejo alquilo lineal y uno ramificado, respectivamente. El complejo ramificado puede sufrir una eliminación de β-hidruro, reformando así el complejo Rh bipiramidal trigonal y una olefina. Esta reacción es una reacción secundaria debido a que el complejo de alquilo ramificado está más abarrotado estericamente que el complejo lineal. El complejo de alquilo lineal Rh puede sufrir una eliminación reductora para formar el alcano lineal y el catalizador de RHCl (PPh 3) 2. Esto completa el ciclo catalítico y puede comenzar un nuevo ciclo.


