14.4.1: Polimerizaciones Ziegler-Natta
- Page ID
- 81614
Otro ejemplo de una reacción catalítica organometálica es la polimerización de olefinas Ziegler-Natta. Esta reacción es de gran importancia industrial para la producción de olefinas como el polietileno. Existen catalizadores Ziegler-Natta heterogéneos y homogéneos. El mecanismo para los catalizadores homogéneos es generalmente bien entendido. Los catalizadores homogéneos son típicamente catalizadores de metaloceno.
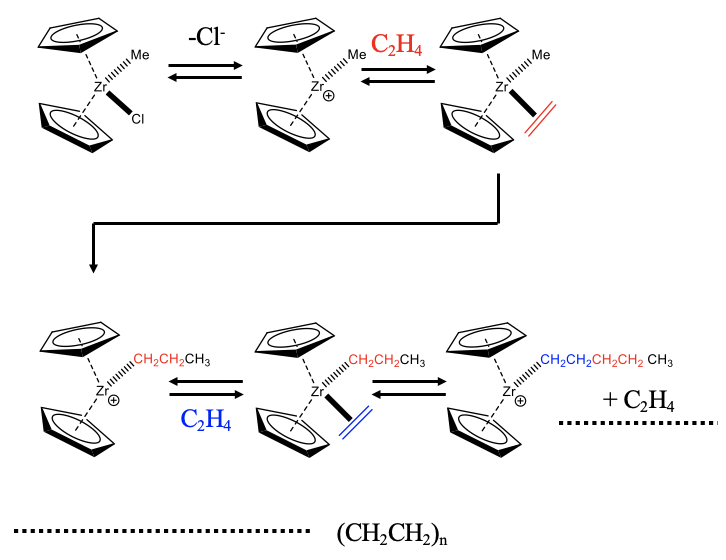
Se muestra un ejemplo de un catalizador basado en circonio (Fig. \(\PageIndex{1}\)). El catalizador es un catión complejo coordinadamente insaturado con dos anillos de ciclopentadienilo y un grupo metilo. El catalizador se forma a partir de su precatalizador, una molécula neutra con un ligando cloro adicional. El catalizador añade oxidativamente una olefina como una molécula de etileno al sitio coordinativamente insaturado. A esta etapa se le sigue una etapa de inserción de olefina que produce un grupo propilo. La inserción migratoria conduce a la formación de un sitio vacante, que puede ser reocupado por otra molécula de etileno. Esta molécula puede insertarse en la cadena de propilo prolongando así la cadena de propilo a una cadena de pentilo. La etapa de inserción de olefinas genera otro sitio vacante que puede ser reocupado por una nueva molécula de etileno. Repetir el ciclo catalítico muchas veces finalmente conduce al polietileno.
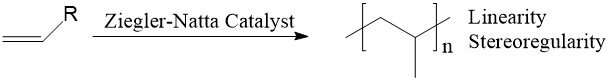
El catalizador Ziegler-Natta (ZN), llamado así por dos químicos: Karl Ziegler y Giulio Natta, es una poderosa herramienta para polimerizar α-olefinas con alta linealidad y estereoselectividad (Figura 1). Un sistema típico de catalizador de ZN generalmente contiene dos partes: un compuesto de metal de transición (metales del Grupo IV, como Ti, Zr, Hf) y un compuesto de organoaluminio (cocatalizador). Los ejemplos comunes de sistemas catalíticos de ZN incluyen TiCl 4 + Et 3 Al y TiCl 3 + AlEt 2 Cl.
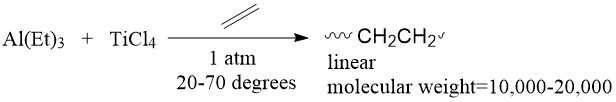
En 1953, el químico alemán Karl Ziegler descubrió un sistema catalítico capaz de polimerizar etileno en polietileno lineal de alto peso molecular que las técnicas de polimerización convencionales no podían hacer. 1 El sistema contenía un haluro de metal de transición con un compuesto alquilo del elemento del grupo principal (Figura\(\PageIndex{3}\)).
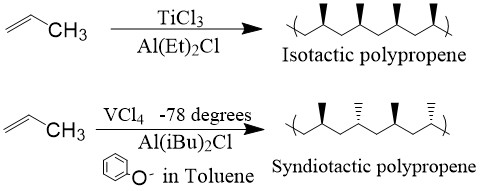
Siguiendo el diseño catalítico, el químico italiano Giulio Natta encontró que la polimerización de α-olefinas resultó en estructuras estereorregulares, 2 ya sea sindiotácticas o isotácticas, dependiendo del catalizador utilizado (Figura\(\PageIndex{4}\)). Debido a estos importantes descubrimientos, Karl Ziegler y Giulio Natta compartieron el Premio Nobel de Química en 1963.
Ventajas sobre el método de polimerización tradicional
Tradicionalmente, la polimerización de α-olefinas se realizaba por polimerización radical (Figura\(\PageIndex{5}\)). El problema con esta técnica fue que la formación de radicales alílicos no deseados conducían a polímeros ramificados. 3 Por ejemplo, la polimerización radical de propeno dio polímeros ramificados con gran distribución de peso molecular. Además, la polimerización radical no tuvo control sobre la estereoquímica. El polietileno lineal no ramificado y el polipropileno estereorregulado no pudieron fabricarse mediante polimerización por radicales libres. Esta técnica limitó en gran medida las aplicaciones potenciales de estos materiales poliméricos.
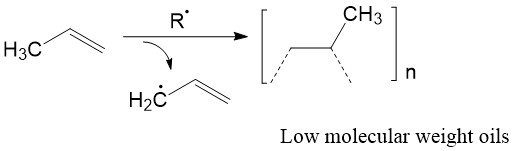
La invención del catalizador ZN abordó con éxito estos dos problemas. El catalizador puede dar polímeros lineales de α-olefina con pesos moleculares altos y controlables. Además, hace posible la fabricación de polímeros con tacticidad específica. Al controlar la estereoquímica de los productos, se pueden lograr polímeros sindiotácticos o isotácticos.
Mecanismo de polimerización catalítica Ziegler-Natta
Activación del catalizador Ziegler-Natta
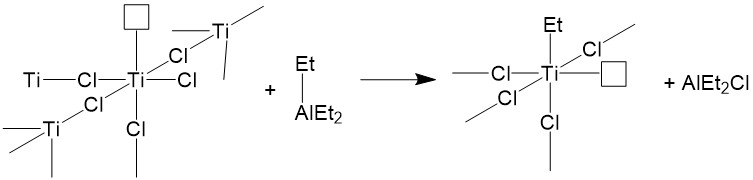
Es necesario comprender la estructura del catalizador antes de entender cómo funciona este sistema catalítico. En el presente documento, se toma como ejemplo el sistema catalizador TiCl 4+AlEt 3. El compuesto de cloruro de titanio tiene una estructura cristalina en la que cada átomo de Ti está coordinado a 6 átomos de cloro. En la superficie cristalina, un átomo de Ti está rodeado por 5 átomos de cloro con un orbital vacío para ser llenado. Cuando entra Et 3 Al, dona un grupo etilo al átomo de Ti y el átomo de Al se coordina a uno de los átomos de cloro. En tanto, un átomo de cloro del titanio es expulsado durante este proceso. Así, el sistema catalizador aún tiene un orbital vacío (Figura\(\PageIndex{6}\)). El catalizador se activa mediante la coordinación de AlEt 3 a átomo de Ti.
Paso de iniciación
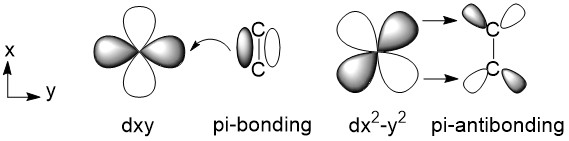
La reacción de polimerización se inicia formando un complejo alqueno-metal. Cuando un monómero vinílico como el propileno llega al centro activo del metal, se puede coordinar al átomo de Ti superponiendo sus orbitales. Como se muestra en la Figura\(\PageIndex{7}\), hay un orbital dxy vacío y un orbital dx 2-y 2 lleno en el caparazón más exterior de Ti (los otros cuatro orbitales no se muestran aquí). El doble enlace carbono-carbono del alqueno tiene un enlace pi, el cual consiste en un orbital de unión pi relleno y un orbital vacío antiunión pi. Entonces, el orbital de unión pi del alqueno y el orbital dxy del Ti se unen y comparten un par de electrones. Una vez que están juntos, ese orbital dx 2 -y 2 de Ti se acerca poderosamente al orbital pi-antibonding, compartiendo otro par de electrones.
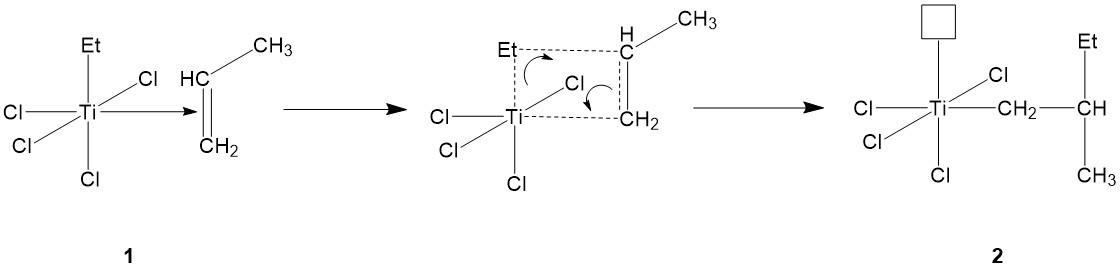
El complejo alqueno-metal formado (1) luego pasa por barajado de electrones, con varios pares de electrones desplazando sus posiciones: El par de electrones del enlace pi carbono-carbono se desplaza para formar un enlace Ti-carbono, mientras que el par de electrones del enlace entre Ti y el grupo etilo AlEt3' se desplaza para formar un enlace entre el grupo etilo y el carbono sustituido con metilo del propileno (Figura\(\PageIndex{8}\)). Después del barajado de electrones, Ti vuelve con un orbital vacío nuevamente, necesitando electrones para llenarlo (2).
Paso de propagación
Cuando entran otras moléculas de propileno, este proceso comienza una y otra vez, dando polipropileno lineal (Figura\(\PageIndex{9}\)).

Paso de terminación
La terminación es el paso final de una polimerización de crecimiento en cadena, formando polímeros “muertos” (productos deseados). La Figura\(\PageIndex{10}\) ilustra varios enfoques de terminación desarrollados con la ayuda del cocatalizador AlEt 3. 4
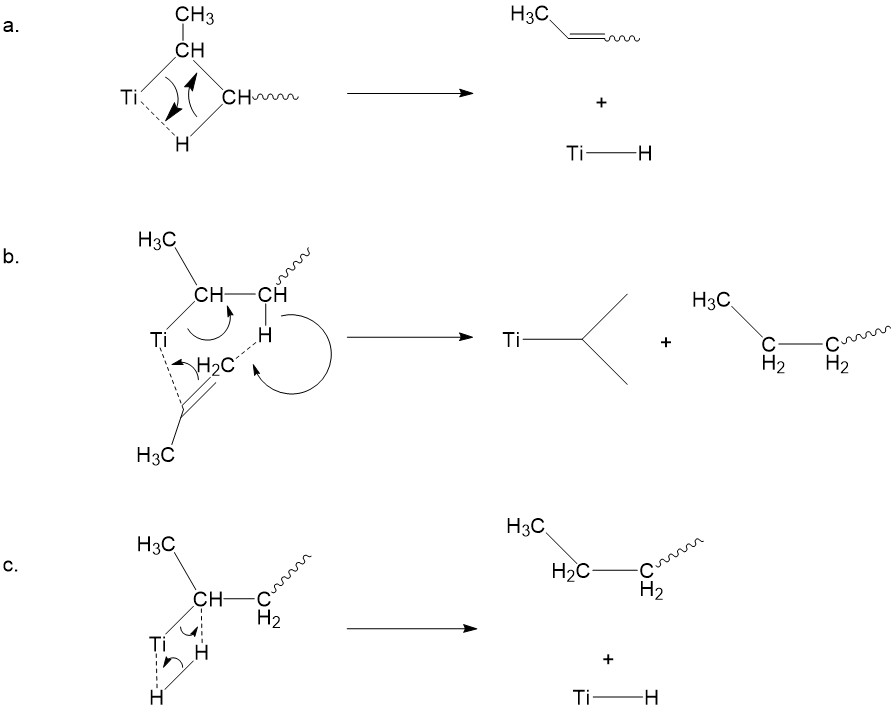
Estudio mecanicista: experimentos con efecto de isótopos cinéticos
A diferencia del mecanismo discutido anteriormente, también existe un mecanismo competidor propuesto por Ivin y compañeros de trabajo. 5 Propusieron que se produce un desplazamiento de 1,2-hidrógeno previo a la asociación del monómero, dando un intermedio de carbeno (Figura\(\PageIndex{11}\)).
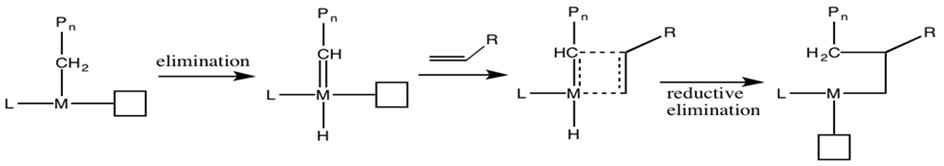
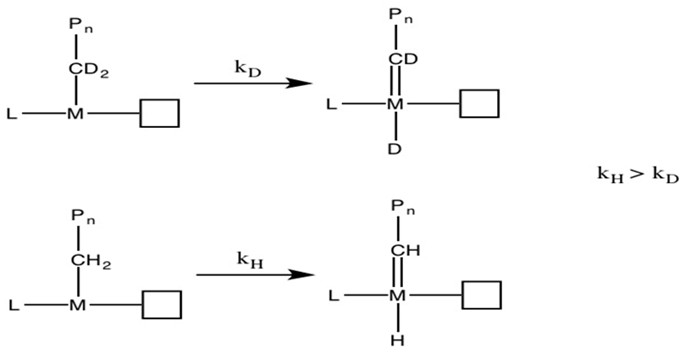
Para determinar el mecanismo real, Grubbs 6 realizó experimentos de efecto cinético de isótopos (KIE). Debido a sus diferentes pesos, el enlace carbono-deuterio reacciona más lento que el enlace carbono-hidrógeno (Figura\(\PageIndex{12}\)). Si dichos enlaces están involucrados en la etapa de determinación de la tasa, las especies isotópicas deben proceder en menor tasa.
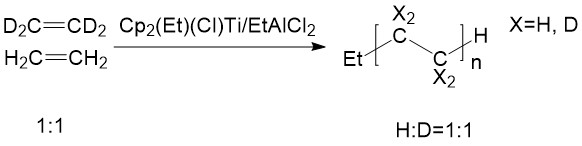
En el experimento de Grubbs, etileno deuterado y etileno normal fueron catalizados por catalizador Ziegler-Natta con relación 1:1 (Figura\(\PageIndex{13}\)). El resultado mostró que la relación H/D en los polímeros resultantes seguía siendo 1:1 .6 Esto indicó que no hay escisión o formación de enlaces carbono-hidrógeno involucrada en la etapa de determinación de la velocidad. Por lo tanto, se excluyó el mecanismo propuesto por Ibin.
Regio- y estero-selectividad
Regio-selectividad
Para la polimerización de propeno, la mayoría de los catalizadores ZN son altamente regioselectivos, favoreciendo la inserción 1,2-primaria [M-R + CH2=CH (Me) =M-CH2-CH (Me) (R)] (Figura\(\PageIndex{14}\)), debido a efectos electrónicos y estéricos. 7

Estereo-selectividad
La estereoquímica de los polímeros hechos de catalizador Zn puede regularse bien mediante el diseño racional de ligandos. Mediante el uso de diferentes sistemas de ligandos, se pueden obtener polímeros sindiotácticos o isotácticos (Figura\(\PageIndex{15}\)).
La estereoquímica relativa de los centros quirales adyacentes dentro de una macromolécula se define como tacticidad. Tres tipos de estereoquímica son posibles: isotáctica, sindiotáctica y atáctica. En los polímeros isotácticos, los sustituyentes se localizan en el mismo lado de la cadena principal del polímero, mientras que los sustituyentes en los polímeros siodiotácticos tienen posiciones alternativas. En polímeros atácticos, los sustituyentes se colocan aleatoriamente a lo largo de la cadena.
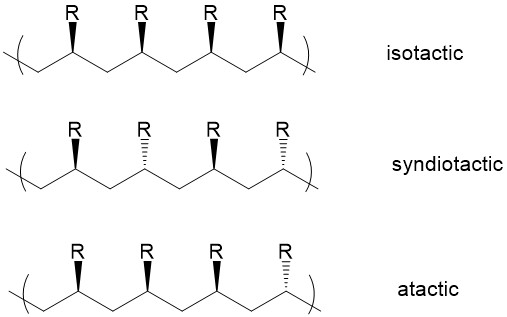
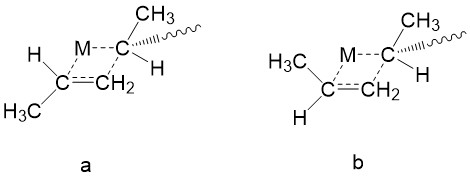
La elección del catalizador ZN regula la estereoquímica. Aquí se utiliza la polimerización de propileno como ejemplo. Recordemos la sección del mecanismo, un monómero se acerca al centro metálico y forma un anillo intermedio de cuatro miembros. La unión de un monómero al enlace reactivo metal-carbono debe ocurrir desde el sitio menos impedido. 8 Como se muestra en la Figura\(\PageIndex{16}\), el trans-complejo en el que el metilo en la cadena en crecimiento es trans al grupo metilo en el monómero entrante, debe ser favorecido energéticamente que el complejo cis, ya que el complejo trans experimenta menos efecto estérico.
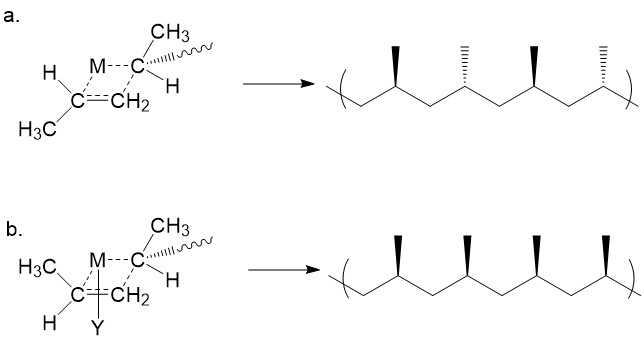
Después del complejo trans, el grupo metilo en el monómero recién agregado es trans al del monómero anterior. El paso se repite para que se obtenga un polipropileno sindiotáctico (Figura\(\PageIndex{17}\) a). Sin embargo, si el centro metálico se coordina con ligandos voluminosos (por ejemplo, grupos -IBu, -Et2), como se indica con Y en la Figura\(\PageIndex{17}\) b, el monómero entrante adoptará una conformación cis para evitar un efecto estérico serio con el ligando voluminoso. Así, en presencia de ligando voluminoso, el monómero de propileno es cis con respecto a la cadena en crecimiento. Esto da como resultado un producto isotáctico.
Aplicaciones
Los catalizadores ZN han proporcionado una industria rentable a nivel mundial con una producción de más de 160 mil millones de libras y creación de numerosas posiciones. 9 Estos productos han sido ampliamente aplicados en diferentes áreas, mejorando en gran medida la calidad de vida de las personas. Pueden catalizar α-olefinas para producir diversos polímeros comerciales, como polietileno, polipropileno y polibuteno-1. Se informa que el polietileno y el polipropileno son los dos primeros plásticos sintéticos ampliamente utilizados en la palabra. 10
Entre los polietileno fabricados por catalizadores ZN, existen tres clases principales: polietileno de alta densidad (HDPE), polietileno lineal de baja densidad (LLDPE) y polietileno de peso molecular ultra alto (UHMWPE). El HDPE, un homopolímero lineal, se aplica ampliamente en contenedores de basura, botellas de detergente y tuberías de agua debido a su alta resistencia a la tracción. Comparado con el HDPE cuyo grado de ramificación es bastante bajo, el LLDPE tiene muchas ramas cortas. Su mejor tenacidad, flexibilidad y resistencia al agrietamiento por tensión lo hace adecuado para materiales como cubiertas de cables, plástico de burbujas, etc. El UHMWPE es polietileno con un peso molecular entre 3.5 y 7.5 millones. Este material es extremadamente resistente y químicamente resistente. Por lo tanto, a menudo se utiliza para hacer engranajes y articulaciones artificiales.
En comparación con el polietileno, el polipropileno tiene propiedades mecánicas mejoradas y resistencia térmica debido al grupo metilo adicional. Además, el polipropileno isotáctico es más rígido y más resistente a la fluencia que el polipropileno atáctico. El polipropileno tiene una amplia gama de aplicaciones en ropa, plásticos médicos, empaque de alimentos y construcción de edificios.
Alcance y limitaciones del sustrato
Los catalizadores ZN son efectivos para la polimerización de α-olefinas (etileno, propileno) y algunos dienos (butadieno, isopreno). Sin embargo, no funcionan para algunos otros monómeros, como 1.2 dobles enlaces disustituidos. El cloruro de vinilo tampoco puede ser polimerizado por el catalizador ZN, ya que la polimerización de vinilo por radicales libres se inicia durante la reacción. Otra situación en la que los catalizadores ZN no funcionan es cuando el sustrato es acrilato. La razón es que los catalizadores de ZN a menudo inician la polimerización aniónica de vinilo en esos monómeros. 11
Referencias
- Ziegler, K.; Holzkamp, E.; Breil, H.; Martin, H., Polimerización Von Athylen Und Anderen Olefinen. Angew Chem Int Editar 1955, 67 (16), 426-426.
- Natta, G., Une Nouvelle Classe De Polímeros D Alfa-olefinas Ayant Une Regularite De Estructura Excepcional. J Polym Sci 1955, 16 (82), 143-154.
- Mulhaupt, R., Catálisis de polimerización catalítica y post polimerización cincuenta años después del descubrimiento de los catalizadores de Ziegler. Macromol Chem Phys 2003, 204 (2), 289-327.
- Sinn, H.; Kaminsky, W., Catálisis Ziegler-Natta. En Avances en Química Organometálica, Stone, F. G. A.; Robert, W., Eds. Prensa Académica: 1980; Vol. Volumen 18, pp 99-149.
- Igin, K. J.; Rooney, J. J.; Stewart, C. D.; Green, M. L.; Mahtab, R., Mecanismo para la polimerización estereoespecífica de olefinas por catalizadores Ziegler—Natta. Revista de la Sociedad Química, Comunicaciones Químicas 1978, (14), 604-606.
- Soto, J.; Steigerwald, M. L.; Grubbs, R. H., Respecto al Mecanismo de Polimerización Ziegler-Natta - Efectos de isótopos sobre las tasas de propagación. J Am Chem Soc 1982, 104 (16), 4479-4480.
- Busico, V.; Cipullo, R.; Pellecchia, R.; Ronca, S.; Roviello, G.; Talarico, G., Diseño de catalizadores estereoselectivos de polimerización de propeno Ziegler-Natta. P Natl Acad Sci USA 2006, 103 (42), 15321-15326.
- Zambelli, A., Estereregulación de la Polimerización de propileno. Abtr Pap Am Chem S 1974, 34-34.
- Ittel, S. D.; Johnson, L. K.; Brookhart, M., Catalizadores de metales tardíos para homo- y copolimerización de etileno. Chem Rev 2000, 100 (4), 1169-1203.
- Macbride, R. R., Tambores de Polietileno de Alto Peso Molecular Muestran Señales de Convertirse en Grandes Negocios. Mod Plast 1975, 52 (12), 10-&.
- Ivan, B., Comparación de Sistemas Vivos de Polimerización. Macromol Symp 1994, 88, 201-215.
Colaboradores y Atribuciones
- Fangyuan Dong y Ru Deng


