15.4.1: Boranes
- Page ID
- 81403
Los boranes y la vinculación en boranes
Los boranos se introdujeron en el Capítulo 8 (Sección 8.6.1). Los boranos son compuestos que consisten en boro e hidrógeno.El ejemplo más básico es el diborano (\(\ce{B2H6}\)), todos los boranos son compuestos deficientes en electrones. Por\(\ce{B2H6}\) lo general, se necesitan 14 electrones para formar 2C,2e-enlaces, pero solo están presentes 12 electrones de valencia. Debido a esto hay dos enlaces B-H-B, que tienen tres centros, pero sólo dos electrones (3c, 2e enlace). Esto puede interpretarse como un orbital molecular que se forma combinando los orbitales atómicos aportados de los tres átomos. En los boranos más complicados no solo se producen enlaces B-H-B sino también B-B-B 3c, 2e-enlaces. En tal enlace los tres átomos B se encuentran en las esquinas de un triángulo equilátero con sus orbitales híbridos sp 3 superpuestos en su centro. Una de las propiedades comunes de los boranos es, que son inflamables o reaccionan espontáneamente con el aire. Se queman con una llama verde característica. Y son sustancias incoloras, diamagnéticas.
Nomenclatura
En los boranos neutros el número de átomos de boro viene dado por un prefijo y el número de átomos de hidrógeno se da entre paréntesis detrás del nombre. ejemplo:\(\ce{B5H11}\) -> pentaborano (11),\(\ce{B4H10}\) -> tetraborano (10) Para iones principalmente se da el número de átomos de hidrógeno y que el número de átomos de boro, detrás el nombre el cargo se da entre paréntes. ejemplo:\(\ce{[B6H6]^{2-}}\) -> hexahidrohexaborat (2-)
Regla de los vades, Estructuras de boranes
La regla de Wades ayuda a predecir la forma general de un borano a partir de su fórmula. Ken Wade desarrolló un método para la predicción de formas de racimos de boranos; sin embargo, puede ser utilizado para una amplia gama de boranos sustituidos (como los carboranos) así como otras clases de compuestos de conglomerados. Las reglas de Wade se utilizan para racionalizar la forma de los cúmulos de boranos calculando el número total de pares de electrones esqueléticos (SEP) disponibles para la unión de conglomerados. Al usar las reglas de Wade es clave entender la relación estructural de diversos boranos.
La metodología general a seguir al aplicar las reglas de Wade es la siguiente:
- Determinar el número total de electrones de valencia de la fórmula química, es decir, 3 electrones por B y 1 electrón por H.
- Restar 2 electrones por cada unidad B-H (o C-H en un carborano).
- Divide el número de electrones restantes por 2 para obtener el número de pares de electrones esqueléticos (SEP).
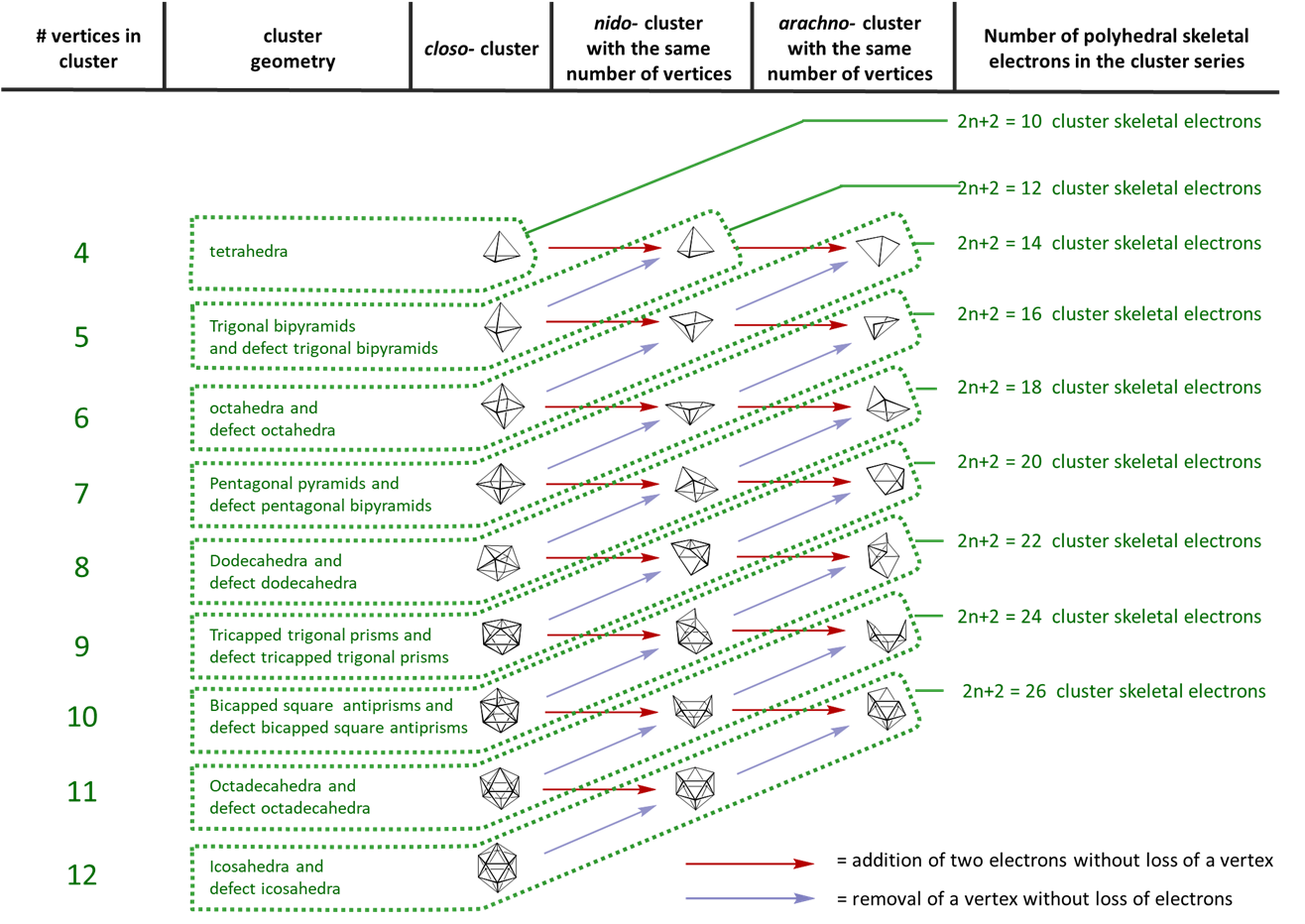
- Un grupo con n vértices (es decir, n átomos de boro) y n +1 SEP para la unión tiene una estructura closo.
- Un grupo con n-1 vértices (es decir, n -1 átomos de boro) y n +1 SEP para la unión tiene una estructura nido.
- Un grupo con n -2 vértices (es decir, n -2 átomos de boro) y n +1 SEP para la unión tiene una estructura aracno.
- Un grupo con n -3 vértices (es decir, n -3 átomos de boro) y n +1 SEP para la unión tiene una estructura hifo.
- Si el número de átomos de boro (es decir, n) es mayor que n +1 SEP entonces el boro extra ocupa una posición de remate en una fase triangular.
| Fórmula Esquelética | Pares de electrones esqueléticos | tipo |
|---|---|---|
| \(\ce{[B_{n} H_{n}]^{2-}}\) | n+1 | closo |
| \(\ce{B_{n} H_{n + 4}}\) | n+2 | nido |
| \(\ce{B_{n} H_{n + 6}}\) | n+3 | aracno |
| \(\ce{B_{n} H_{n + 8}}\) | n+4 | bombo |
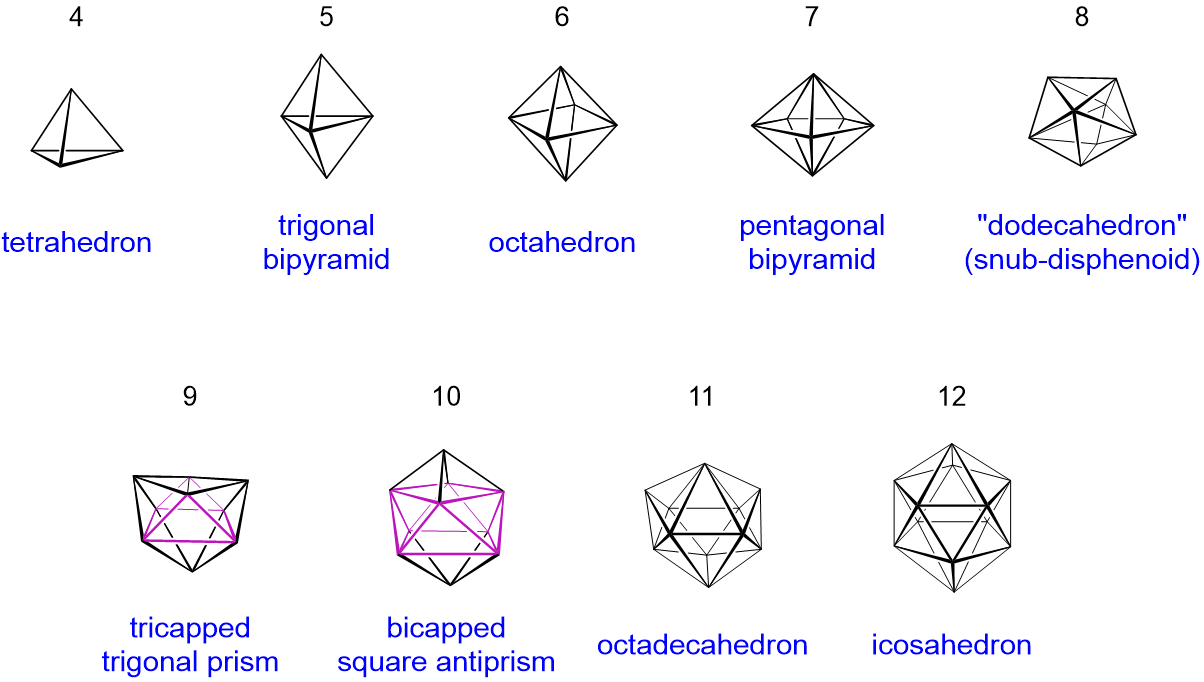
Los poliedros siempre están conformados por caras triangulares, por lo que se les llama deltaedra. Por lo general, hay tres posibles tipos de estructura:
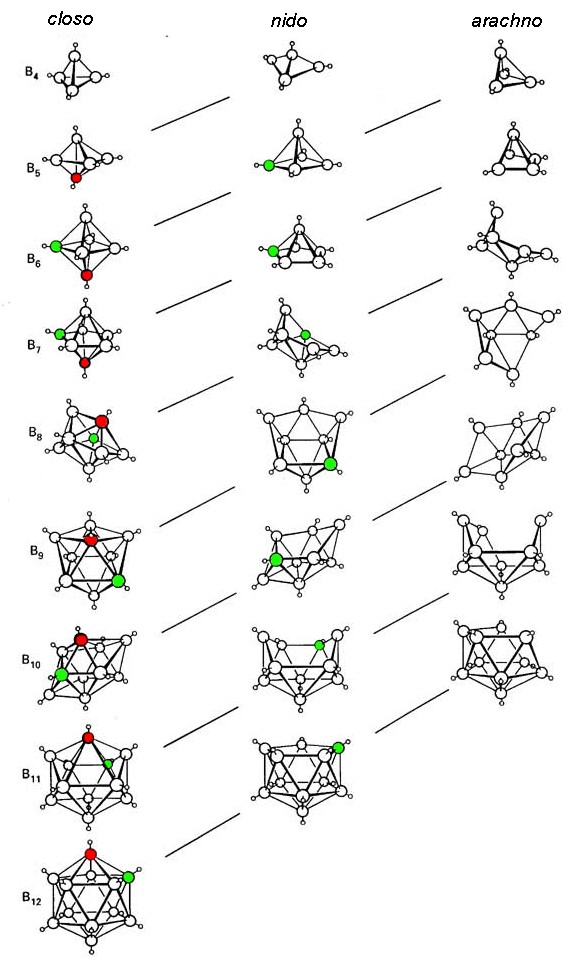
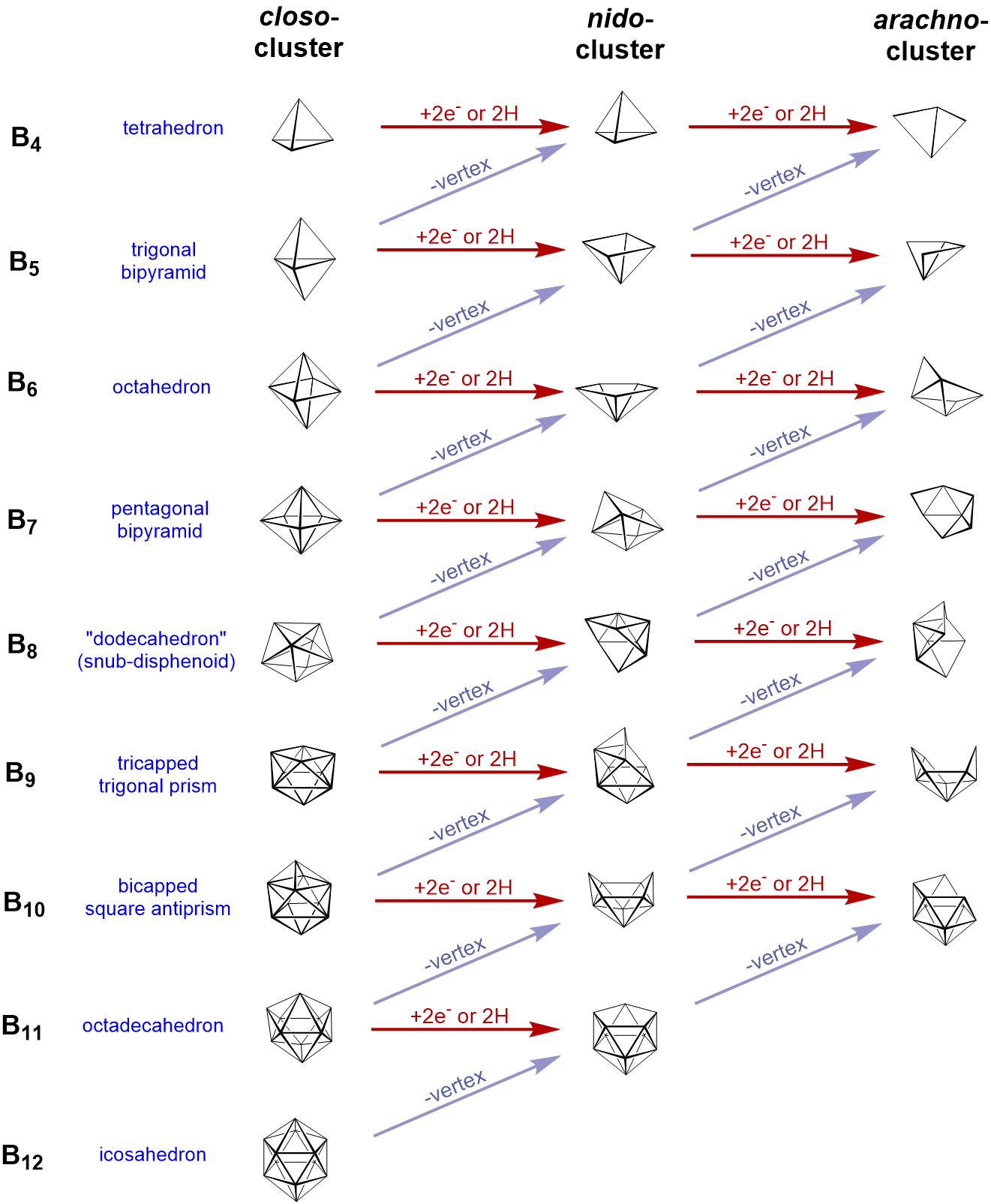
Relación estructural entre closo, nido y aracno boranos (y boranos heterosustituidos). Las líneas diagonales conectan especies que tienen el mismo número de pares de electrones esqueléticos (SEP). Se omiten los átomos de hidrógeno excepto los de la estructura B-H. El átomo rojo se omite primero, el átomo verde se elimina en segundo lugar. Adaptado de R. W. Rudolph, Acc. Chem. Res., 1976, 9, 446.
Closo-boranos
- deltaedros cerrados sin B-H-B 3c,2e-bonos
- térmicamente estable y moderadamente reactivo.
- ejemplo:\(\ce{[B5H5]^{2-}}\): el ion construye un poliedro trigonal bipiramidal
Nido boranes
- closo borano con una esquina menos y adición de dos átomos de hidrógeno en su lugar
- Los enlaces B-H-B y los enlaces B-B son posibles.
- la estabilidad térmica se encuentra entre closo- y aracno-boranos.
- ejemplo:\(\ce{B5H9}\) su estructura puede ser asumida como el deltaedro octaédrico de\(\ce{[B6H6]^{2-}}\) sin una pirámide tetragonal de esquina
Aracno-boranes
- deltaedro de closo borano pero con dos unidades BH eliminadas y dos átomos de H añadidos.
- tiene que tener B-H-B 3c, 2e-bonos.
- térmicamente inestable a temperatura ambiente y altamente reactivo.
- ejemplo:\ {\ ce {B4H10}\) la estructura se puede derivar de\(\ce{[B6H6]^{2-}}\) -> deltaedro con dos esquinas menos.
También existen otras estructuras como los hifo-boranos, pero son menos importantes.
Reglas de Wade
¿Cuál es la estructura de B 5 H 11?
Solución
- Número total de electrones de valencia = (5 x B) + (11 x H) = (5 x 3) + (11 x 1) = 26
- Número de electrones por cada unidad B-H = (5 x 2) = 10
- Número de electrones esqueléticos = 26 — 10 = 16
- Número SEP = 16/2 = 8
- Si n +1 = 8 y n -2 = 5 átomos de boro, entonces n = 7
- La estructura de n = 7 es bipirámide pentagonal, por lo tanto B 5 H 11 es un aracno basado en una bipirámide pentagonal con dos vértices faltantes.
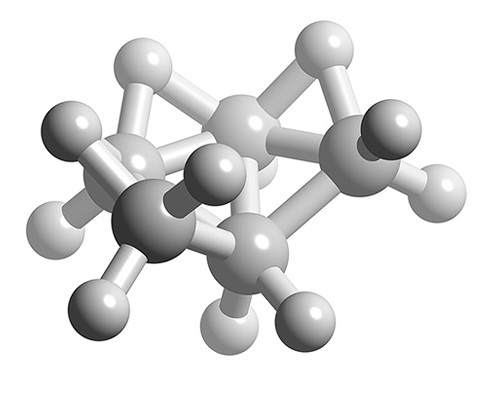
Representación de bola y palo de la estructura de B 5 H 11.
¿Cuál es la estructura de B 5 H 9?
Solución
- Número total de electrones de valencia = (5 x B) + (9 x H) = (5 x 3) + (9 x 1) = 24
- Número de electrones por cada unidad B-H = (5 x 2) = 10
- Número de electrones esqueléticos = 24 — 10 = 14
- Número SEP = 14/2 = 7
- Si n +1 = 7 y n -1 = 5 átomos de boro, entonces n = 6
- La estructura de n = 6 es octaédrica, por lo tanto B 5 H 9 es una estructura nido basada en una estructura octaédrica con un ápice faltante.
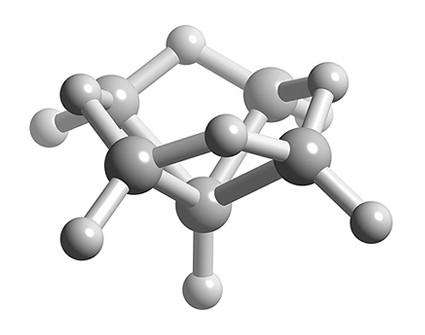
Representación de bola y palo de la estructura de B 5 H 9.
¿Cuál es la estructura de B 6 H 6 2 -?
- Número total de electrones de valencia = (6 x B) + (3 x H) = (6 x 3) + (6 x 1) + 2 = 26
- Número de electrones por cada unidad B-H = (6 x 2) = 12
- Número de electrones esqueléticos = 26 — 12 = 14
- Número SEP = 14/2 = 7
- Si n +1 = 7 y n átomos de boro, entonces n = 6
- La estructura de n = 6 es octaédrica, por lo tanto B 6 H 6 2 - es una estructura closo basada en una estructura octaédrica.
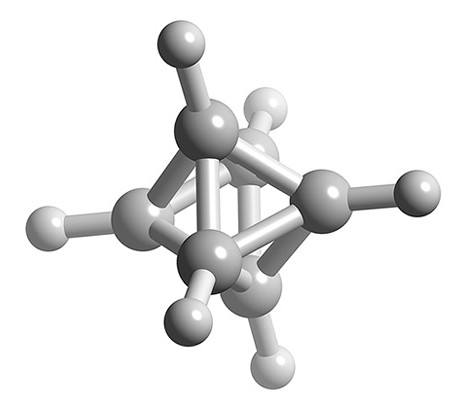
Representación de bola y palo de la estructura de B 6 H 6 2 -.
\(\PageIndex{1}\)La tabla proporciona un resumen del cúmulo de boranos con la fórmula general B n H n x - y sus estructuras definidas por las reglas de Wade.
| Tipo | Fórmula básica | Ejemplo | # de verticies | # de vacantes | # de e- en B + cargo | # de MoS de unión |
|---|---|---|---|---|---|---|
| Closo | B n H n 2 - | B 6 H 6 2 - | n | 0 | 3n + 2 | n + 1 |
| Nido | B n H n 4 - | B 5 H 9 | n + 1 | 1 | 3n + 4 | n + 2 |
| Aracno | B n H n 6 - | B 4 H 10 | n + 2 | 2 | 3n + 6 | n + 3 |
| Hypho | B n H n 8 - | B 5 H 11 2 - | n + 3 | 3 | 3n + 8 | n + 4 |
Notas y Referencias
R. W. Rudolph, Acc. Chem. Res., 1976, 9, 446.
K. Wade, Adv. Inorg. Chem. Radiochem. , 1976, 18, 1.
D. F. Shriver, P. W. Atkins, Química Inorgánica Tercera edición, Oxford University Press, 2001
Patrick O' Malley de la Universidad de Manchester vía Wolearn.org (https://www.wolearn.org/pluginfile.php/1492/mod_resource/content/1/Wades_Rules.pdf)
Template:ContribConnectionshttps://archive.cnx.org/contents/ffb...2/wade-s-rules
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

