1.1: Desarrollo histórico de la teoría atómica
- Page ID
- 70064
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Desarrollo de la Teoría Atómica
Desde la antigüedad, los humanos pensaron en explicar el mundo material en toda su complejidad. La idea básica detrás de todas las teorías de elementos es que la materia que nos rodea está compuesta de materia más simple. Este asunto puede estar compuesto de materia aún más simple. El asunto más sencillo se llamaría un elemento.
Las teorías del primer elemento fueron teorías de un elemento: El filósofo griego Thales pensó que el agua era el único elemento, y todo era una forma de agua. Los anaximenos pensaban que el aire era el único elemento, y Heráclito creía que el fuego era el único elemento (Figura 1.1.1).



Sin embargo, con un solo elemento asumido era difícil explicar satisfactoriamente el mundo material en toda su complejidad. Esto podría hacerse de manera más satisfactoria mediante una teoría de múltiples elementos. El primer filósofo que introdujo una teoría multielemento fue Empédocles. Sugirió una teoría de cuatro elementos con fuego, aire, agua y suelo como elementos (Figura 1.1.2).

Primeras ideas atomísticas

Las teorías de los elementos de Tales, Anaximenes, Heráclito y Empédocles fueron todas no atomísticas. Esto quiere decir que no incluyeron la idea de que los elementos estaban hechos de pequeñas partículas que eran indivisibles. Los primeros filósofos griegos que introdujeron la teoría de elementos atomísticos fueron Leukippes y Demócritas (Figura 1.1.3). Asumieron que las partículas no se pueden dividir en partículas más pequeñas infinitamente a menudo. En última instancia, después de muchas divisiones, se llegaría a partículas que no podrían dividirse más, y estas partículas se llamarían átomos. La teoría de elementos atomísticos permite muchos elementos diferentes, lo que ayuda a explicar satisfactoriamente la complejidad del mundo material. Sin embargo, Leukippes y Demócritas no sabían cuántos elementos diferentes había, y cómo se distinguían realmente diferentes átomos de diferentes elementos. Esta pregunta no sería respondida hasta aproximadamente 2000 años después.
Teorías Atómicas Modernas

Aunque la idea atomística ya se conocía en la antigüedad, se olvidó durante mucho tiempo y solo se reintrodujo unos 2000 años después con la hipótesis atómica de Dalton. ¿Qué lleva a la hipótesis del átomo de Dalton? El primer descubrimiento que fue importante para el desarrollo de la teoría atómica moderna fue la ley de la conservación de la masa de Antoine Lavoisier (Fig. 1.1.4). Históricamente, la conservación de la masa y el peso se mantuvo oscura durante milenios por el efecto boyante de la atmósfera terrestre sobre el peso de los gases, efecto que no se entendió hasta que la bomba de vacío permitió por primera vez el pesaje efectivo de los gases mediante básculas. Hasta entonces, en muchos casos la masa parecía aparecer o desaparecer. Por ejemplo, la masa de madera parece desaparecer cuando se quema. No obstante, la masa de la madera en realidad no desaparece solo se convierte en la masa de gases, principalmente dióxido de carbono. Cuando los científicos se dieron cuenta de que la masa nunca desapareció podrían por primera vez embarcarse en estudios cuantitativos de las transformaciones de sustancias. Esto a su vez llevó a la idea de elementos químicos, así como a la idea de que todos los procesos y transformaciones químicas son reacciones simples entre estos elementos. La ley de conservación de la masa establece que la masa de un sistema cerrado de sustancias se mantendrá constante, independientemente de los procesos que actúen dentro del sistema. Una declaración equivalente es que la materia no puede ser creada o destruida, aunque puede cambiar de forma. Esto implica que para cualquier proceso químico en un sistema cerrado, la masa de los reactivos debe ser igual a la masa de los productos.
Ley de Composición Constante
El descubrimiento de la ley de la conservación de la masa condujo al descubrimiento de la ley de la composición constante (también llamada ley de proporciones definitivas) por Joseph Proust (Fig. 1.1.5). Esta ley fue el resultado de un análisis químico que determinó la relación de masa de elementos en sustancias puras. Se encontró que una sustancia pura siempre contiene exactamente la misma proporción de elementos por masa. Por ejemplo, el análisis de elementos de sustancias puras que contienen los elementos carbono y oxígeno sería de 42.9% de carbono y 57.1% de oxígeno o 27.3% de carbono y 72.7% de oxígeno.

La ley fue cuestionada por el compañero francés de Proust, Claude Louis Berthollet, quien argumentó que los elementos podían combinarse en cualquier proporción. La existencia misma de este debate se debió a que en su momento aún no se había desarrollado completamente la distinción entre compuestos químicos puros y mezclas. Cuando se mezclan dos compuestos puros de dos elementos diferentes, entonces la mezcla puede tener una relación de masa continua entre los dos elementos porque los compuestos se pueden mezclar en cualquier proporción. Entonces, para el ejemplo en los dos compuestos entre carbono y oxígeno, en mezclas de los dos podría haber relaciones de carbono a oxígeno variando continuamente entre 27.7% a 42.9% de carbono, y 42.9% a 72.7% de oxígeno. Fue un logro de Proust que fuera capaz de distinguir correctamente entre compuestos puros y mezclas.
La Ley de las Múltiples Proporciones

John Dalton (Fig. 1.1.6) descubrió la ley de proporciones múltiples mediante un análisis cercano de la ley de composición constante de Proust. Notó que si dos elementos forman más de un compuesto entre ellos, entonces las proporciones de las masas del segundo elemento que se combina con una masa fija del primer elemento serán las proporciones de números enteros pequeños, también llamados números enteros. Veamos cuál es el significado de la ley de las múltiples proporciones con un ejemplo:
Ejemplo\(\PageIndex{1}\)
El primer compuesto contiene 42.9% en masa de carbono y 57.1% en masa de oxígeno.
El segundo compuesto contiene 27.3% en masa de carbono y 72.7% en masa de oxígeno.
¡Demuestre que los datos son consistentes con la Ley de Proporciones Múltiples!
Solución
En 100 g del primer compuesto (se elige 100 para facilitar los cálculos) hay 57.1 g O y 42.9 g C.
La masa de O por gramo C es:
57.1 g O/42.9 g C = 1.33 g O por g C
En 100 g del segundo compuesto, hay 72.7 g O y 27.3 g C.
La masa de oxígeno por gramo de carbono es:
72.7 g O/27.3 g C = 2.66 g O por g C
Dividiendo la masa O por g C del segundo compuesto (valor mayor) por la masa O por g C del primer compuesto da:
2.66:1.33 = 2:1
2 y 1 son ambos números enteros.
Hipótesis del átomo de Dalton
Dalton argumentó que los átomos podrían explicar la ley de las múltiples proporciones. Si se suponía que los elementos estaban hechos del mismo tipo de partículas indivisibles, que son idénticas en masa y todas las propiedades entonces, debido a que estas partículas solo pueden venir en números enteros, diferentes átomos pueden combinarse para formar compuestos también solo en números enteros. Así, en un compuesto puro los átomos de elementos diferentes se combinarían en pequeñas proporciones de números enteros. En consecuencia, un compuesto dado siempre tiene el mismo número relativo y tipos de átomos. Las reacciones químicas implicarían la reorganización de los átomos, pero los átomos conservarían su identidad. Los átomos podrían reordenarse en una reacción química pero no crearse ni destruirse.
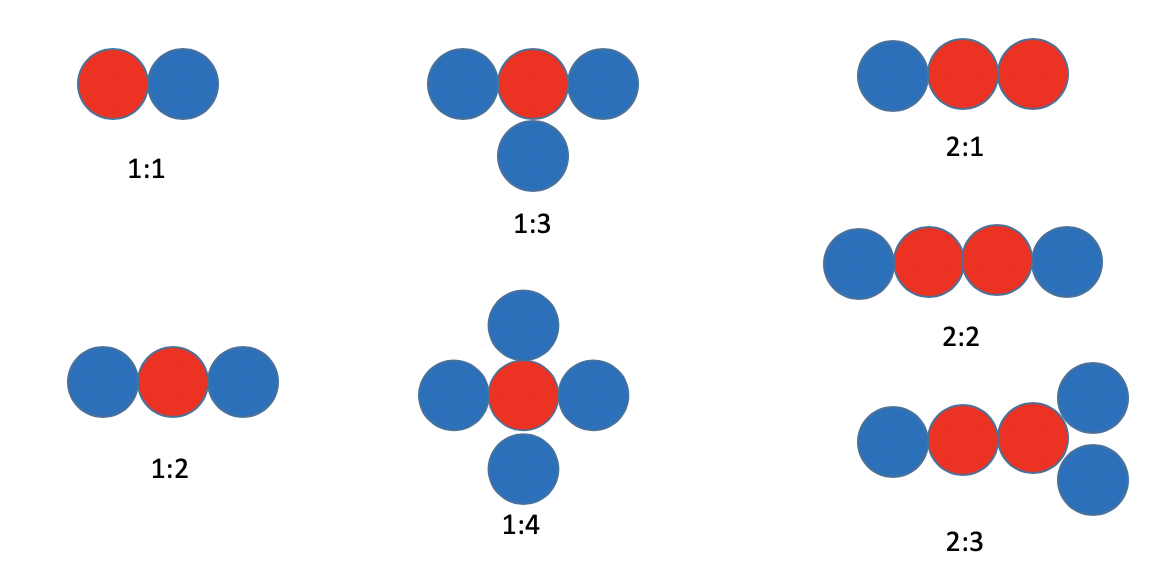
La Figura 1.1.7 es una simple ilustración de cómo los átomos pueden explicar la ley de múltiples proporciones. Las bolas azules y rojas simbolizan diferentes átomos de diferentes elementos. Es posible combinar un átomo rojo con uno, dos, tres o cuatro átomos azules para hacer cuatro compuestos diferentes. Por ejemplo también es posible combinar dos átomos rojos con uno, dos o tres átomos azules. En todos estos compuestos así como en todos los demás pensables, los átomos azul y rojo solo se pueden combinar en números enteros.
Símbolos Atom de Dalton
Dalton también pensó en símbolos para los átomos de los diferentes elementos. Los símbolos son diferentes de los símbolos de elementos que se utilizan hoy en día, pero el concepto es el mismo. Se pueden ver algunos de ellos en la Figura 1.1.8. Por ejemplo, el oxígeno está representado por una bola blanca, mientras que el carbono está simbolizado por una bola negra. También se puede ver que Dalton ya combinó símbolos atómicos de diferentes elementos para ilustrar compuestos. Por ejemplo combinó una bola blanca con una bola negra para indicar monóxido de carbono, mientras combinó dos bolas blancas con una bola negra para indicar dióxido de carbono. En este caso identificó correctamente las proporciones de átomos en los dos compuestos. No obstante, se puede ver que no siempre es así. Por ejemplo, combinó un átomo de hidrógeno (bola blanca con un punto en el medio) con un átomo de oxígeno para indicar la composición del agua. Sin embargo, como sabemos hoy en día, una molécula de agua tiene dos átomos de hidrógeno y un átomo de oxígeno. ¿Por qué ha tenido razón con los compuestos carbono-oxígeno, pero mal con el agua? La respuesta es que en su momento podría determinar las relaciones atómicas solo a partir de la ley de las múltiples proporciones. En su momento solo se conocía un compuesto que estaba hecho de hidrógeno y oxígeno, agua, por lo que asumió la relación atómica más simple de 1:1. Si hubiera conocido el peróxido de hidrógeno, que tiene la composición H 2 O 2, y así la mitad de hidrógeno por oxígeno, probablemente habría asignado correctamente la relación correcta de hidrógeno a oxígeno al agua. En el caso de los óxidos de carbono, asignó las composiciones correctamente porque en ese momento se conocían tanto el monóxido de carbono como el dióxido de carbono.

https://commons.wikimedia.org/wiki/F...an_symbols.png)
Partículas Subatómicas
La teoría atómica de Dalton afirmaba que diferentes elementos estaban hechos de diferentes átomos, pero no explicaba qué hacía que los átomos fueran diferentes. La respuesta es que los átomos están compuestos por partículas subatómicas, protones, neutrones y electrones, y el número de protones y electrones en un átomo define el elemento que representa. Entonces, después de todo, los átomos no son tan indivisibles. Sin embargo, un átomo aún puede verse como la partícula más pequeña que representa todas las propiedades de un elemento. Si un átomo se divide aún más en partículas subatómicas entonces estas propiedades se están perdiendo. Para entender más a fondo los átomos, por lo tanto, debemos entender las partículas subatómicas de las que están hechas. La primera partícula subatómica que se descubrió fue el electrón. Se encontró a través de la investigación de los llamados rayos catódicos que eran un fenómeno misterioso en su momento. Los rayos catódicos ocurren cuando se aplica un alto voltaje de aproximadamente 10-20 kV a un tubo evacuado (0.0001 mm Hg). Se puede ver un tubo de este tipo con un rayo catódico atravesando en la Figura 1.1.9. La gran pregunta era: ¿Qué causa estos rayos?

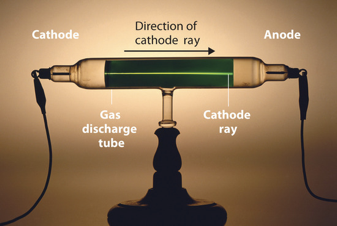
y su aparato experimental (Atribución: Chemlibetexts https://chem.libretexts.org/@api/dek...338&height=228, creativecommons.org/licencias/ by-nc-sa /3.0/nosotros/).
La respuesta fue encontrada por John Joseph Thomson. Aplicó campos eléctricos y magnéticos a estos rayos y los encontró desviados. Cuando se aplicó un campo eléctrico, el haz se desvió hacia el polo positivo. Cuando se aplicó un campo eléctrico y magnético igualmente fuertes, y el campo magnético era perpendicular al campo eléctrico, entonces estos campos se cancelaron y los rayos ya no se desviaron. Thomson concluyó que estos rayos deben consistir en partículas cargadas negativamente emitidas por el electrodo cargado negativamente porque fueron atraídas por el polo positivo del campo eléctrico: Electrones. Conociendo las fuerzas asociadas a los campos eléctrico y magnético, pudo calcular una relación masa/carga de los electrones que es de 5.6857 x 10E-9 g/C.Después de Thomson, Robert Millikan realizó otro experimento, el llamado experimento de gotas de petróleo, que permitió determinar la carga y la masa de el electrón. La carga de un electrón es de -1.6 x 10E-19 C, y su masa es de 9.1 x 10E-28 g.
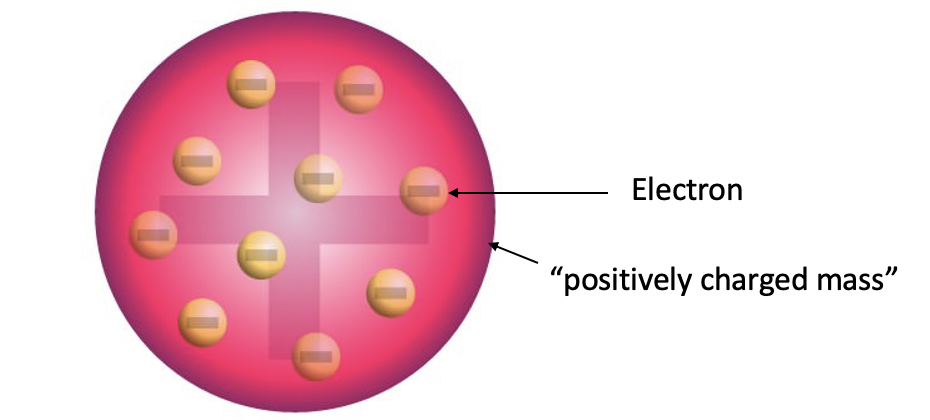
Modelo atómico de pudín de ciruela de Thomson
El descubrimiento del electrón llevó a Thomson al desarrollo de un primer modelo atómico que incluiría una partícula subatómica. Se denomina modelo de pudín de ciruela (Fig. 1.1.10). En el modelo de átomos de Thomson los electrones están incrustados ya que pequeñas partículas en una masa cargada positivamente como las pasas están incrustadas en una torta. Este modelo de átomos aún está lejos del modelo atómico que hoy aceptamos, pero representó un importante paso adelante, porque introdujo por primera vez la idea de que los átomos no son indivisibles, sino que contienen partículas subatómicas.
Modelo Atom de Rutherford
Ernest Rutherford (Fig. 1.1.11) quiso probar el modelo de átomo de pudín de ciruela de Thomson por experimento. Para ello, colocó una película fotográfica alrededor de una lámina de oro (Figura 1.1.12). A continuación bombardeó la lámina de oro con radiación alfa. La radiación alfa es una forma de radiactividad y consiste en núcleos de helio, también llamados partículas alfa. Se sabía en este momento que las partículas alfa estaban cargadas positivamente y tenían una gran masa en comparación con un electrón. La hipótesis de Rutherford era que si el modelo atómico de Thomson era cierto, entonces las partículas alfa deberían ir todas directamente a través de la lámina de oro como una bala pasando por un pudín de ciruela. Por lo tanto, un ennegrecimiento de la película fotográfica, que sirvió como detector de radiación alfa, solo debería ocurrir directamente detrás de la película de oro.

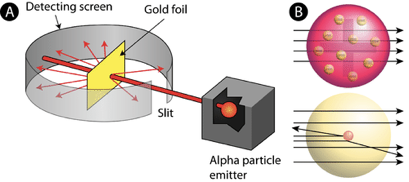
Sin embargo, lo que observó Rutherford fue que si bien la mayoría de las partículas alfa pasaban directamente por la lámina de oro, algunas de ellas fueron desviadas, y algunas de ellas incluso se reflejaron. Rutherford concluyó que el modelo de pudín de ciruela de Thomson debe estar equivocado. Un disparo de bala a un pudín de ciruela simplemente nunca se reflejaría en el pudín de ciruela y volvería hacia ti.
Sugirió que el átomo estaría hecho de un núcleo cargado positivamente donde se concentraría casi toda la masa del átomo. En caso de colisión entre la partícula alfa y ese núcleo, la partícula alfa se reflejaría. En caso de que una partícula alfa pase por el núcleo cercano, la partícula alfa sería desviada. En el caso de que una partícula alfa pase por el núcleo en mayor distancia, la partícula alfa pasaría el átomo prácticamente no desviada. La observación de que la mayoría de las partículas alfa no fueron desviadas llevó a Rutherford a la conclusión de que el átomo global debe ser mucho mayor que el núcleo, de hecho, los datos le permitieron calcular que el radio del átomo sería aproximadamente 10,000 veces mayor que el radio del núcleo. Esto implica que los átomos serían en su mayoría espacio vacío. Para explicar el espacio vacío, Rutherford asumió que los electrones se moverían en órbitas alrededor del núcleo como planetas alrededor del sol. Esto se llamaría el modelo planetario del átomo (Fig. 1.1.13).
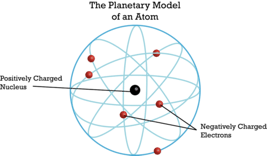
Modelo Atom de Bohr
El modelo atómico de Rutherford fue otro gran paso adelante en el desarrollo de la teoría atómica, sin embargo hubo problemas inherentes con ella ya que violaba principios fundamentales de la física. Un electrón en una órbita es una partícula autoacelerada cargada eléctricamente, y de acuerdo con las leyes de la física tales partículas deben emitir radiación electromagnética. Sin embargo, en circunstancias normales los átomos no emiten radiación electromagnética. En segundo lugar, aunque el electrón emitiera radiación electromagnética, entonces esto significaría que el electrón perdería energía porque la radiación electromagnética es una forma de energía. Sin embargo, un electrón que pierde constantemente energía lo haría inestable en su órbita alrededor del núcleo, y debería espiral hacia abajo más cerca del núcleo hasta que el átomo finalmente se derrumbara. Sin embargo, no se observa experimentalmente que los átomos colapsan, son especies bastante estables. Estas dificultades del modelo atómico de Rutherford significaron que no podía ser la respuesta final a la estructura atómica. Niels Bohr (Fig. 1.1.14) era consciente de los problemas del modelo de Rutherford, y dos nuevos desarrollos en la física, a saber, el concepto de la cuantificación de la energía y los espectros atómicos le ayudaron a desarrollar un modelo atómico mejorado, conocido como modelo Bohr. Para entender este modelo, veamos primero la cuantificación de la energía y los espectros atómicos.

Radiación de cuerpo negro
La cuantificación de la energía se descubrió en el contexto del fenómeno físico llamado “radiación de cuerpo negro”. La radiación de cuerpo negro es la radiación electromagnética que cualquier objeto envía debido a su temperatura (Fig. 1.1.15).

Su distribución de longitudes de onda sigue curvas que dependen de la temperatura y se muestran en la Figura 1.1.16. Se puede ver que por cada temperatura la intensidad primero aumenta al aumentar la longitud de onda, luego pasa por un máximo, y finalmente vuelve a disminuir. También se puede ver que la intensidad general de la radiación de cuerpo negro aumenta con la temperatura y que el máximo de la curva se desplaza a longitudes de onda más pequeñas al aumentar la temperatura. Los objetos a temperatura ambiente no emiten mucha radiación de cuerpo negro y las longitudes de onda son mucho más largas de lo visible para el ojo humano. Sin embargo, cuando un objeto se calienta lo suficientemente alto, la intensidad aumenta y la longitud de onda disminuye, y el objeto comienza a brillar. Por ejemplo, la lava (Figura 1.1.15) tiene una temperatura lo suficientemente alta como para que su radiación de cuerpo negro sea visible para el ojo humano. Al aumentar la temperatura, los objetos primero brillan en rojo, luego naranja, luego amarillo y eventualmente blanco. Esto se debe a que el rojo es el color asociado con la mayor longitud de onda, y a medida que aumenta la temperatura otros colores se mezclan en rojo, hasta que el objeto brilla en blanco. A temperaturas extremadamente altas, la radiación de cuerpo negro también tiene una intensidad significativa en la región UV. Tales temperaturas ocurren en los procesos de soldadura, por ejemplo, y por esta razón los soldadores necesitan usar vidrios que bloqueen la radiación UV. La longitud de onda y la intensidad de la radiación de cuerpo negro se pueden medir fácilmente, pero a principios del siglo XX no hubo una buena explicación para su comportamiento. La teoría clásica predijo que la intensidad aumentaría continuamente con la disminución de la longitud de onda a cualquier temperatura que no estuviera de acuerdo con la observación experimental.

Para llevar el experimento y la teoría de acuerdo, Max Planck hizo la suposición radical de que se cuantificó la energía asociada a la radiación de una longitud de onda dada o una frecuencia dada. Sería un entero múltiplo n de esa frecuencia\(\nu\), multiplicado por la constante de proporcionalidad h, conocida hoy como la constante de Planck.
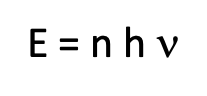
Ecuación 1.1.1 La ecuación de Planck-Einstein.
Utilizando esta suposición, pudo derivar la ecuación de Planck (Ecuación 1.1.2) que describe correctamente la intensidad y distribución de la longitud de onda de la radiación de cuerpo negro para cualquier temperatura. La correcta descripción de la radiación de cuerpo negro apoyó fuertemente la suposición de Planck de que la energía estaba cuantificada, pero no la probó ni la explicó. La prueba y la explicación se encontraron sólo más tarde. Inicialmente Planck lo asumió simplemente para ajustarse a los datos.
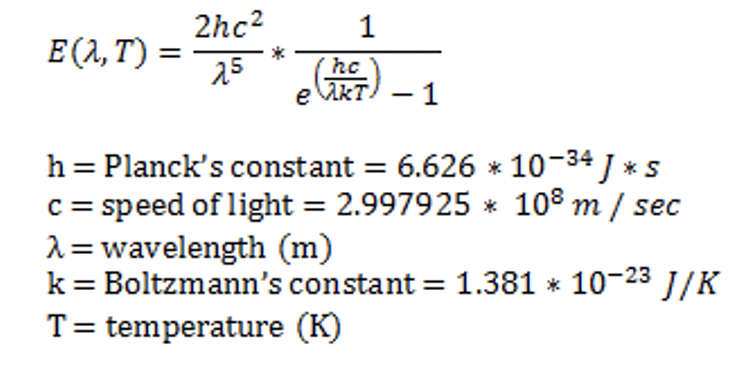
Ecuación 1.1.2 Ecuación de Planck
Modelo Atom de Bohr
El segundo desarrollo que contribuyó al modelo atómico de Bohr fue el espectro de absorción y emisión de átomos. Se observó experimentalmente que bajo ciertas circunstancias los átomos enviarían o absorberían radiación electromagnética de longitudes de onda discretas que eran características de un átomo. Por ejemplo, los átomos de H absorberían o emitirían a cuatro longitudes de onda discretas en la región visible del espectro electromagnético (Fig. 1.1.17).

Esto se conoce como la serie Balmer que lleva el nombre de su descubridor Johann Balmer. Friedrich Paschen y Chester Lyman más tarde encontraron que H también absorbe y emite a longitudes de onda discretas en la región IR y UV respectivamente. Estas longitudes de onda se conocen como las series Paschen y Lyman, respectivamente (Fig. 1.1.18).


Para los espectros de absorción y emisión de H se puede encontrar una relación matemática simple entre las energías asociadas a las longitudes de onda. La energía es proporcional a una constante, hoy conocida como la constante de Rydberg, multiplicada por uno sobre un número entero cuadrado menos uno sobre otro número entero cuadrado, por lo que el segundo número entero sería mayor que el primero (Ec. 1.1.3). La observación de números enteros mostró que también se cuantifican la energía y las longitudes de onda de los espectros de absorción atómica y emisión. La pregunta fue qué significó la cuantificación de los espectros de absorción para la estructura atómica.
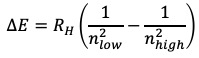
Ecuación 1.1.3 Fórmula de Rydberg para la emisión de luz con energías particulares.
Bohr respondió a la pregunta de la siguiente manera. Argumentó, que como en el modelo de Rutherford los electrones se moverían en órbitas alrededor del núcleo. Un equilibrio de fuerzas centrífugas opuestas y atracciones de Coulomb mantendría al electrón estable en la órbita. Sin embargo, debido a que se cuantifica la energía, también se cuantificaría el momento angular del electrón, y así, solo se permitirían radios discretos. La órbita más interna tendría el número cuántico n=1, la siguiente órbita superior el número cuántico n=2, y así sucesivamente (Fig. 1.1.19).
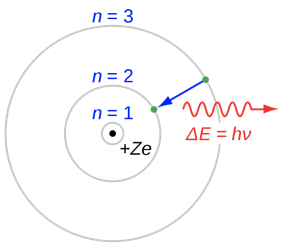
La cuantificación de las energías de los electrones y los radios sería la explicación de por qué los electrones, a pesar de la autoaceleración, no emiten continuamente radiación electromagnética. La radiación electromagnética solo se emite cuando un electrón salta de una órbita externa de mayor energía a una órbita interna de menor energía. Esta radiación debe tener una longitud de onda discreta porque la diferencia de energía entre dos órbitas es discreta. Viceversa, un átomo puede adsorber radiación electromagnética de longitud de onda específica y energía que es adecuada para hacer que el electrón salte de una órbita interna a una externa. En suma, la cuantificación de la energía y los radios explicaría la cuantificación de los espectros de absorción y emisión. La pregunta es: ¿Se pueden calcular los radios y cuáles son las energías asociadas de los electrones en las órbitas?
Definición: Postulados de Bohr (1913)
1. Un electrón en un átomo se mueve en órbita circular alrededor del núcleo bajo la influencia de la atracción Coulomb entre el electrón y el núcleo, obedeciendo las leyes de la mecánica clásica.
2. En lugar de la infinidad de órbitas que serían posibles en la mecánica clásica, solo es posible que un electrón se mueva en una órbita para la cual su momento angular orbital L es un múltiplo integral de h/2π.
3. A pesar de que se acelera constantemente, un electrón que se mueve en una órbita tan permitida no irradia energía electromagnética. Así, su energía total E permanece constante.
4. La radiación electromagnética se emite si un electrón, inicialmente moviéndose en una órbita de energía total, cambia discontinuamente su movimiento para que se mueva en otra órbita de energía total. La frecuencia de la radiación emitida es igual a la cantidad dividida por h.
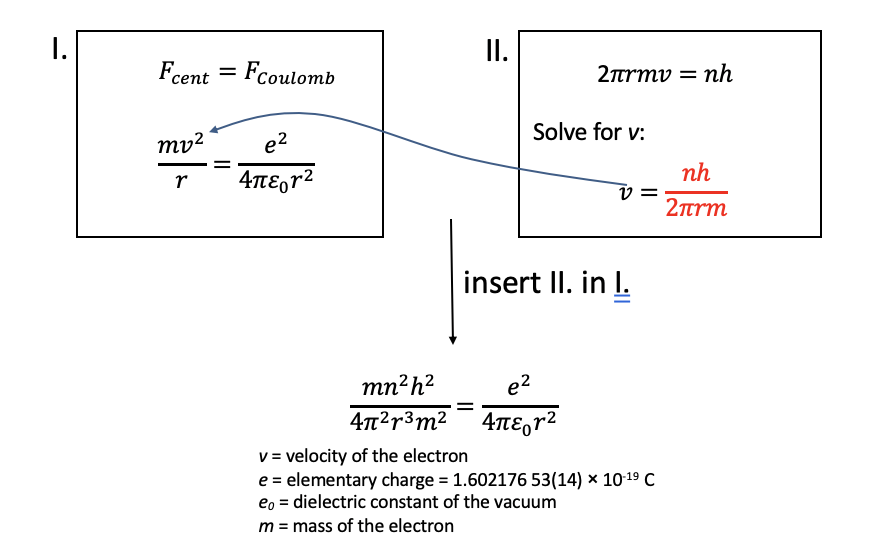
Para calcular los radios y energías del electrón en el átomo H, Bohr hizo dos suposiciones: En primer lugar, la fuerza centrífuga asociada con el electrón que se mueve en la órbita se asumiría igual a la fuerza Coulomb entre el electrón y el protón para que el electrón fuera estable en la órbita. En segundo lugar, se cuantificaría el momento angular del electrón y se cuantificaría un múltiplo entero de la constante de Planck h. el factor 2\(\pi\) se debe a que E = h/2π x frecuencia angular. La frecuencia angular (también llamada velocidad angular) es el desplazamiento angular (en grados o rad) por unidad de tiempo. La frecuencia angular es la frecuencia x 2π. Podemos reorganizar esta ecuación resolviéndola para v y luego insertar la ecuación en la ecuación I dando el resultado como se muestra en la Fig. 1.1.20.
Entonces podemos multiplicar esta ecuación por 4πε 0 r 2, dividir por e 2, y multiplicarla por r Esto nos da el término r =( n 2 h 2 ε 0)/(πme 2). Analizando el término nos muestra que r es sólo una función del número cuántico n, específicamente el radio es proporcional a n 2 (Fig. 1.1.21). Todos los demás términos son constantes, es decir, la constante de Planck h, la constante dieléctrica del vacío, π, la masa del electrón y la carga elemental. Al insertar los números cuánticos en la ecuación podemos calcular los valores reales para los radios. Por ejemplo, cuando insertamos 1 para el número cuántico n, obtenemos el radio para la órbita más interna del electrón en el átomo H. Es de 5.29 x 10 -11 m. Si insertamos 2 para n, obtendríamos el segundo radio, si insertamos 3, obtendríamos el tercer radio y así sucesivamente.
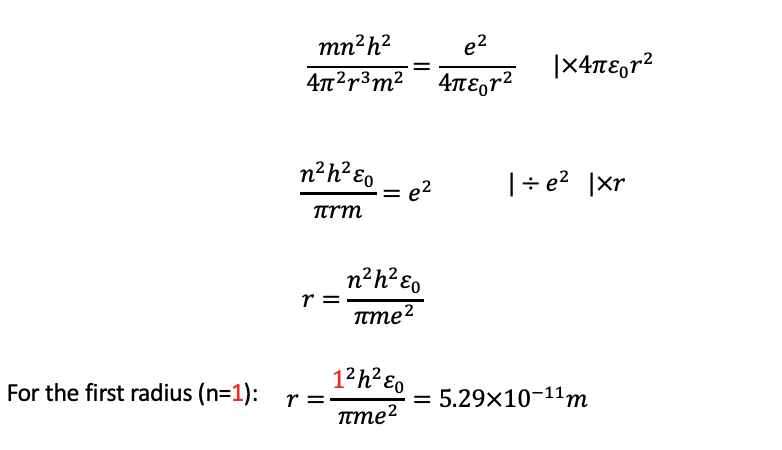
Ahora calculemos las energías del electrón sobre estos radios. Generalmente, la energía global del electrón es la suma de las energías cinéticas y potenciales. La energía cinética de un objeto en movimiento viene dada por E kin =1⁄2 mv 2. Sabemos que m debe ser la masa del electrón, pero ¿cuál es la velocidad del electrón? Podemos derivarlo de la ecuación I que anteriormente usamos resolviéndola para v 2 (Fig. 1.1.20). Entonces podemos insertar el término para v 2 en la ecuación E kin =1⁄2 mv 2, que da E kin =e 2/(8πε 0 r), Fig. 1.1.23.
Ahora consideremos la energía potencial. La energía potencial es la energía de Coulomb entre el protón y el electrón en el átomo H. La fórmula para la energía de Coulomb de dos partículas que tienen dos cargas elementales opuestas es E pot =-e 2/(4πε 0 r). Obsérvese que esta energía tiene un signo algebraico negativo porque las fuerzas entre el protón y el electrón son atractivas (Fig. 1.1.23).
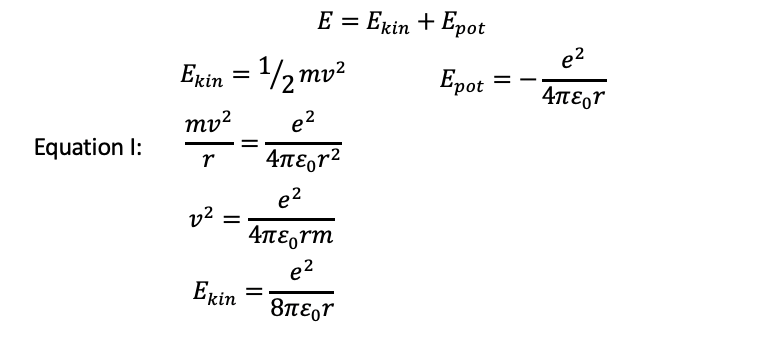
Ahora podemos sumar la energía cinética y potencial para dar la energía global que es E = E kin +E pot = [e 2/(8πε 0 r)] - [e 2/(4πε 0 r)] = e 2/(πε 0 r) (1/8-1/4) = -e 2/(8πε 0 r). Entonces podemos usar el término que calculamos previamente para r (Fig. 1.1.21) e insertarlo en el término para la energía global. Como resultado la energía global se convierte en E=- (e 4 m)/(8ε 0 2 n 2 h 2), Fig. 1.1.24. Como podemos ver, las energías para los electrones en las diferentes órbitas también son solo una función del número cuántico n, específicamente, son una función de 1/n 2. Obsérvese también que la energía general es negativa. Esto se debe a que la energía es una energía vinculante. Debido al signo algebraico negativo, un número cuántico mayor n significa un mayor, porque menos energía negativa. A números cuánticos muy altos n el valor de E se aproximaría a cero, lo que significa que la energía de unión para el electrón se acercaría a cero. Cuanto más alta es la órbita del electrón, más energía tiene y menos fuerza está unida al átomo.
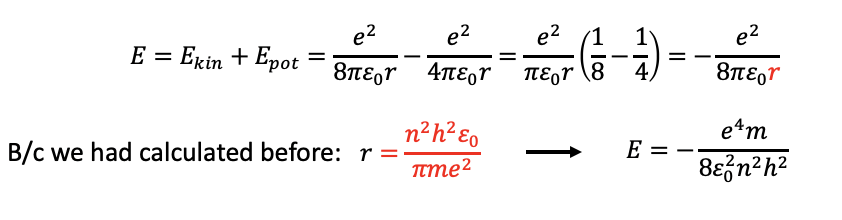
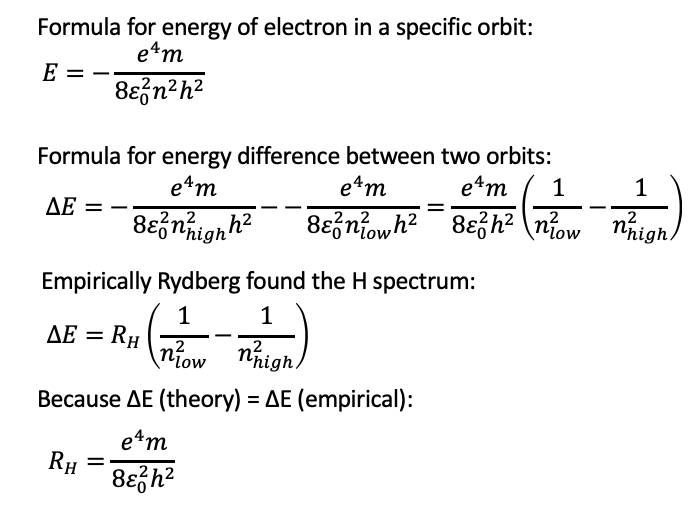
Finalmente calculemos las diferencias de energía entre electrones en diferentes órbitas. La resta de los términos para las energías de dos electrones en dos órbitas diferentes da ∆E= (e 4 m)/(8ε 0 2 h 2) (1/ (n bajo 2) - 1/ (n alto 2)), Fig. 1.1.25. La ΔE calculada y encontrada empíricamente coinciden excelentemente, la constante empíricamente encontrada de Rydberg coincide con la constante teóricamente derivada (e 4 m)/(8ε 0 2 h 2). Así, el experimento y la teoría están de acuerdo. La teoría de Bohr es capaz de explicar muy bien los espectros H, y puede predecir tanto radios de órbitas de electrones como de energías. El modelo de Bohr introdujo por primera vez la cuantificación de estados de electrones en átomos, y en este sentido en fue un gran paso adelante. No obstante, todavía había problemas con la teoría de Bohr. Sólo pudo explicar bien los espectros H, pero no pudo explicar los espectros de todos los demás átomos. En segundo lugar, los postulados de Bohr parecían ad hoc y carecían de explicación. No hubo una buena explicación por qué un electrón en una órbita cuantificada no emitiría radiación electromagnética de manera continua. Así, el modelo de Bohr aún no podría ser la respuesta final a la teoría atómica. De hecho, le falta tomar en cuenta una propiedad importante del electrón: El dualismo onda-partícula del electrón.
Definición: Problemas con la teoría de Bohr
1. Puede explicar solo el espectro H y no logra explicar todos los espectros de todos los demás átomos.
2. Los postulados de Bohr son ad hoc. Les falta una explicación.


