3.2: El método de combinación lineal adaptada a simetría de orbitales atómicos
- Page ID
- 70182
Reglas para la Combinación Lineal Adaptada a Simmetría de Orbitales Atómicos (SALC)
La construcción de orbitales moleculares utilizando la teoría de grupos sigue un método llamado “combinación lineal adaptada a simetría de orbitales atómicos”. Este método sigue los siguientes pasos.
- En primer lugar, determinamos el grupo puntual para la molécula.
- En segundo lugar, determinamos los ejes del sistema de coordenadas de manera útil.
- En tercer lugar, determinamos los orbitales atómicos del ligando que se pueden combinar para formar los llamados orbitales del grupo ligando (LGO). Estos suelen ser orbitales del mismo tipo que una operación de simetría puede interconvertir. El número de LGO es siempre el número de los orbitales atómicos del ligando.
- En el siguiente paso, determinamos los tipos de simetría de los orbitales del grupo ligando, y hablaremos en un momento cómo funciona esto.
- Finalmente, determinamos el tipo de simetría de los orbitales atómicos de nuestro átomo central, y combinamos orbitales de grupos de ligandos y orbitales de átomos centrales del mismo tipo de simetría. Si tienen el mismo tipo de simetría su simetría es “correcta”. Los MO resultantes de esta combinación tendrán el mismo tipo de simetría que los orbitales a partir de los cuales se han hecho. También el número de MO debe ser el mismo que el número de OGs y los AO de átomos centrales.
Ahora puedes construir un diagrama de orbitales moleculares usando los MO que has construido usando SALC. Después de haber construido el diagrama MO, siempre verifique que el número de MO sea igual al número de AO. Si no, debes haber cometido un error y tienes que regresar y encontrar el error.
Ejemplo - H 2 O
Llevemos a cabo estos pasos usando nuestra molécula de agua como ejemplo. Como determinamos anteriormente, el grupo puntual de la molécula de agua es C 2v. Una manera sensata de definir el sistema de coordenadas es tener el punto del eje x a la derecha, el punto del eje z a la parte superior y el punto del eje y fuera del plano del papel (Fig. 3.2.1). La molécula de agua estaría en el plano xz apuntando hacia la dirección z. El siguiente paso es definir los átomos del ligando y los orbitales del ligando. Es fácil ver que los átomos de H serían átomos de ligando, y el átomo O sería el átomo central. Los orbitales atómicos del ligando que se combinarían para formar orbitales del grupo ligando serían los orbitales 1s de los átomos de hidrógeno. Esperaríamos dos orbitales de grupos de ligandos porque combinamos dos orbitales atómicos.
Determinación de los tipos de simetría LGO
A continuación, necesitamos determinar los tipos de simetría de los orbitales del grupo ligando (LGO). Esto lo podemos hacer en dos pasos.
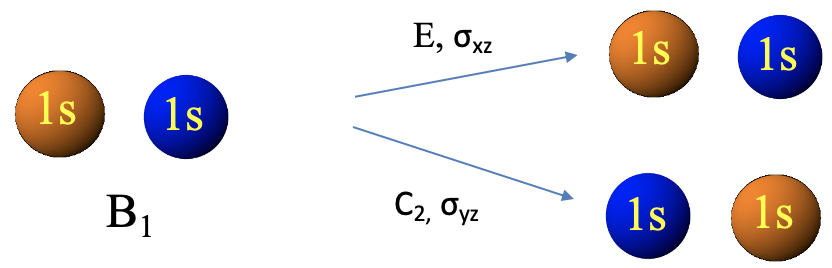
En el primer paso, determinamos la representación reducible para los orbitales del grupo ligando mediante un método llamado “método de intercambio orbital”, y en el segundo paso determinamos las representaciones irreducibles para los orbitales del grupo ligando a partir de la representación reducible. Las representaciones irreducibles nos darán el tipo de simetría de los orbitales del grupo ligando. Hagamos el primer paso, y llevemos a cabo el método de intercambio de orbitales para determinar la representación reducible. Para ello, denotemos primero los dos orbitales 1s ψ1 y ψ2, respectivamente (Fig. 3.2.2).
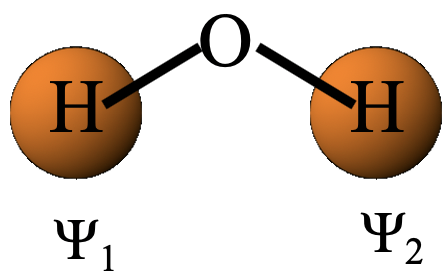
Entonces, decidimos si ψ1 y ψ2 se intercambian cuando se lleva a cabo una operación de simetría particular. Si es así, cada uno obtiene un carácter cero, si no, obtienen un carácter +1 cada uno. La suma de estos caracteres da el carácter en la representación reducible para la operación de simetría particular. Después de haber aplicado el intercambio orbital para todas las operaciones de simetría, conocemos todos los caracteres de la representación reducible. La operación de simetría E no intercambia los orbitales, de ahí que el carácter en la representación reducible sea 1+1=2 (Fig. 3.2.3). La operación de simetría C 2 sí intercambia los orbitales, de ahí que el carácter en la representación reducible sea 0+0=0. El plano espejo xz deja los orbitales en sus posiciones, por lo tanto el carácter en la representación reducible es 1+1=2. el plano espejo yz intercambia los orbitales, de ahí que el carácter sea 0+0=0 (Fig. 2.3.2).

Te puedes preguntar: ¿Por qué funciona el método de intercambio orbital? ¿Qué principio más profundo hay detrás de esto? La respuesta es. El método de intercambio orbital es un atajo para obtener la suma de los caracteres en la traza de una matriz de transformación que convierte las dos funciones de onda. Antes de que se lleve a cabo la operación de simetría las dos funciones de onda pueden ser descritas por una matriz de la forma a continuación (Fig. 3.2.4).
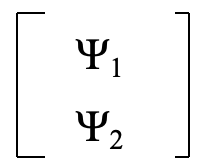
Cuando se intercambian los orbitales, se intercambian ψ1 y ψ2 en la matriz, y la matriz toma la forma siguiente (Fig. 3.2.5).
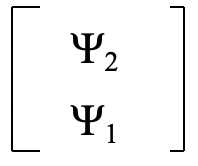
La matriz de transformación cuando se multiplica por la matriz en la Figura 3.2.4 da la matriz en la Figura 3.2.5 que es la matriz de transformación para la (s) operación (es). Esta matriz tiene la forma siguiente (Fig. 3.2.6),
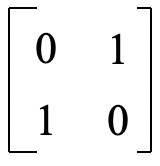
y podríamos usar las reglas de multiplicación para mostrar que esta matriz es la matriz correcta. Esto significa que la matriz de transformación para C2 y σ yz es la matriz que se muestra en la Figura 3.2.6.
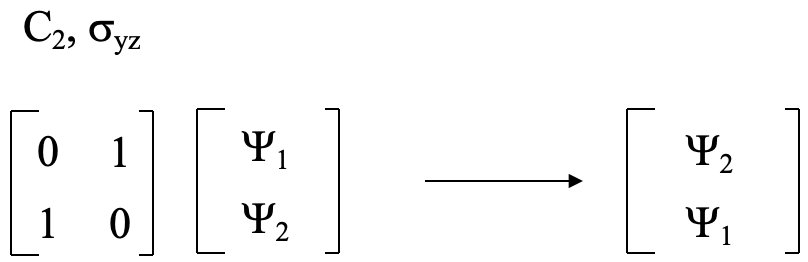
Para las operaciones E y σ xz los orbitales no se intercambian, y la matriz final es la misma que la matriz inicial en la Figura 3.2.4. Así, la matriz de transformación tiene la forma siguiente (Fig. 3.2.8). Para la matriz en la Figura 3.2.6 la suma de los caracteres en la traza de la matriz es cero. Para la matriz de abajo
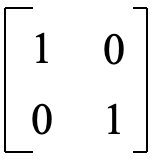
esta suma es 2. Estos son los caracteres de la representación reducible que previamente determinamos utilizando el método de intercambio orbital. Usando las reglas de multiplicación podemos mostrar que la matriz de la Fig. 3.2.8 es la matriz de transformación correcta (Fig. 3.2.9)
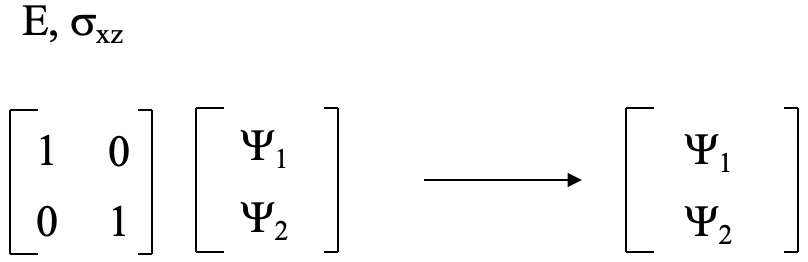
En el siguiente paso necesitamos determinar las representaciones irreducibles a partir de la representación reducible. Recuerde, una representación reducible es la suma de dos o más representaciones irreducibles. Así, una representación reducible contiene la información sobre las representaciones irreducibles por las que está compuesta, y necesitamos encontrar una herramienta para extraer esa información.
La herramienta para hacer esto es una fórmula de la teoría de grupos llamada fórmula de reducción. Se puede ver la fórmula de reducción a continuación (Fig. 3.2.10).

Dice que el número de representaciones irreducibles de un tipo de simetría dado es uno sobre el orden del grupo de puntos multiplicado por la suma de los productos del número de operaciones en una clase específica en la tabla de caracteres del grupo de puntos multiplicada por el carácter de la representación reducible para una simetría dada operación multiplicada por el carácter de la representación irreducible para una operación de simetría dada. La “suma de productos” significa la suma de los productos para todas las clases de operaciones de simetría en el grupo de puntos. El número de operaciones en una clase y el carácter de la representación irreducible se pueden leer de la tabla de caracteres para el grupo de puntos. Aquí vemos por primera vez la utilidad de las tablas de caracteres para la teoría orbital molecular. Los caracteres de la representación reducible pueden leerse a partir de la representación reducible previamente determinada por el método de intercambio orbital.
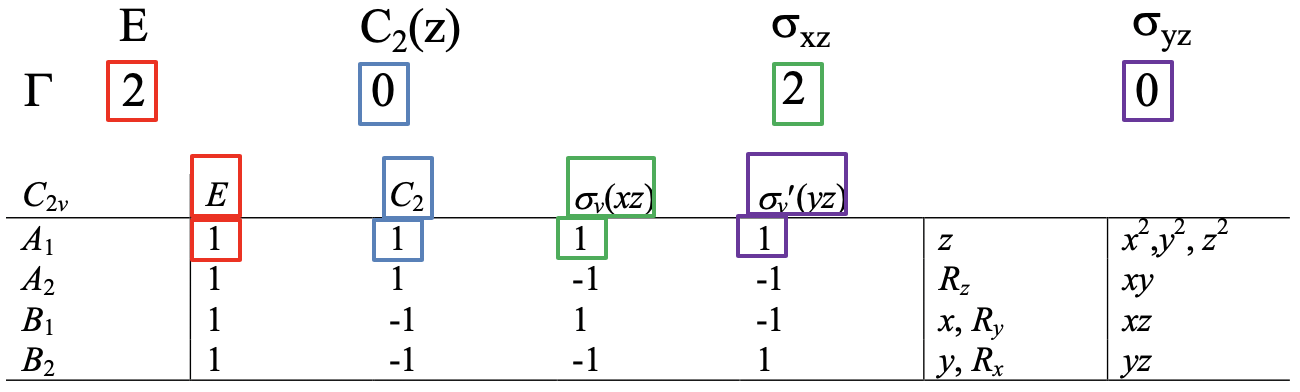
Para mayor claridad, utilicemos la fórmula de reducción para la determinación de las representaciones irreducibles de los orbitales del grupo ligando para el ejemplo de la molécula de agua. Nuestra tarea es encontrar el número de representaciones irreducibles de cada tipo de simetría posible en el grupo de puntos. En el grupo puntual C 2v, estos son los tipos de simetría A 1, A 2, B 1 y B 2. Empecemos con A 1. El número de representaciones irreducibles del tipo A1 es: A 1 = 1/4 (1x2x1 + 1x0x1 + 1x2x1 + 1x0x1) = 1 (Fig. 3.2.12).
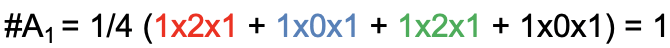
El resultado significa que uno de los dos orbitales del grupo ligando tiene la simetría tipo A1. El factor ¼ se debe a que el orden del grupo de puntos es 4. Podemos determinar el orden simplemente contando el número de operaciones de simetría en la tabla de caracteres para C 2v. El primer producto 1x2x1 (rojo) es el producto para la identidad E. El número de operaciones en la columna para E es 1, nunca hay otra operación conjugada en la clase para la identidad. Tenga en cuenta que el número “1” no está explícitamente deletreado. El número de operaciones dentro de una clase de una tabla de caracteres solo se explica cuando el número es mayor que 1. El carácter en la representación reducible para E es 2, y el carácter para la representación irreducible para el tipo de simetría A1 debajo de E también es 1. El segundo producto es 1x0x1 (azul) porque el número de operaciones en la clase de para C 2 es 1, el carácter en la representación reducible para C 2 es 0, y el carácter de la representación irreducible debajo de C 2 es 1. El tercer producto para la operación σ xz es 1x2x1 (verde) porque el carácter para la clase σ xz es 1, el carácter en la representación reducible para σ xz es 2 y el carácter de la representación irreducible bajo σ xz es 1. Por último, el producto para la operación σ yz es 1x0x1 (negro) porque el número de operaciones en la clase para σ yz es 1, el carácter en la representación reducible bajo σ yz es 0, y el carácter de la representación irreducible bajo σ yz es 1 ( púrpura).
Mediante el mismo procedimiento, también podemos determinar el número de orbitales de grupos de ligandos que tienen los tipos de simetría, A 2, B 1 y B2.
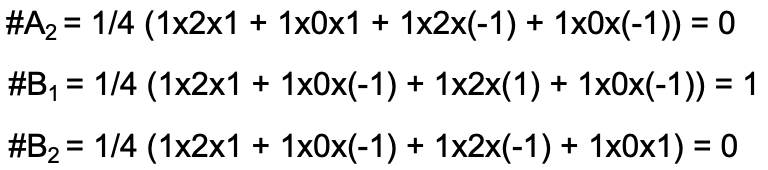
El resultado (Fig. 3.2.13) es que el segundo grupo de ligandos orbital tiene la simetría tipo B 1, y el número de orbitales del grupo ligando con la simetría tipo A 2 y B 2 es 0. Hemos determinado que la representación reducible es la suma de las dos representaciones irreducibles A 1 y B 2 (Fig. 3.2.14).

El resultado significa que un grupo ligando orbital tiene simetría A 1, el otro simetría B 1. El que tiene simetría A1 refleja la combinación de dos orbitales 1s con el mismo signo algebraico, el que tiene simetría B 1 refleja la combinación de dos orbitales 1s con signo algebraico opuesto.
Nos encontramos con las OGL ya previamente por inspección. Aquí vemos que la teoría de grupos puede derivarlos formalmente. También podemos verificar que las dos LGO tienen simetría A1 y B1, respectivamente, realizando las operaciones de simetría y ver qué hacen con la LGO respectiva. Para el LGO con simetría A1, ninguna operación de simetría cambia el LGO (Fig. 3.2.15). Esto es consistente con el tipo de simetría A1 para el cual todos los caracteres en la representación irreducible son 1.
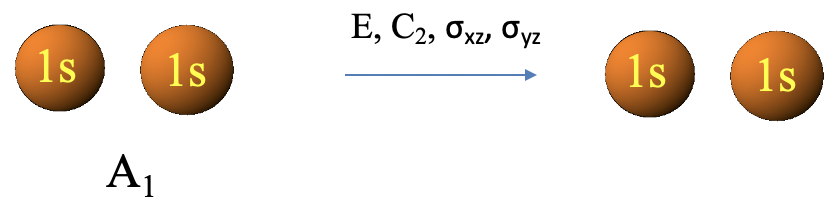
Para el LGO con tipo de simetría B 1 vemos que la operación C 2 y las operaciones σ yz invierten el signo algebraico de la función de onda, mientras que la identidad y las operaciones σ yz no lo hacen (Fig. 3.2.16). Esto es consistente con la representación irreducible del tipo de simetría B 1 que tiene los caracteres +1 para E y σ xz, y -1 para las operaciones C 2 y σ yz.
Determinación del tipo de simetría de los orbitales de átomos centrales
En el siguiente paso tenemos que conocer los tipos de simetría de los orbitales de valencia de átomos centrales. En el caso de la molécula de agua los orbitales de valencia del átomo central son los 2s, y los tres orbitales 2p. Podemos leer fácilmente los tipos de simetría de estos orbitales de la tabla de caracteres del grupo de puntos C 2v (Fig. 3.2.17).
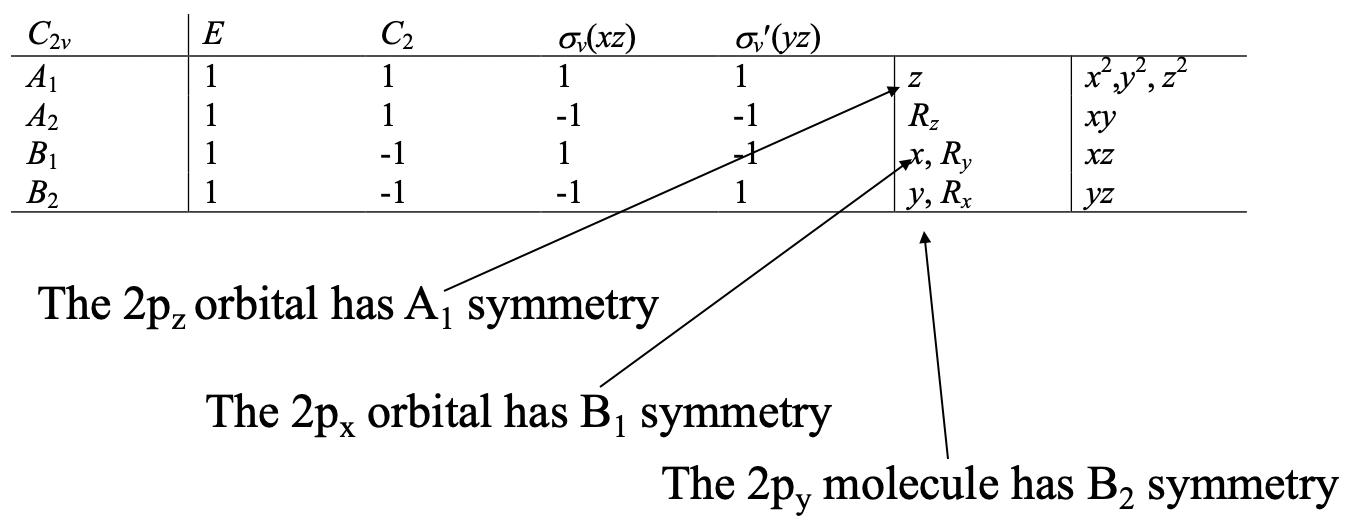
Un orbital es siempre del tipo de simetría totalmente simétrica en el grupo de puntos. Este es el tipo de simetría con todos los caracteres que tienen un valor +1. En el grupo de puntos C 2v esta es la simetría tipo A 1. El tipo de simetría del orbital 2p z es también A 1. Esto se debe a que la letra z está en la fila para el tipo de simetría A1. De igual manera, los orbitales 2p x y 2p y tienen la simetría tipo B 1 y B2 respectivamente porque las letras x e y están en las filas para los tipos de simetría B 1 y B2, respectivamente.
Combinación de AO y LGO para formar MO
Cuando los AO de átomos centrales tienen el mismo tipo de simetría, entonces tienen la simetría “correcta” para combinarse para formar orbitales moleculares. Los orbitales moleculares tendrán el mismo tipo de simetría que los AO y las OGL de los que se han hecho. El número de MO de un tipo de simetría específico debe ser igual a la suma de los OGs y AO que tienen el mismo tipo de simetría. Cuando un orbital no encuentra un orbital compañero del mismo tipo de simetría entonces no se une.
Apliquemos estas ideas al ejemplo de la molécula de agua. Vimos que había dos AO que tenían la simetría tipo A1, a saber, el 2s y el orbital 2p z. También hubo un LGO con simetría A 1. Por lo tanto, podemos combinar estos tres orbitales para formar orbitales moleculares. También deben tener la simetría tipo A 1 (Fig. 3.2.18).

A continuación, pensemos en orbitales de la simetría tipo A 2. Ningún AO y ningún LGO tiene este tipo de simetría. Por lo tanto, tampoco hay MO de este tipo de simetría (Fig. 3.2.19).

Para la simetría tipo B 1 encontramos que hay un AO, es decir, el orbital 2p x y un LGO que tienen este tipo de simetría. Esto significa que estos dos orbitales se pueden combinar para formar dos MO del mismo tipo de simetría (Fig. 3.2.20).

Para la simetría B 2 solo existe el 2p y AO, pero ningún LGO con el que podría combinarse. Así, el orbital 2p y permanece sin unión (Fig. 3.2.21).

Recuerden, obtuvimos el mismo resultado cuando analizamos los orbitales por inspección. Aquí, la teoría de grupos nos da el mismo resultado a través de un formalismo. Esto tiene la ventaja de que se evitan la ambigüedad y los errores. Sin embargo, se debe tener en cuenta lo que significa el resultado teórico grupal, y para ello es útil haber analizado previamente las interacciones de los orbitales 2p con los orbitales 1s mediante inspección.
El diagrama MO de H 2 O
Ahora podemos construir el diagrama orbital molecular de H 2 O. Como siempre dibujamos primero una flecha vertical para el eje de energía (Fig 3.2.22). A continuación indicamos los símbolos de átomo en el lado izquierdo y derecho del diagrama. Por convención, el átomo central está en el lado izquierdo. Después de eso podemos escribir los orbitales atómicos en el diagrama orbital molecular de acuerdo con la energía relativa aproximada, e indicar sus nombres y simetría.
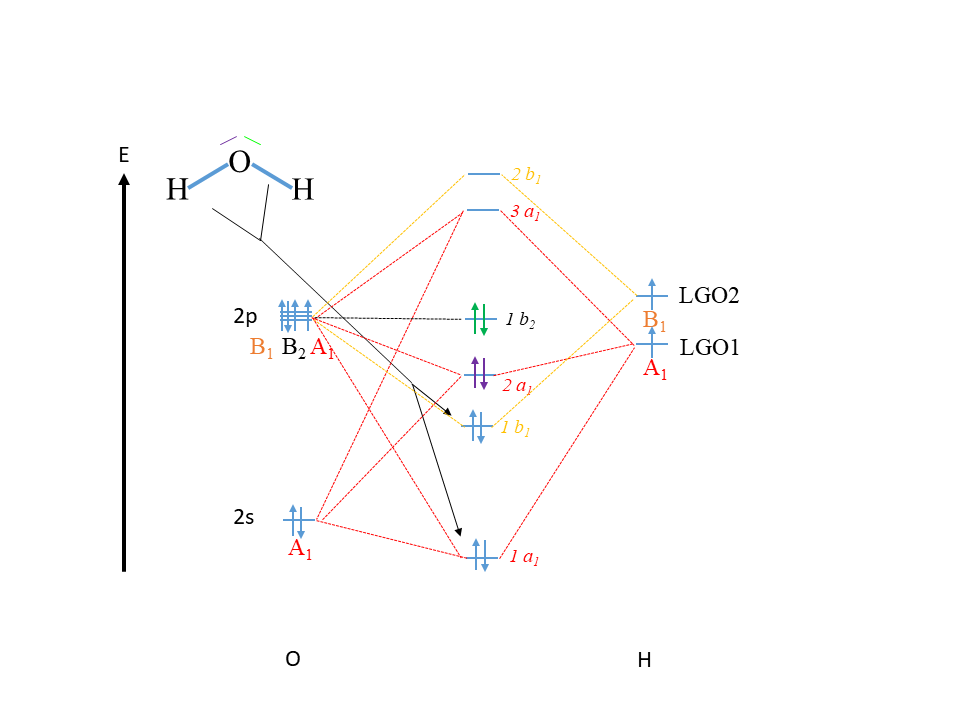
Sabemos que los orbitales 2s de O deben ser más bajos en energía que los orbitales 2p de O, y los escribimos en consecuencia. También sabemos que los orbitales 2p tienen todos la misma energía, y así los escribimos juntos lo más cerca posible. Para los orbitales H escribimos los orbitales del grupo ligando y los indicamos LGO1 y LGO2. Desconocemos la energía exacta de los OGs con relación a los orbitales 2p y 2s de oxígeno, pero esperaríamos que sea similar a los de ellos, de lo contrario no podríamos hacer enlace covalente. También sabemos que los enlaces O-H están polarizados hacia O, por lo que sospecharíamos que los LGO son más similares a los orbitales 2p en energía en comparación con los orbitales 2s. Escribimos el LGO2 algo por encima de LGO1 para indicar que el LGO2 tiene una energía ligeramente mayor porque tiene un nodo. También está bien, aunque escribirlos con la misma energía, ambos métodos son comunes en la literatura. Indicamos que LGO1 tiene la simetría tipo A1 y LGO2 tiene la simetría tipo B 1.
Ahora necesitamos escribir los orbitales moleculares en medio del diagrama. Pasamos sistemáticamente por todos los tipos de simetría a medida que construimos los MO. Por ejemplo, podemos comenzar con la simetría tipo A 1. Debido a que combinamos tres orbitales de este tipo de simetría necesitamos escribir tres MO en el centro del diagrama, e indicar el tipo de simetría. Cuando combinamos tres orbitales se mantiene la siguiente aproximación. Habrá una orbital de unión de baja energía, una orbital antiunión de alta energía y una tercera de energía intermedia que es aproximadamente no enlazante. No sabemos si es exactamente no pegada, ligeramente pegada o ligeramente antiadherencia. Los cálculos cuántico-mecánicos exactos podrían determinar esto así como la energía exacta de la órbita, pero aquí nuestro enfoque está en la construcción cualitativa y la comprensión de los diagramas orbitales moleculares. Por lo tanto, debemos dejar sin respuesta esta pregunta. El orbital de unión debe escribirse por debajo del orbital atómico de menor energía que contribuye al MO, en este caso el orbital 2s de O. El orbital antiunión debe dibujarse a un nivel de energía por encima del orbital de mayor energía que contribuya a ello, en este caso el orbital A 1 tipo 2p. Puede dibujar el MO de tipo 1 aproximadamente sin unión a aproximadamente la mitad de la distancia entre la unión y el MO antiadhesión en el diagrama. El orbital de menor energía obtiene la etiqueta 1a 1, la segunda más baja, la etiqueta 2a 1, y la órbita de mayor energía obtiene la etiqueta 3a 1. Tenga en cuenta que para los MO utilizamos letras minúsculas para indicar el tipo de simetría. Los coeficientes frente al tipo de simetría numeran los orbitales según la energía creciente. En el último paso conectamos todos los AO y LGO de tipo A 1 con los MOs de tipo a 1 por líneas punteadas. Esto se indica con las líneas punteadas rojas en la Fig. 3.2.22.
A continuación, podemos dibujar los MOs de tipo b 1. Esperamos dos MO, porque hay un AO de este tipo de simetría, y un LGO de este tipo de simetría. Se espera que un MO esté pegando y debe tener baja energía, el otro debe ser antiadhesivo y tener alta energía. La energía del MO de unión debe ser menor que la energía del orbital de menor energía que contribuye a ello, en este caso el orbital B 1 tipo 2p. El orbital antienlace debe tener una energía mayor que la energía más alta AO/LGO que contribuya a ello, en este caso el LGO2. El MO de unión obtiene la etiqueta 1b 1 y el antienlace orbital la etiqueta 2b 1. No conocemos exactamente la energía de los MOs de tipo b 1 en relación con los AO de tipo a 1 cuando se dibuja cualitativamente el diagrama MO. Por ejemplo, el orbital anti-unión 2b 1 se dibuja con una energía más alta que el orbital anti-unión 3a 1, pero no lo haríamos con seguridad (solo los cálculos cuántico-mecánicos exactos podrían decir). Sin embargo, sospecharíamos que el orbital de unión 1b 1 tiene una energía mayor que el orbital de unión 1a 1 porque la energía del orbital 2s es significativamente menor que la energía del orbital B 1 tipo 2p. También sospecharíamos que el orbital 1b 1 es menor en energía que el orbital 2a 1 porque sabemos que el 1b 1 está uniendo, mientras que el 2a 1 es aproximadamente no unido. Finalmente, conectamos los AO y los LGO con simetría B 1 con los MOs de simetría b 1 con líneas punteadas, indicadas naranja en la Fig. 3.2.22.
Por último, aún tenemos que decidir qué hacer con el orbital 2p y que tiene la simetría tipo B 2. Este orbital no tiene pareja del mismo tipo de simetría, y por lo tanto permanece exactamente sin unión. Por lo tanto, escribimos el orbital 2p y como orbital tipo b 2 con energía inalterada en medio del diagrama MO, e interconectamos los dos orbitales con una línea punteada horizontal, Fig. 3.2.22.
Ahora llenemos los electrones en los orbitales. El átomo O tiene seis electrones de valencia, dos de ellos están en los orbitales 2s y cuatro de ellos están en los orbitales 2p. Los orbitales 2p se llenan de acuerdo con la regla de Hund. Debido a que cada átomo de H aporta un electrón, los LGO se consideran ambos medio llenos con un electrón cada uno. Ahora podemos llenar los MOs según el aumento de la energía. En general tenemos 6+2=8 electrones para llenar en los MOs. En consecuencia, el 1a 1 se llena primero, luego el 1b 1, luego el 2a 1, y finalmente el 1b 2. El 1b 2 se llama el orbital molecular ocupado más alto, abreviado HOMO. El siguiente orbital superior, el orbital 3a 1 se llama el orbital desocupado más bajo, también llamado LUMO. Los HOMOS y LUMO son importantes para la química de una molécula porque los electrones HOMO son los electrones más reactivos, y el LUMO es el orbital que más fácil de llenar con un electrón proveniente de un correactante.
Ahora nuestro diagrama MO está completo. Es perspicaz comparar el diagrama MO del agua con la estructura de punto Lewis de la molécula de agua para comprender qué información adicional podemos obtener del diagrama MO en comparación con la estructura de puntos de Lewis. En la estructura de puntos de Lewis hay dos enlaces O-H localizados, por lo que en general tenemos cuatro electrones de unión. ¿Podemos ver estos electrones de unión también en el diagrama MO? Bueno, reconocemos que hay dos orbitales moleculares de unión que están llenos, el 1a 1 y el 1b 1. Por lo tanto, también en el diagrama MO hay cuatro electrones de unión. Se puede ver sin embargo, que los dos MO no son energéticamente iguales, así dos electrones tienen una energía mayor que los otros dos. Esto es algo que NO vemos en la estructura Lewis-dot. De acuerdo con la estructura de puntos de Lewis, los cuatro electrones son equivalentes. Los MO de unión en el agua se deslocalizan sobre toda la molécula. En contraste con eso en la estructura de puntos de Lewis, dos electrones están localizados en el primer enlace O-H, y los otros dos en el segundo enlace O-H. Esta es otra diferencia entre el punto de Lewis y el cuadro MO del enlace covalente en agua.
A continuación, veamos si hay un equivalente de los dos pares de electrones solitarios en O en la estructura de puntos de Lewis en el diagrama MO. Podemos ver que hay dos MOs rellenos, sin unión, el 1b 2 es completamente no adhesivo, y el 2a 1 es aproximadamente sin unión. Podemos argumentar que estos electrones no enlazantes son las contrapartes de los cuatro electrones en los dos pares solitarios de electrones. Sin embargo, en la estructura de punto Lewis los dos pares solitarios de electrones parecen equivalentes. En la imagen MO podemos ver que los dos electrones no ligantes tienen una energía mayor que los otros dos.
En general, podemos decir que los diagramas MO nos dan una imagen más refinada del enlace covalente en comparación con la estructura de puntos de Lewis. Sin embargo, esto tiene el precio de construir un diagrama MO complicado en comparación con una estructura simple de puntos de Lewis. Por lo tanto, nuestra decisión de construir o no construir un diagrama MO depende de la cantidad de detalles que necesitamos conocer en el contexto de un problema químico que queremos resolver. Por ejemplo, la absorción de luz debida a las transiciones de electrones no se puede explicar a través de una estructura de punto Lewis, necesitamos un diagrama MO para entenderlo.
El diagrama MO de NH 3
Hagamos otro ejemplo más complejo para mejorar nuestra comprensión de la teoría MO, el ejemplo del diagrama MO de NH 3. La molécula NH 3 pertenece al grupo puntual C 3v. El sistema de coordenadas se puede elegir para que el eje z apunte verticalmente, y el eje x apunte a la derecha. El eje y se encuentra perpendicular al plano de papel. La molécula NH 3 está orientada con la punta de la pirámide apuntando hacia arriba y un enlace N-H en el plano xz (Fig. 3.2.23).
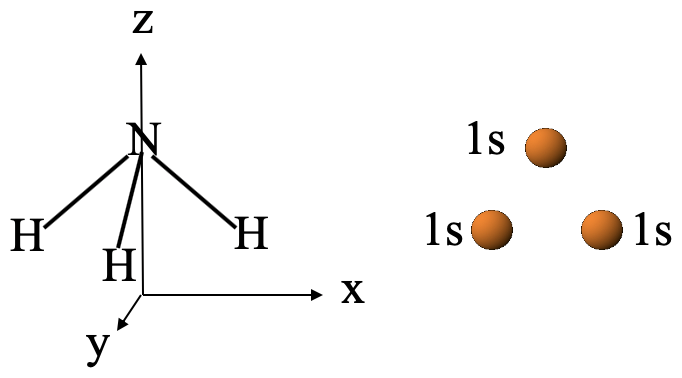
Escogeríamos el átomo de N como el átomo central y los átomos de H los átomos del ligando. Los orbitales de ligando relevantes para la unión serían los orbitales 1s de los átomos de H. Los agruparíamos para formar orbitales de grupos de ligandos. Se esperarían tres OGL ya que se combinarían tres orbitales 1s.
La Representación Reductible de las OGL de NH 3
El siguiente paso es determinar la representación reducible de las OGs utilizando el método de intercambio orbital, Fig. 3.2.24.

Podemos ver que la identidad deja inalterados los tres orbitales, de ahí que el carácter en la representación reducible para E sea 1+1+1=3 (Fig. 3.2.24).
A continuación necesitamos ver qué hace una operación de C 3. Cambia la posición de los tres orbitales, por lo que el carácter en la representación reducible es 0+0+0=0.
Por último, necesitamos ver qué hace un plano de espejo vertical. Tenemos tres planos de espejo conjugados y podemos seleccionar cualquiera de los tres. Por ejemplo podemos seleccionar el que pasa por orbital 1. La reflexión en este plano no cambia la posición del orbital 1, sino que cambia las posiciones de los orbitales 2 y 3. Así, orbital 1 obtiene un carácter 1, los otros obtienen el carácter 0. El carácter de la representación reducible es la suma de estos tres caracteres, y así 1+0+0=1. Ahora, hemos encontrado todos los personajes de la representación reducible.
Las representaciones irreducibles para las LGO de NH 3
A continuación, podemos determinar las representaciones irreducibles a partir de la representación reducible usando la fórmula de reducción. En este caso el número de representaciones irreducibles de tipo A1 es 1, el número de representaciones irreducibles de tipo E es 1, y el número de representaciones irreducibles de tipo A 2 es 0 (Fig. 3.2.25).
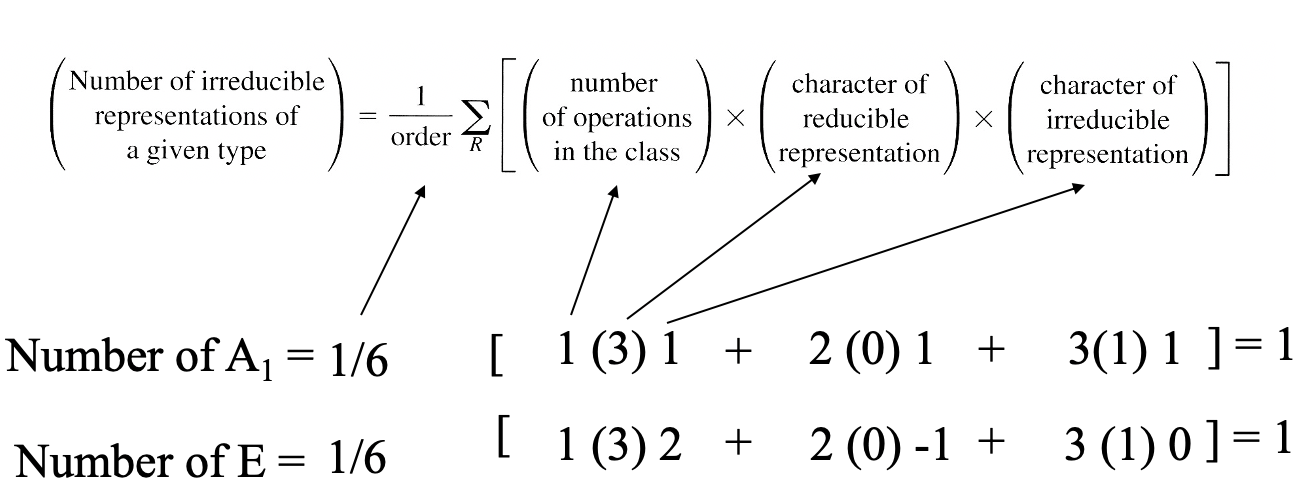
A primera vista parece que solo habíamos encontrado dos de las tres representaciones irreducibles esperadas. Sin embargo, debemos considerar que la simetría tipo E es doblemente degenerada, por lo que cuenta como dos representaciones irreducibles. En consecuencia, dos de los tres orbitales de ligando pertenecen a este tipo de simetría, y son doblemente degenerados. El tercero tiene la simetría tipo A 1.
Tipos de simetría de Orbitales de Átomo Central de NH 3
A continuación, necesitamos determinar el tipo de simetría de los orbitales del átomo central. Un rápido vistazo a la tabla de caracteres nos puede decir eso (Fig. 3.2.26).
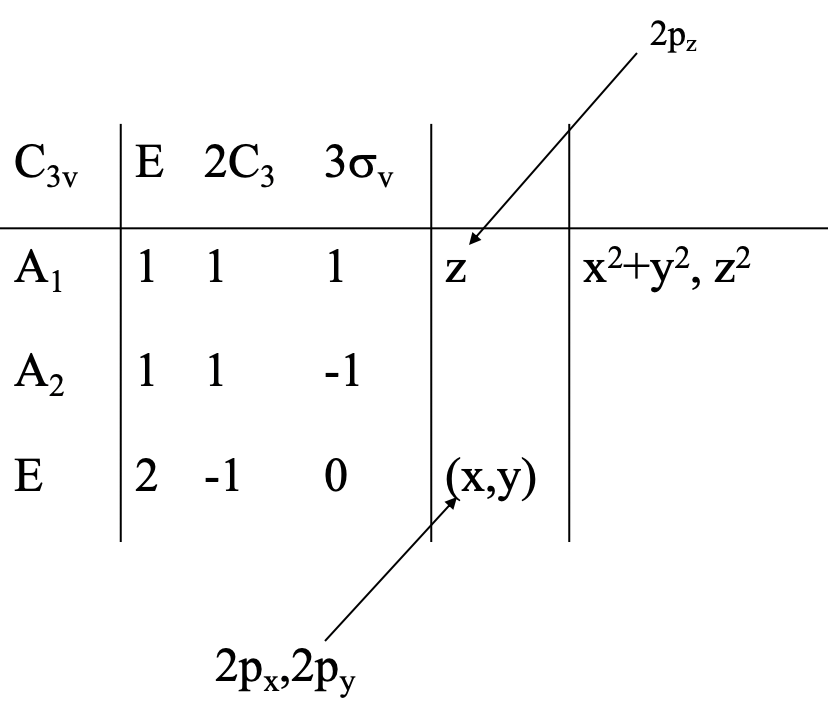
El orbital 2s debe tener el tipo de simetría totalmente simétrica, por lo que debe tener el tipo de simetría A1. Los orbitales 2p x y 2p y se encuentran en la fila para el tipo de simetría E. Están doblemente degenerados como se puede ver por el hecho de que las letras x e y están entre paréntesis. El orbital 2p z tiene simetría A 1, debido a que la letra z se puede encontrar la fila del tipo de simetría A 1.
Combinación de los AOs y LGO de NH 3 para formar MO
Ahora debemos volver a combinar AO de átomos centrales y LGO del mismo tipo de simetría para formar orbitales moleculares. Los orbitales moleculares tendrán el mismo tipo de simetría que los AO y las OGL de los que se han hecho. El número de MO de un tipo de simetría específico debe ser igual a la suma de los OGs y AO que tienen el mismo tipo de simetría. Cuando un orbital no encuentra un orbital compañero del mismo tipo de simetría, entonces es sin unión.
Apliquemos estas ideas a la molécula de amoníaco. Vimos que había dos AO que tenían la simetría tipo A1, es decir, los orbitales 2s y 2p z. También hubo un LGO con simetría A 1. Por lo tanto, podemos combinar estos tres orbitales para formar orbitales moleculares. También deben tener la simetría tipo a 1.

A continuación, pensemos en orbitales de la simetría tipo A 2. Ningún AO y ningún LGO tiene este tipo de simetría. Por lo tanto, tampoco hay MO de este tipo de simetría. Para el tipo de simetría E encontramos que existen dos AO, a saber, el orbital 2p x y 2p y y dos LGO que tienen este tipo de simetría. Esto significa que estos dos orbitales se pueden combinar para formar cuatro MO del tipo de simetría E (Fig. 3.2.28).

El diagrama MO de NH 3
Ahora podemos construir el diagrama MO de NH 3 (Fig. 3.2.29).
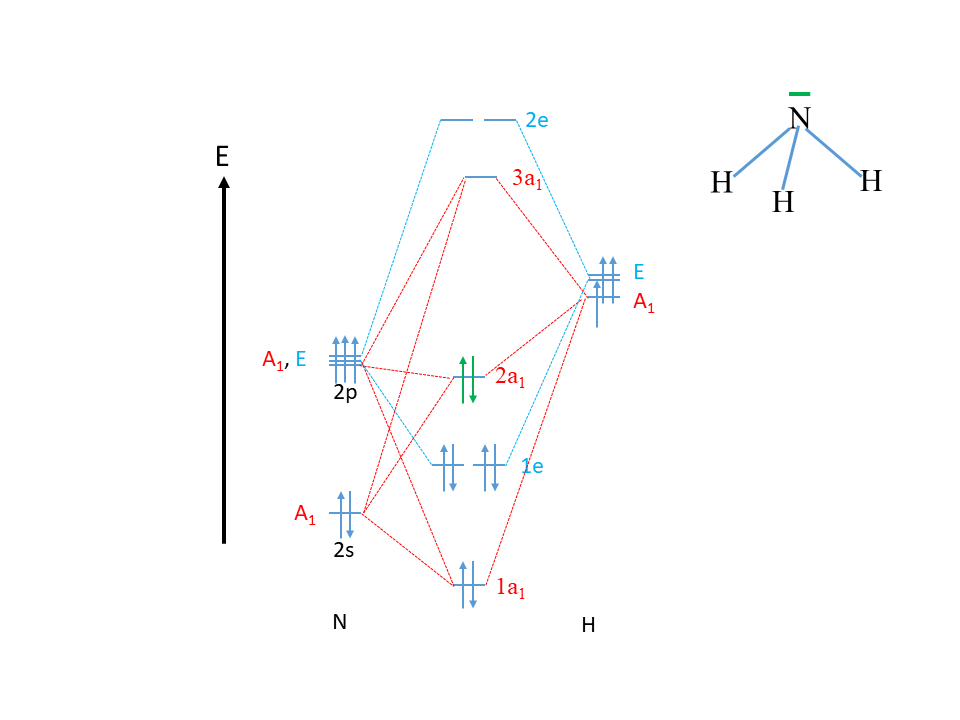
Primero, dibujamos el eje de energía e indicamos los átomos N y H en el lado izquierdo y derecho del diagrama. En el siguiente paso dibujamos los orbitales atómicos para el átomo N e indicamos el tipo de simetría. El orbital 2s debe ser dibujado por debajo de los orbitales 2p para indicar su menor energía.
Entonces, podemos dibujar los orbitales del grupo ligando en el lado derecho del diagrama e indicar la simetría. Podemos dibujar el LGO tipo A1 algo por debajo de los orbitales de tipo E porque tiene una energía algo menor, pero esto es opcional. Sabemos que se deben formar tres MO con una simetría 1. Cuando se forman tres MO, entonces podemos estimar que uno será uno de unión de baja energía, uno será uno antiadhesivo de alta energía y el tercero será aproximadamente uno sin unión de energía intermedia. Por lo tanto, dibujaremos el enlace 1a 1-orbital por debajo del orbital 2s, y el orbital anti-unión 3a 1 por encima del LGO de tipo A1, y el orbital 2a 1 aproximadamente a medio camino entre ellos. También etiquetamos los MO de acuerdo con la energía con las etiquetas 1a 1, 2a 1 y 3a 1, respectivamente. Por último, interconectamos el AO y los LGO del tipo de simetría A1 con los MOs de tipo a 1 a través de líneas punteadas. Se muestran en rojo (Fig. 3.2.29).
Después, dibujamos los cuatro MO de tipo E. Debido a que la simetría tipo E implica que los orbitales son doblemente degenerados, sabemos que debe haber dos MO de doble enlace degenerado y dos MO anti-enlace doble degenerados del tipo de simetría E. Una propiedad valiosa de la teoría de grupos es que la doble degeneración en simetría también implica doble degeneración en energía, y esto significa que sabemos que los dos MO de unión tienen la misma energía, y los MO antiadhesión también tienen la misma energía. También debemos dibujarlos de esta manera en el diagrama MO. El par de unión está etiquetado 1e y el par antiunión está etiquetado 2e. No podemos saberlo con certeza a partir de una inspección cualitativa, pero podemos sospechar que los dos orbitales tipo e de unión tienen una energía entre el orbital 1a 1 y el 2a 1 orbital. El orbiital 2a 1 es mayor que el orbital 1e debido a que el primero es aproximadamente no unido, y el segundo es de unión. El orbital 1a 1 es probablemente menor en energía que el orbital 1e porque el orbital 1a 1 tiene una contribución del orbital 2s de baja energía, mientras que el orbital 1e solo tiene contribuciones de los orbitales 2p energéticamente más altos. Por argumentos similares podemos explicar que el orbital 2e tiene una energía algo mayor que el 3a 1.
Ahora todavía necesitamos llenar los electrones en los orbitales. El átomo de N tiene cinco electrones de valencia, dos en los 2s y tres en los orbitales 2p. Los tres LGO de H contienen un electrón cada uno. Esto da en general 5+3=8 electrones que necesitamos llenar en los MOs de acuerdo con la energía. Eso llena primero el orbital 1a 1, luego los dos orbitales 1e 1, y finalmente el orbital 2a 1. Esto hace que el 2a 1 orbital sea el HOMO en la molécula, y el 3a 1 el LUMO en la molécula.
También podemos hacer nuevamente una comparación del MO y el cuadro de Lewis-dot del enlace covalente. Podemos ver el HOMO no enlazante el equivalente del par electrón-solitario en N. Hay seis electrones en MoS de unión que es el equivalente de los seis electrones de unión en la estructura Lewis-dot. Sin embargo, en el diagrama MO podemos ver que los seis electrones no son equivalentes en energía. No podemos ver eso en la estructura Lewis-dot. Nuevamente, podemos concluir que el diagrama MO nos da más información sobre la vinculación, que viene a expensas del mayor esfuerzo para construir un diagrama MO.


