4.1: Teoría orbital molecular y reacciones ácido-base de Lewis
- Page ID
- 70230
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Una breve revisión de la teoría ácido-base de Lewis
En este capítulo discutiremos las reacciones de Lewis-ácido-base desde la perspectiva de la teoría orbital molecular. El concepto ácido-base de Lewis ha sido desarrollado por Gilbert Lewis (Fig. 4.1.1).

https://commons.wikimedia.org/wiki/F...wton-Lewis.jpg)
Es un concepto ácido-base muy general, e incluye los conceptos ácido-base Broensted y Arrhenius. Es muy importante para la química de coordinación. Repasemos brevemente lo que es un ácido de Lewis, una base de Lewis y una reacción ácido-base de Lewis.
Un ácido de Lewis se define como un aceptor de pares de electrones.
Definición: Lewis Acid
Un ácido de Lewis es un aceptor de pares de electrones
Una base de Lewis se define como un donante de pares de electrones.
Definición: Lewis Base
Una base de Lewis es un donante de pares de electrones
Un ejemplo de un ácido de Lewis es BH 3, y un ejemplo para una base de Lewis es NH 3. ¿Qué sucede en una reacción de Lewis-ácido base?
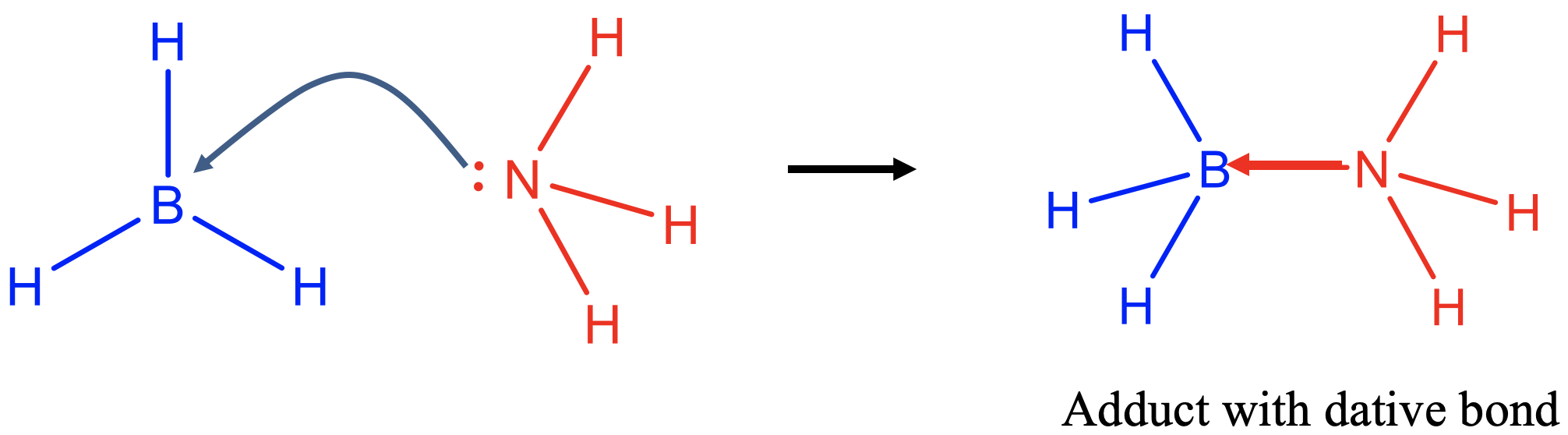
La base de Lewis dona un par de electrones para formar un enlace covalente con el ácido de Lewis (Fig. 4.1.2). Un enlace covalente formado en una reacción ácido-base de Lewis generalmente se llama enlace dativo porque ambos electrones en el enlace covalente provienen de una sola pareja. En un enlace covalente “convencional” ambos socios aportan un electrón al enlace covalente. Sin embargo, no hay diferencia fundamental entre un enlace covalente “convencional” y un enlace covalente dativo, es solo cuestión de perspectiva. Para indicar un enlace dativo se puede dibujar una flecha apuntando desde el átomo donante al aceptor, en lugar de solo una línea. El producto de reacción de una reacción ácido-base de Lewis se denomina aducto.
Como se mencionó anteriormente, el concepto ácido-base de Lewis es bastante general y puede explicar la unión en compuestos bastante diferentes. Incluye el concepto ácido-base de Broensted, lo que significa que cualquier ácido de Broensted también es un ácido de Lewis, y cualquier base Broensted también es una base de Lewis. Sin embargo, lo contrario no es cierto. No todos los ácidos de Lewis son un ácido Broensted, y no todas las bases de Lewis son una base Broensted.
Aquí hay algunos ejemplos que pueden ilustrar la generalidad del concepto ácido-base de Lewis.
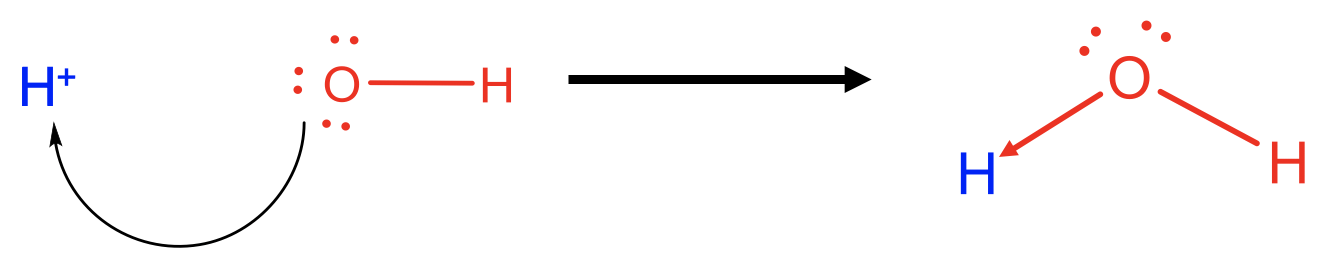
Por ejemplo, un ion H + es un ácido de Lewis y un anión OH - es una base de Lewis, y los dos pueden reaccionar para formar agua como un aducto de base de ácido de Lewis. En este caso uno de los enlaces O-H en la molécula de agua sería visto como un enlace dativo, mientras que el otro sería visto como un enlace covalente “regular”. Por supuesto, no hay diferencia real entre los dos lazos, solo tenemos una perspectiva diferente sobre ellos. La misma reacción también podría verse como una reacción ácido-base de Broensted con el ion OH - como aceptor de protones, y el ion H + como donante de protones.
El concepto ácido-base de Lewis también explica la unión en compuestos de coordinación y la formación de compuestos de coordinación a partir de iones metálicos y ligandos. El ligando es la base de Lewis y el ion metálico es el ácido de Lewis, el compuesto de coordinación es el aducto ácido-base de Lewis. El enlace entre el ion metálico y el ligando es un enlace dativo que apunta desde el ligando al metal.
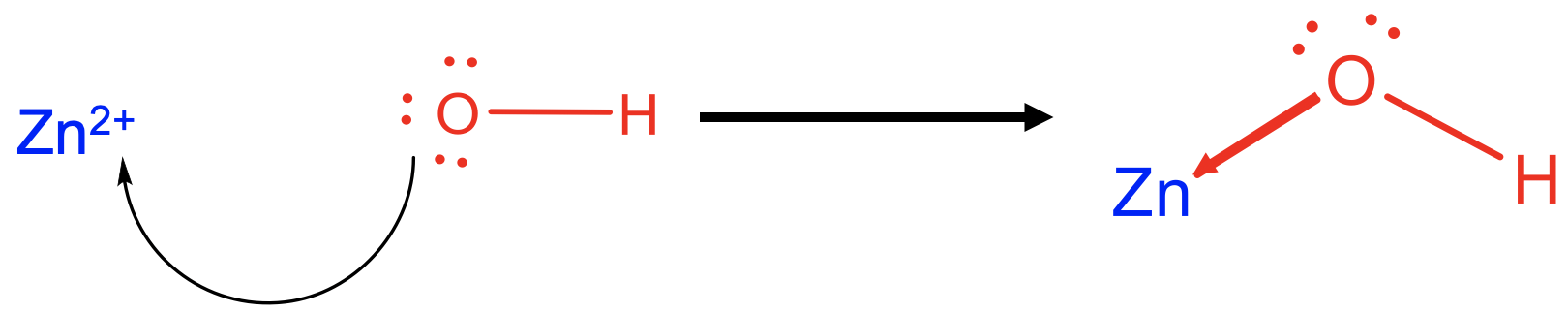
Por ejemplo, Zn 2 + actúa como un ácido de Lewis cuando reacciona con 4 OH - como base de Lewis para formar aniones tetrahidroxo zincato (2-) (Fig. 4.1.4). Los enlaces Zn-O formados son enlaces dativos indicados como flechas que apuntan desde el O al Zn.
El concepto ácido-base de Lewis puede incluso ser utilizado para explicar la unión en cristales iónicos. En este caso el anión sería el donador y el catión el aceptor.
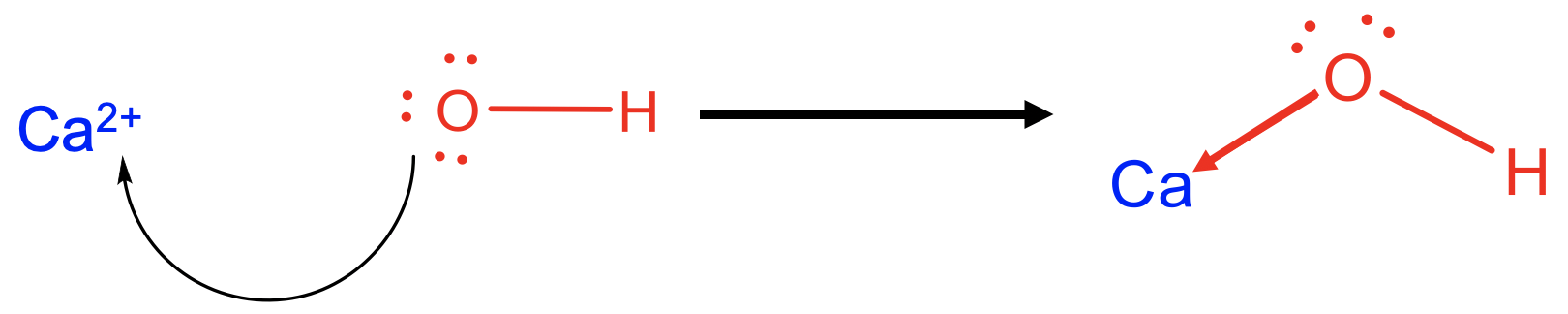
Por ejemplo, Ca 2 + puede verse como un ácido de Lewis, y OH - como una base de Lewis en una reacción que forma hidróxido de calcio Ca (OH) 2 como aducto ácido-base de Lewis. Los enlaces entre Ca 2 + y OH - serían vistos como unos enlaces dativos indicados como flechas apuntando de O a Ca. En este caso los enlaces iónicos se interpretarían como enlaces dativos altamente polares. Es posible que desee recordar en este contexto que los enlaces completamente iónicos no son posibles en general, y también debe haber algún grado de covalencia debido a la diferencia finita de electronegatividad entre dos elementos.
Teoría MO y bases de Lewis
La teoría MO es una teoría diseñada para explicar el enlace covalente. Debido a que los enlaces dativos son enlaces covalentes, la teoría MO debería ser capaz de explicar los enlaces dativos. Entonces, ¿cómo pueden verse los ácidos y bases de Lewis y sus reacciones desde una perspectiva de la teoría MO? La teoría MO establece que una molécula es una base de Lewis cuando su HOMO es aproximadamente no enlazante (Fig. 4.1.6).
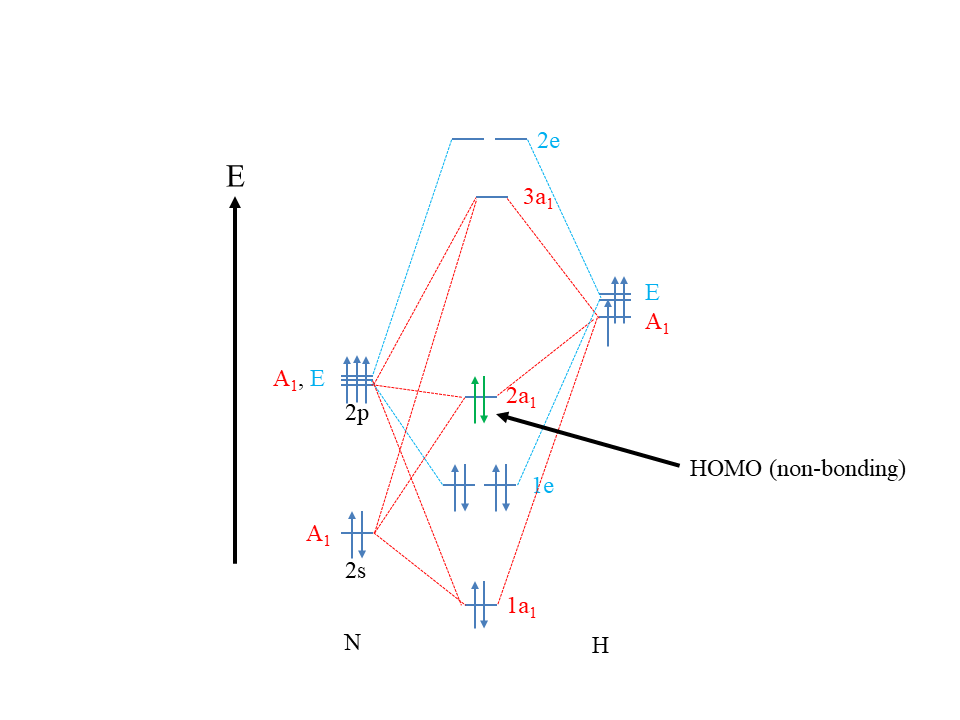
Esto explica, por ejemplo, que NH 3 es una base de Lewis. Recuerde, su HOMO, el orbital 2a 1, es aproximadamente sin unión. ¿Por qué un HOMO aproximadamente sin unión hace que una molécula sea una base de Lewis? En primer lugar, debido a que los electrones HOMO son los electrones de mayor energía y, por lo tanto, los electrones más reactivos, se donan preferencialmente sobre todos los demás electrones. La naturaleza no enlazante del HOMO es ideal, porque si el HOMO fuera antienlace, los electrones serían tan reactivos, por lo que probablemente se transferirían completamente al compañero de reacción. En este caso no tendríamos una reacción ácido-base de Lewis, sino una reacción redox. No formaríamos un enlace covalente, sino un enlace iónico. Si el HOMO se uniera, entonces la energía de los electrones sería demasiado poco reactiva, simplemente no se observaría ninguna reacción.
Teoría MO y ácidos de Lewis
Entonces, ¿qué es entonces un ácido de Lewis según la teoría de MO? Un ácido de Lewis, desde la perspectiva de la teoría MO, es una molécula que tiene un orbital molecular desocupado más bajo aproximadamente no enlazante. El orbital necesita desocupado, de lo contrario no se podrían donar electrones a él. Para los argumentos de minimización de energía, los electrones serían donados al orbital desocupado que tiene la energía más baja, que es el LUMO. Entonces, ¿por qué es ideal si el LUMO no está unido? Si fuera antienlace, su energía probablemente sería demasiado alta, y el donante no podría donar sus electrones. No habría una estabilización de electrones debido a la alta energía de la LUMO. La molécula permanecería no reactiva. Si el LUMO fuera un orbital de unión, entonces su energía probablemente sería tan baja para que los electrones probablemente se transfirieran completamente al ácido de Lewis. En este caso no formaríamos un enlace dativo sino un enlace iónico a través de una reacción redox.
Un ejemplo de un ácido de Lewis es la molécula BeH 2. Es una molécula lineal perteneciente al grupo puntual D ∞ h. La tabla de caracteres de este grupo de puntos es un poco inusual porque el eje principal tiene orden infinito, y hay un número infinito de ejes C 2 y planos espejo (Fig. 4.1.7). Por lo tanto, los tipos de simetría de este grupo de puntos no son del tipo que encontramos anteriormente. No queremos entender la tabla de caracteres y sus tipos de simetría en detalle aquí, sino simplemente extraer la información que es relevante para nosotros para construir los orbitales moleculares.
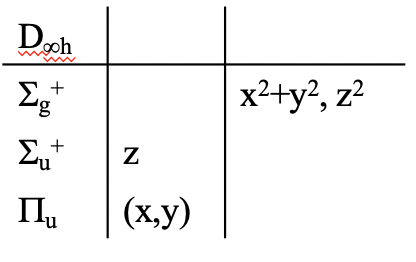
El átomo central de la molécula es el átomo Be, y sus orbitales de valencia son los orbitales 2s y 2p. De acuerdo con la tabla de caracteres de D ∞ h el orbital 2s tiene el tipo de simetría σ g +, el orbital 2p z tiene la simetría π u, y los orbitales 2p x y 2p y son doblemente degenerados, y tienen el tipo de simetría σ u +.
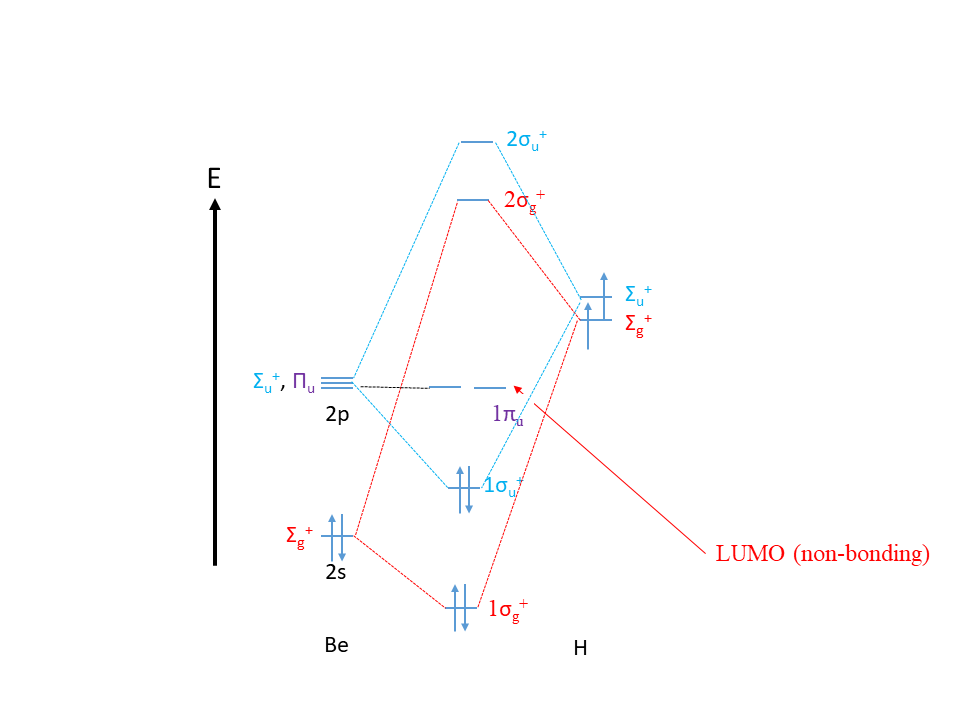
Los dos orbitales 1s de H forman orbitales de dos grupos de ligandos. La determinación de la representación reducible e irreducible de las LGO vía SALC daría los tipos de simetría de los LGO que en este caso son σ g + y σ u +. Por lo tanto, esperamos que haya una orbital de unión y una orbital antiunión de tipo σ g +, y una orbital de unión y una orbital antiunión sean de tipo σ u +. Los orbitales 2p x y 2p y permanecen sin unión. El átomo Be tiene dos electrones de valencia en el orbital 2s, y los 2 átomos H aportan dos electrones de valencia cada uno, por lo que en general hay cuatro electrones que necesitamos llenar en los MoS. Esto llena la unión σ g + y la σ u +, haciendo que la σ u + sea el HOMO. Ves que aquí tenemos un HOMO de vinculación, lo que argumentaría que BeH 2 no es una base de Lewis. Sin embargo, vemos que los LUMO son los orbitales 2p x y 2p y no vinculantes. Esto explica el carácter ácido de Lewis de la molécula.
Unión en aductos de base ácida de Lewis
La mayor interacción covalente entre dos orbitales se logra cuando ambos orbitales tienen la misma energía. Esto lo aprendimos previamente en el Capítulo 3 cuando discutimos el criterio energético. Lo mismo vale para los bonos dativos. Cuanto más similares sean las energías del donante HOMO y del aceptor LUMO, mayor es la interacción covalente. Idealmente, las energías son exactamente las mismas. En este caso formamos un enlace covalente perfecto con los electrones igualmente compartidos entre el donante y el aceptor. Esto se puede ilustrar gráficamente en un diagrama MO de la siguiente manera (Fig. 4.1.9).
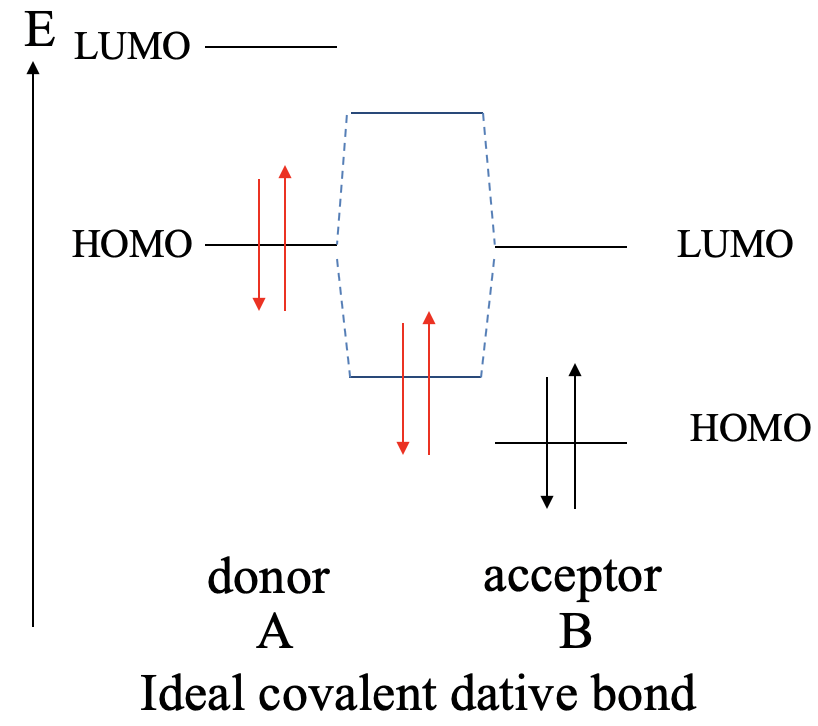
Supongamos una molécula A que actúa como donante y una molécula B que actúa como aceptora. El donante A tiene un HOMO y un LUMO que tienen cierta energía. La molécula aceptora B también tiene un HOMO y un LUMO, teniendo el LUMO la misma energía que el HOMO de A. La molécula B también tendrá HOMO que está energéticamente por debajo de ese LUMO. Debido a que sus energías idénticas la combinación del HOMO de A con el LUMO de B conduce a un MO de unión y un MO antienlace con densidad electrónica igualmente compartida. Ambos MO tienen energía equidistante del HOMO de A y el LUMO de B. Los electrones provenientes del HOMO de A estarán en el MO de unión. Serán igualmente compartidos, y el enlace dativo es un enlace covalente ideal.
La coincidencia exacta de las energías HOMO y LUMO del donante y aceptor rara vez se logra. Consideremos una serie de escenarios en los que estas energías no son las mismas, y qué consecuencias tiene esto para el vínculo dativo.
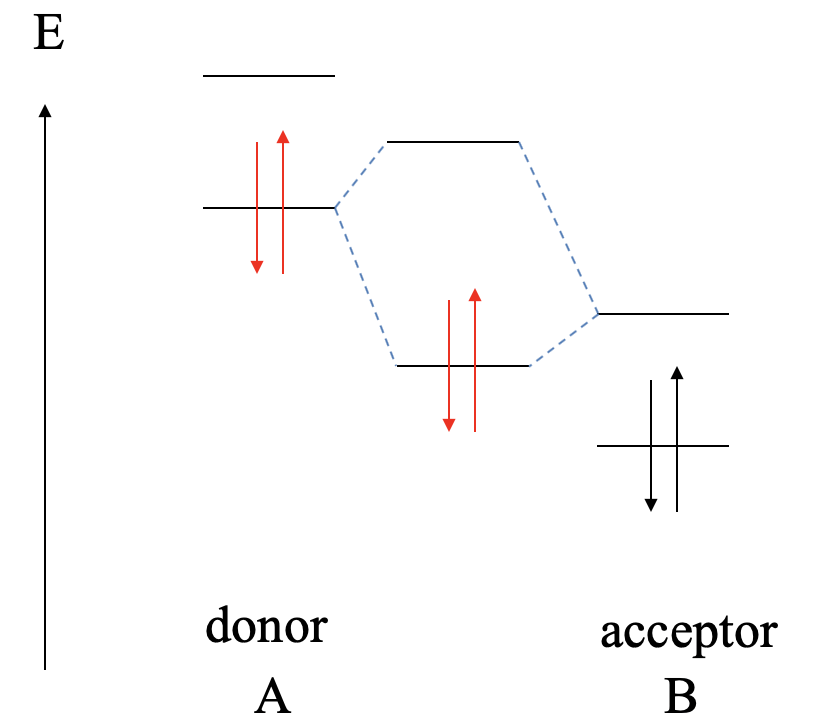
Supongamos a continuación, que el LUMO del aceptor B es algo menor que el HOMO del donante A. En este caso, todavía podemos formar un MO de unión y un MO antienlace debido a la interacción covalente entre el HOMO de A y el LUMO de B. Sin embargo, ahora el MO de unión se localizará principalmente en B, y el anti- MO de unión se localizará principalmente en A. Los electrones del HOMO de A estarán en el MO de unión, y así los electrones de unión en el enlace dativo se localizarán principalmente en B. Esto significa que el enlace dativo es polar, y polarizado hacia el aceptor.
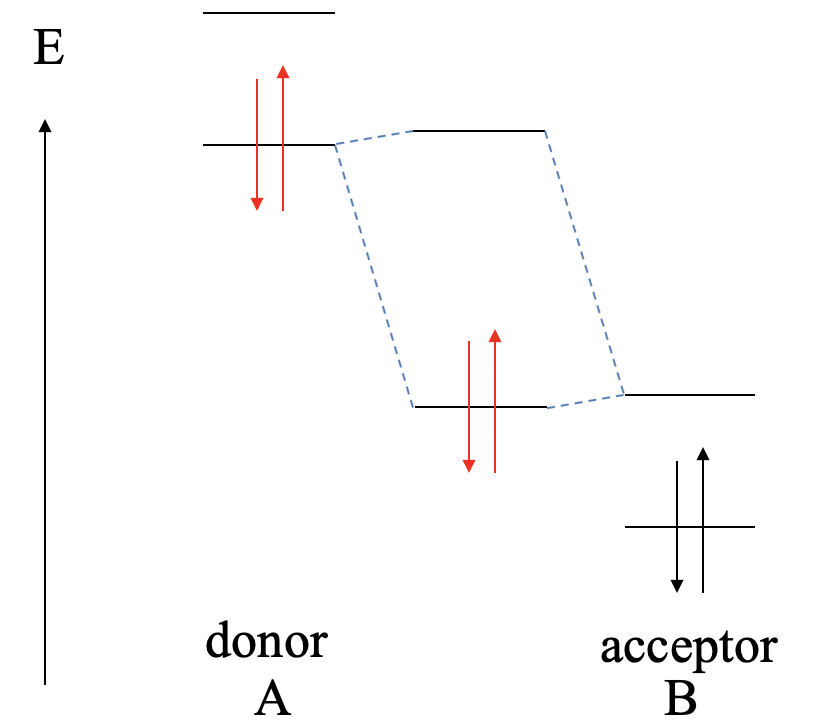
Consideremos a continuación, cuál será la vinculación si la LUMO del aceptor es mucho menor que el HOMO del donante (Fig. 4.1.11). En este caso, aún existe la posibilidad de formar un MO de unión y un MO antiunión, pero el MO de unión se localizará prácticamente exclusivamente en el aceptor, y el MO antiunión se localizará prácticamente por completo en el donante. Los electrones del donador estarán en el MO de enlace, pero debido a que el MO de enlace se localiza casi en su totalidad en el aceptor, los electrones se transfieren completamente de A a B en una reacción redox, y el enlace será iónico, y tenemos un compuesto iónico AB hecho de cationes A 2+ y B 2- aniones. Esta reacción ya no se consideraría una reacción ácido-base de Lewis, y el producto de reacción ya no se consideraría un aducto ácido-base de Lewis.
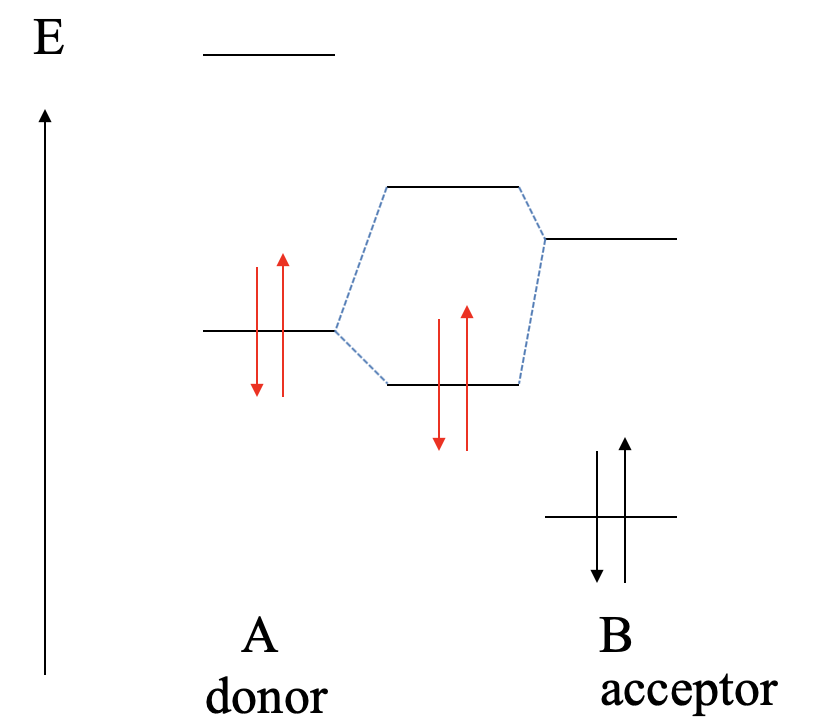
La siguiente posibilidad a considerar es que el LUMO de B es mayor en energía que el HOMO de A (Fig. 4.1.12). En este caso, el MO de unión se localizará principalmente en el donante A y los electrones en el enlace dativo estarán predominantemente en A. Tenemos un enlace polar dativo que está polarizado hacia A.
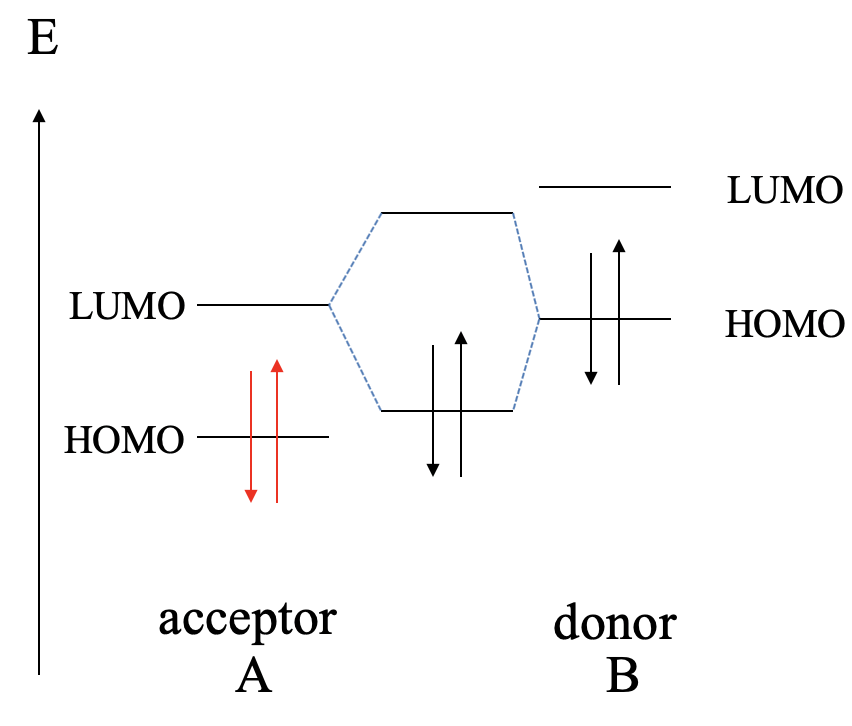
A continuación, elevemos aún más la energía del HOMO y la LUMO de B. Esto lleva a que ahora el HOMO de B se encuentre energéticamente más cerca del LUMO de A, comparado con la diferencia energética entre el HOMO de A y el LUMO de B. Esto da como resultado que la interacción será mayormente entre el HOMO de B y el LUMO de A. Como consecuencia, B actuará ahora como donante , y A actuará como aceptador. El enlace dativo puede estar polarizado hacia A o B, o no ser polar en absoluto dependiendo de la energía relativa del HOMO de B y el LUMO de A.
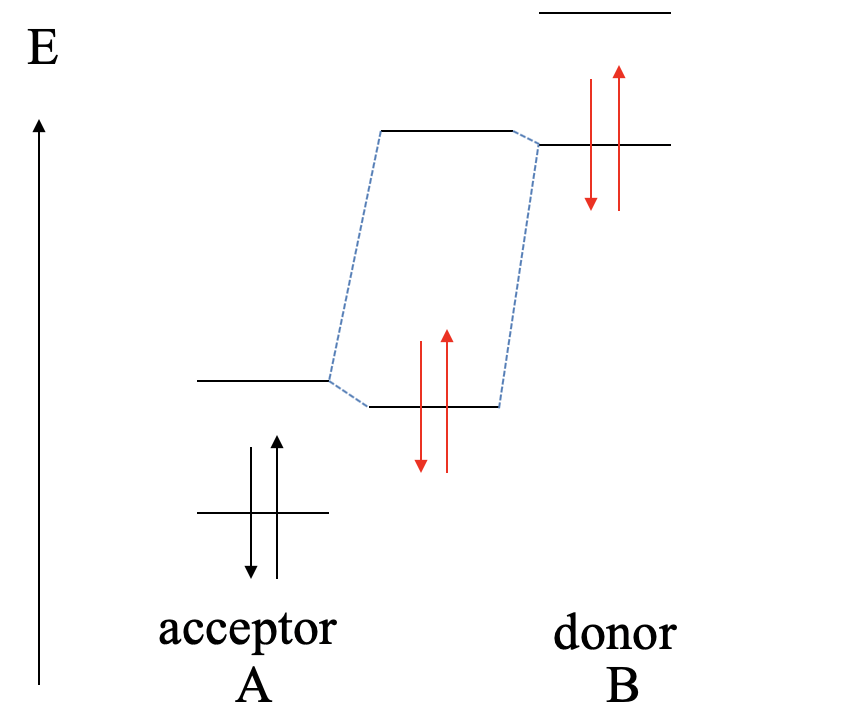
Si elevamos aún más las energías orbitales de B, y el HOMO de B es mucho mayor que el HOMO de A, entonces obtendremos una reacción redox. B se oxida y A se reduce. Los cationes B 2+ y los aniones A 2- formarán un compuesto iónico de la composición AB.
Ejemplos
En términos generales, las energías relativas HOMO y LUMO de los compañeros de reacción deciden si tiene lugar una reacción ácido-base de Lewis, o una reacción redox, y cuál es la polaridad del enlace. Aquí hay algunos ejemplos que ilustrarán nuestras consideraciones generales (Fig. 4.1.15).
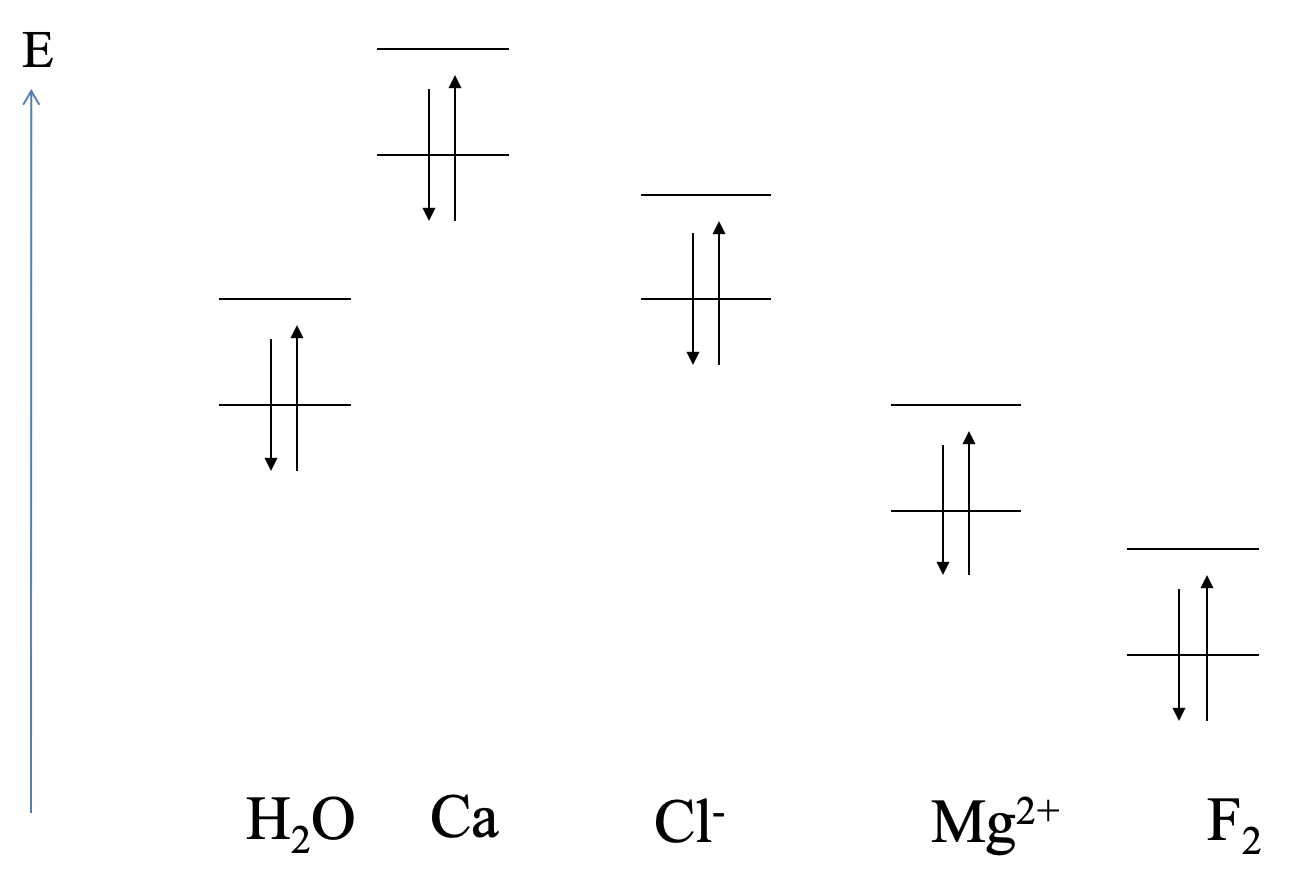
Se muestran las energías orbitales relativas de los orbitales atómicos más altos ocupados y los orbitales atómicos desocupados más bajos de calcio, y las energías HOMO y LUMO de H 2 O (Fig. 4.1.15). ¿Podemos predecir el tipo de reacción? Podemos ver que la órbita de Ca ocupada más alta tiene una energía mucho mayor que la LUMO de agua. Por lo tanto, esperaríamos que el Ca se oxide, y el agua se reduzca. Se esperaría un compuesto iónico. Esto es lo que realmente sucede en el experimento. La reacción de agua y calcio produce hidróxido de calcio e hidrógeno gaseoso.
A continuación, consideremos una posible reacción entre el agua y el cloruro. Podemos ver que el HOMO de Cl -es similar en energía comparado con el LUMO de H 2 O. Por lo tanto, esperaríamos una interacción ácido-base de Lewis con Cl - como donante y H 2 O como aceptor. Tal interacción de hecho ocurre en soluciones acuosas que contienen Cl - en forma de débil enlace de hidrógeno entre Cl - y H 2 O.
A continuación, consideremos las interacciones entre Mg 2 + y H 2 O. En este caso el LUMO de Mg 2 + tiene aproximadamente la energía del HOMO de la molécula de agua. Por lo tanto, esperaríamos que la molécula de agua actúe como donante y el Mg 2 + actúe como aceptor. En efecto, Mg 2 + forma un complejo hexaaqua con agua, que tiene la composición Mg (H 2 O) 6 2+. La unión debe ser muy poco polar.
Por último, ¿cuáles son las interacciones entre F 2 y H 2 O? El HOMO de H 2 O es mucho mayor que el LUMO de F 2. Por lo tanto, esperaríamos una reacción redox en la que F 2 se reduzca, y H 2 O se oxide. En realidad F 2 puede oxidar H 2 O para formar DE 2 y HF.
A partir de los ejemplos anteriores también queda claro que no necesariamente podemos predecir la fuerza de las interacciones Lewis-ácido-base. Por ejemplo, el enlace de hidrógeno entre H 2 O y Cl - es mucho más débil que los enlaces dativos entre H 2 O y Mg 2 +. Otros factores como el solapamiento orbital también deben ser tomados en consideración para hacer declaraciones sobre la fuerza de las interacciones.


