4.2: Ácidos y bases duros y blandos
- Page ID
- 70221
El concepto de bases duras y blandas (HSAB)
El concepto ácido y base duro y blando (HSAB) puede concebirse como un refinamiento del concepto de ácido y base de Lewis. Su característica más útil es que puede hacer predicciones sobre la fuerza de las interacciones ácido-base. También puede estimar si las interacciones son más iónicas o más covalentes.
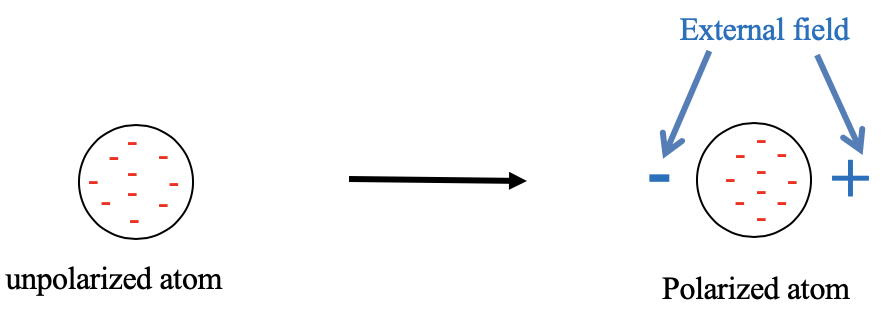
4.2.1 Representación visual de un átomo no polarizado y un átomo polarizado en un campo eléctrico.
Primero aclaremos qué se entiende por duro y blando, respectivamente. Estos términos se refieren a la polarizabilidad de los electrones en un átomo o una molécula (Fig. 4.2.1). Un átomo es blando cuando sus electrones son fácilmente polarizables. Esto significa que la nube de electrones se deforma fácilmente en un campo eléctrico. La deformación fácil es consistente con el término “suave”. En un campo eléctrico los electrones cargados negativamente son atraídos hacia el polo positivo del campo eléctrico. Por lo tanto, la nube de electrones se distorsiona hacia el extremo positivo del campo eléctrico, y el átomo se polariza. Viceversa, cuando la nube de electrones no es fácilmente polarizable, decimos que el átomo es duro. ¿Qué se entiende entonces por un ácido o base duro y uno blando? Un ácido duro o blando es un ácido de Lewis duro o blando, y una base dura o blanda es una base de Lewis dura o blanda. Como se mencionó anteriormente, el concepto HSAB es útil porque hace declaraciones sobre la fuerza de las interacciones ácido-base, y por lo tanto la fuerza de los enlaces. También puede hacer declaraciones sobre si el enlace es más covalente o más iónico (Fig. 4.2.2).

Generalmente, las interacciones duras-duras, es decir, las interacciones entre un ácido duro y una base dura, tienden a ser fuertes. La unión es más probable iónica. Las interacciones blando-blando también tienden a ser fuertes, pero son más probables covalentes. Las interacciones duro-suaves tienden a ser débiles.

¿Por qué las interacciones suave-suave y duro-duro son fuertes, mientras que las interacciones duro-suaves son débiles Para responder a esta pregunta, primero debemos entender qué hace que un ácido o base sea duro o blando. Generalmente, podemos decir que cuanto más deslocalizados están los electrones, más suaves son las especies. Para un solo átomo o ion esto significa que cuanto mayor sea el átomo o ion, más suave será la especie. Cuanto mayor es el tamaño del átomo, más deslocalizados son sus electrones de valencia. El tamaño de un átomo neutro se define por su posición en la tabla periódica. Generalmente, cuanto mayor es el periodo, más suave es el átomo (Fig. 4.2.3).

Para los iones, también la carga juega un papel. Para los cationes, una mayor carga positiva hace que un catión sea más duro, para los aniones una mayor carga negativa hace que el anión sea más blando (Fig. 4.2.4).

El tamaño del átomo donador/aceptor no es el único factor que determina la dureza. También es importante la capacidad de la especie para hacer enlaces π. Las especies que tienen orbitales adecuados para la unión π tienden a ser suaves incluso si los argumentos de tamaño sugieren que son duros. Esto se debe a que el enlace π aumenta la deslocalización de electrones (Fig. 4.2.5).
Por ejemplo, los metales de transición tienen orbitales d disponibles que son adecuados para la unión p con ligandos, mientras que los metales alcalinos no. Por lo tanto, un catión de metal de transición relativamente pequeño como Cu + es más blando que los iones de metales alcalinos grandes como Cs +. Para los aniones, la unión π también es importante. Por ejemplo, los aniones CN - son bases blandas a pesar de que el átomo de carbono donante es pequeño porque el ligando CN tiene orbitales π disponibles para enlaces π con ácidos de Lewis.
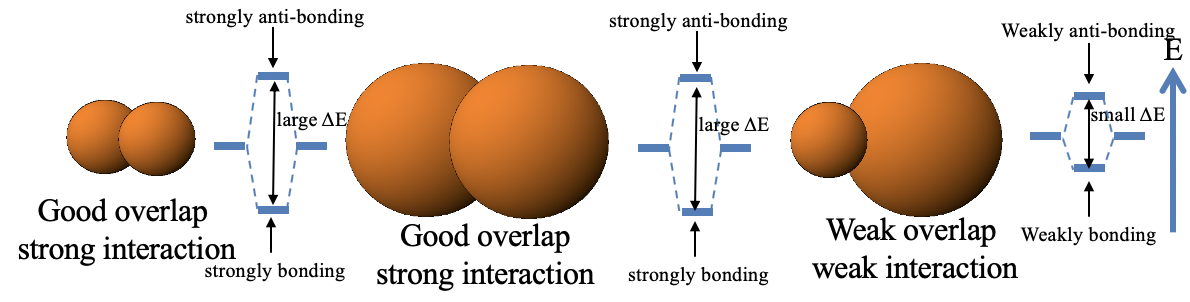
Así que volvamos a la pregunta: ¿Por qué las interacciones suave-suave y duro-duro son fuertes, pero las interacciones duro-suaves débiles? Esto esencialmente se reduce a la regla 2 del criterio de superposición orbital (ver capítulo 3 sobre la teoría MO). Dos orbitales pequeños tienen típicamente buena superposición, y dos orbitales grandes también tienen una buena superposición orbital, y por lo tanto la interacción es fuerte. Sin embargo, los orbitales grandes y pequeños tienden a tener un solapamiento orbital débil y, por lo tanto, la unión es débil.
Ahora a la pregunta de por qué las interacciones suaves-suaves tienden a ser más covalentes, mientras que las interacciones duro-duras tienden a ser más iónicas. La respuesta tiene que ver con el hecho de que en átomos más pequeños las diferencias de energía entre los orbitales atómicos tienden a ser mayores en comparación con los átomos grandes. Como consecuencia, es estadísticamente más probable que el HOMO y LUMO de dos especies blandas tengan energías más similares en comparación con dos especies duras. Cuando el HOMO y LUMO de un ácido de Lewis y una base de Lewis son similares en energía, entonces el enlace es más covalente. Cuando son significativamente diferentes, entonces el enlace es más iónico.
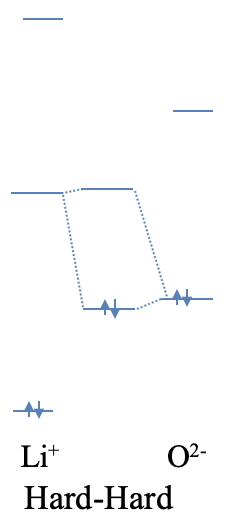
Ilustremos esto con dos ejemplos calificativos. El óxido de litio está hecho de O 2- aniones y cationes Li +. Si vemos el enlace iónico entre los iones O 2- y Li + como un caso extremo de un enlace polar dativo, entonces el anión óxido actúa como una base de Lewis, y el ion Li + actúa como un ácido de Lewis. ¿Cómo se puede explicar la alta ionicidad? Tanto el Li + como el O 2- son iones pequeños, por lo que ambos son duros. El pequeño tamaño también implica que las diferencias de energía entre los orbitales atómicos son grandes. Debido a esto, es poco probable que el orbital atómico ocupado más alto del ion O 2- tenga una energía similar a la órbita atómica desocupada más baja del ion Li +. Debido a la gran diferencia de energía, el MO de unión se localizará casi completamente en el anión O 2-, y el enlace será iónico (Fig. 4.2.7).
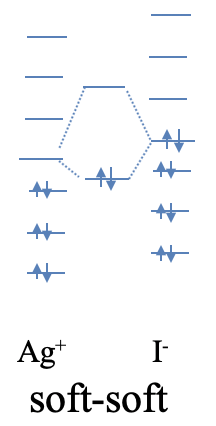
Un ejemplo de un compuesto con interacciones blandas fuertes es el yoduro de plata. Si bien AGi se considera un compuesto iónico, las interacciones tienen un carácter covalente significativamente más fuerte. La naturaleza blanda de Ag + se entiende fácilmente por el hecho de que Ag + es un ion de metal de transición del período 5 con baja carga positiva, y orbitales d disponibles para la unión π. El yodo es un elemento periodo 6, por lo que el yoduro es bastante blando. Debido a que Ag e I son elementos del periodo 5 y 6, respectivamente, sus diferencias de energía orbital son significativamente menores que las de O y Li, que son elementos del período 2. Así, el HOMO de I - y el LUMO de Ag + son naturalmente más cercanos en energía dando como resultado una interacción más covalente (Fig. 4.2.8).
Debemos ser conscientes de que necesitamos tratar estas consideraciones con cautela. Por ejemplo, los enlaces B-O son enlaces bastante covalentes a pesar de que B y O son ambos bastante duros. El HOMO del donante y el LUMO del aceptor de especies duras no son necesariamente muy diferentes. Otros parámetros como las diferencias de electronegatividad también pesan y deben tenerse en cuenta para predecir correctamente la naturaleza del enlace químico.
Ejemplos - Bases
Para tener la sensación de estimar correctamente la dureza de una especie consideremos algunos ejemplos. Empecemos con algunas bases.

Qué declaraciones sobre la dureza se pueden hacer para las series F -, Cl -, Br -, I - (Fig. 4.2.9). Todos son iones halogenuros con la misma carga negativa. El tamaño aumenta de fluoruro a cloruro, a bromuro a yoduro. Así, la suavidad debe aumentar en el mismo orden. F - es un ion pequeño con una pequeña carga negativa y debería ser duro, yo es un elemento muy pesado por lo tanto yo - es muy suave. Cl - y Br - son iones moderadamente duros y blandos, respectivamente.
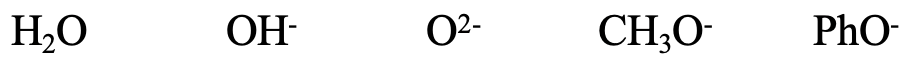
A continuación, considere las series H 2 O, OH -, O 2-, CH 3 O -, y Pho -. Todas las especies contienen pequeños átomos donadores de O, por lo que todas ellas deben considerarse duras. El ion OH - es algo más blando que el H 2 O debido a la carga negativa que aumenta el tamaño del átomo de O donante. Por la misma razón O 2- es algo más suave que OH -. CH 3 O - es algo más suave que O 2- debido al efecto inductivo positivo del grupo metilo. El ion fenolato es el más blando porque la carga negativa en O puede deslocalizarse en el anillo aromático. La deslocalización de la carga negativa conduce a una mayor polarizabilidad, y por lo tanto suavidad. También podríamos pensar si F - probablemente sería más duro o más suave que H 2 O. F es un poco más pequeño que O, pero F lleva una carga negativa, por lo que el caso es ambiguo.
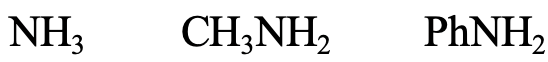
A continuación, veamos las series NH 3, CH 3 NH 2 y PhNH 2 (Fig. 4.2.11). El átomo donador de N es un átomo pequeño, poco polarizable, por lo que la especie debe considerarse dura. Sin embargo, N es algo mayor que O, lo que significa que NH 3 es algo más blando que H 2 O. CH 3 NH 2 sería un poco más suave que NH 3 debido al efecto inductivo positivo del grupo metilo, y la anilina sería un poco más suave que la metilamina porque de posibilidad de deslocalizar el par solitario en N en el anillo aromático.
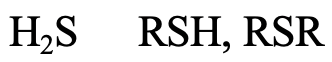
¿Qué pasa con H 2 S, alquil tioles y di alquil tioles (4.2.12)? El átomo donador de S se encuentra en el 3er periodo, y lo suficientemente grande como para ser considerado blando. Se esperaría que la suavidad aumentara algo de H 2 S a R-SH a R-S-R debido al efecto inductivo positivo del grupo alquilo.
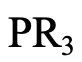
El siguiente ejemplo es una fosfina de fórmula general PR 3 (4.2.13). Al igual que el azufre, el fósforo es un átomo donante del período 3, y las fosfinas son generalmente blandas.

Por último, veamos el monóxido de carbono y el cianuro (Fig. 4.2.14). A primera vista estas especies aparecen como bases duras debido a los pequeños átomos donantes de carbono. Sin embargo, en realidad son bastante blandos debido a su capacidad para usar sus orbitales π y π* en enlaces π con ácidos de Lewis, en particular iones de metales de transición. Analizaremos más de cerca este tema más adelante cuando discutamos en detalle la unión en complejos de metales de transición.
Ejemplo - Ácidos
Ahora pensemos en la dureza de los ácidos.

En las series H +, Li +, Na +, K +: ¿Son estos ácidos duros o blandos y cómo cambia la dureza dentro de esta serie (Fig. 4.2.15)? La respuesta es: Todos los cationes de metales alcalinos se consideran ácidos duros, incluso el catión K + relativamente grande en el 4to periodo. Esto se debe a que los cationes de metales alcalinos solo tienen orbitales de valencia s y, por lo tanto, carecen de orbitales adecuados para la unión π. Dentro de la serie H + es el más duro y K + es el más suave debido a que el radio iónico aumenta con el incremento del periodo.
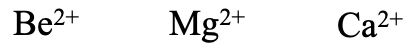
De igual manera, los metales alcalinotérreos Be 2 +, Mg 2+ y Ca 2 + son cationes duros con la dureza decreciente de Be 2 + a Ca 2 +. Debido a que los cationes de metales alcalinotérreos de carga 2+ se esperan más duros que los cationes de metales alcalinos del mismo periodo, por ejemplo Be 2 + debe estimarse más duro que Li +.

En las siguientes series BF 3, BCl3, B (CH 3) y BH 3 la dureza disminuye de BF 3 a BH 3 (Fig. 4.2.17). El BCl 3 es más blando que BF 3 debido a la menor electronegatividad de Cl versus F. El F más electronegativo retira más densidad de electrones del boro haciéndolo más pequeño, y por lo tanto más duro. Debido al efecto inductivo positivo, el B (CH 3) 3 es más suave que el Bcl3. Las moléculas BF 3 y Bcl3 se consideran ácidos duros en general, la B (CH 3) 3 es un caso intermedio. A primera vista, parecería que BH 3 es más duro que B (CH 3) 3, sin embargo actúa más como un ácido blando, posiblemente por el carácter hidrido del compuesto.

A continuación consideremos las series de iones de metal de transición Fe 2 +, Fe 3+, Co 2 +, Co 3+, Rh 3 +, Ir 3+ (Fig. 4.2.18). Estos cationes tienen la capacidad de hacer π-bonding, pero debido a la mayor carga 2+ y 3+ respectivamente, ninguno de ellos es blando. Todos los cationes del periodo 4 con una carga 3+, concretamente Fe 3 + y Co 3 + son ácidos duros, los iones Fe 2 + y Co 2 + están en el límite entre duros y blandos debido a su menor carga. Rh 3 + e Ir 3 + también están en el límite. Tienen una mayor carga positiva, pero se encuentran en el periodo 5 y 6, respectivamente. Se esperaría que Rh 3 + fuera más duro que Ir 3 + porque se encuentra en un periodo menor.

Ti 4 + y Si 4 + son ambos ácidos duros (Fig. 4.2.19). Generalmente, todos los iones con una carga de +4 o superior son ácidos duros.
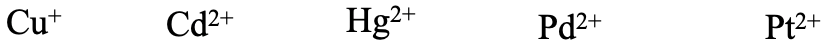
¿Y las últimas series Cu +, Cd 2+, Hg 2 +, Pd 2+ y Pt 2 + (Fig. 4.2.20)? Piénsalo. Todos ellos son considerados ácidos blandos. Cu + es un elemento de periodo 4 relativamente bajo, pero solo tiene una carga 1+, y tiene orbitales d para la unión π. Hg 2 +, Pd 2+ y Pt 2 + tienen una carga de 2+ algo mayor, pero son elementos de periodo 5 y 6, y también tienen orbitales d para la unión π. Pt 2 + se esperaría más suave que Pd 2 + debido a su mayor periodo.
Medidas Cuantitativas para la
De las consideraciones anteriores hemos visto que es posible hacer estimaciones cualitativas, y en algunos casos semicuantitativas sobre la dureza de ácidos y bases, pero no son una medida cuantitativa para la dureza. Una escala de dureza que permite medir cuantitativamente la dureza es el concepto de dureza absoluta de Pearson (Equ. 4.2.1).
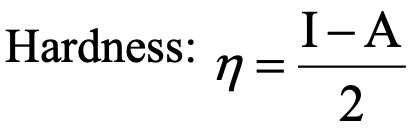
Ecuación 4.2.1 Ecuación para el cálculo cuantitativo de la dureza absoluta
Se relaciona la dureza con la diferencia entre la energía de ionización y la afinidad electrónica sobre 2.
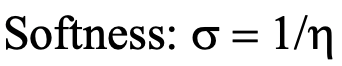
Ecuación 4.2.2 Ecuación para el cálculo cuantitativo de suavidad
La suavidad se define entonces como la inversa de la dureza absoluta (Ec. 4.2.2).
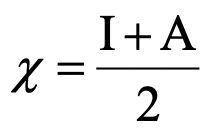
Ecuación 4.2.3 Ecuación para la electronegatividad de Mulliken
Podemos ver inmediatamente que la dureza absoluta está relacionada con la escala de electronegatividad de Mulliken que es la energía de ionización + la afinidad electrónica sobre 2 (4.2.3).
¿Cuál es la idea detrás de esta definición? Anteriormente hemos discutido cualitativamente que las especies duras tienden a tener grandes diferencias de energía orbital, mientras que las especies blandas tienden a tener pequeñas diferencias de energía orbital. Por lo tanto, tiene sentido definir la diferencia de energía entre el orbital atómico o molecular ocupado más alto y el orbital atómico o molecular desocupado más bajo, una medida cuantitativa para la dureza de una especie (Ec. 4.2.4).
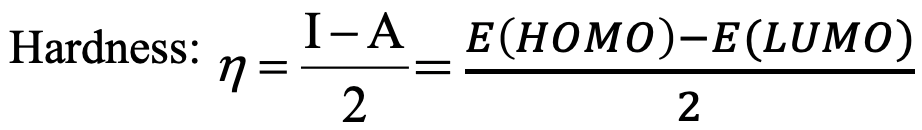
Ecuación 4.2.4 Ecuación extendida para el cálculo de la dureza absoluta
La primera energía de ionización IE es menos la energía del orbital atómico/molecular ocupado más alto: IE=-E (HOMO o HOAO) y la afinidad electrónica es menos la energía del orbital molecular u atómico desocupado más bajo: EA=-E (LUMO/LUAO). Por lo tanto, la diferencia entre el HOMO/HOAO y el LUMO/LUAO es la misma que la diferencia entre la energía de ionización y la afinidad electrónica.
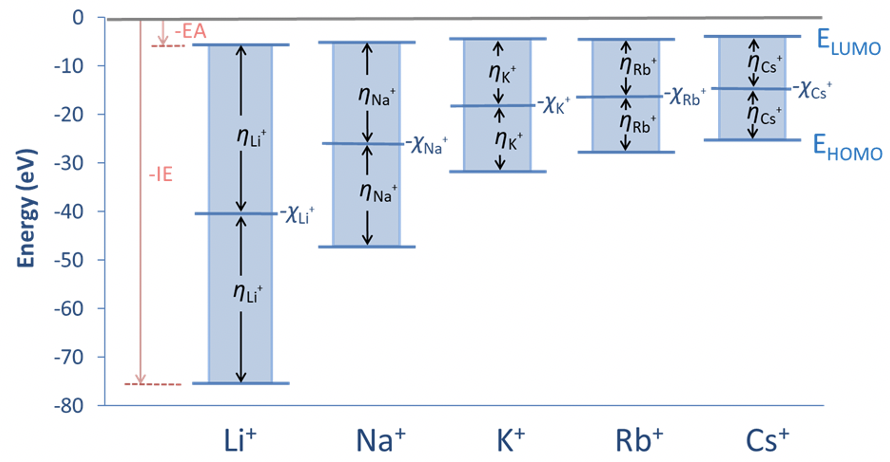
La Figura 4.2.21 ilustra el concepto de dureza absoluta para el ejemplo de los cationes de metales alcalinos. Se puede ver que los orbitales atómicos desocupados más bajos son bastante similares en energía, pero la energía del orbital atómico ocupado más alto aumenta significativamente del Li + al Cs +. Así, las diferencias de energía disminuyen del Li + al Cs +, y la dureza absoluta η es apenas la mitad del valor. La energía en el eje y a medio camino entre la energía HOMO y la LUMO es menos la energía asociada con la electronegatividad de Mulliken.
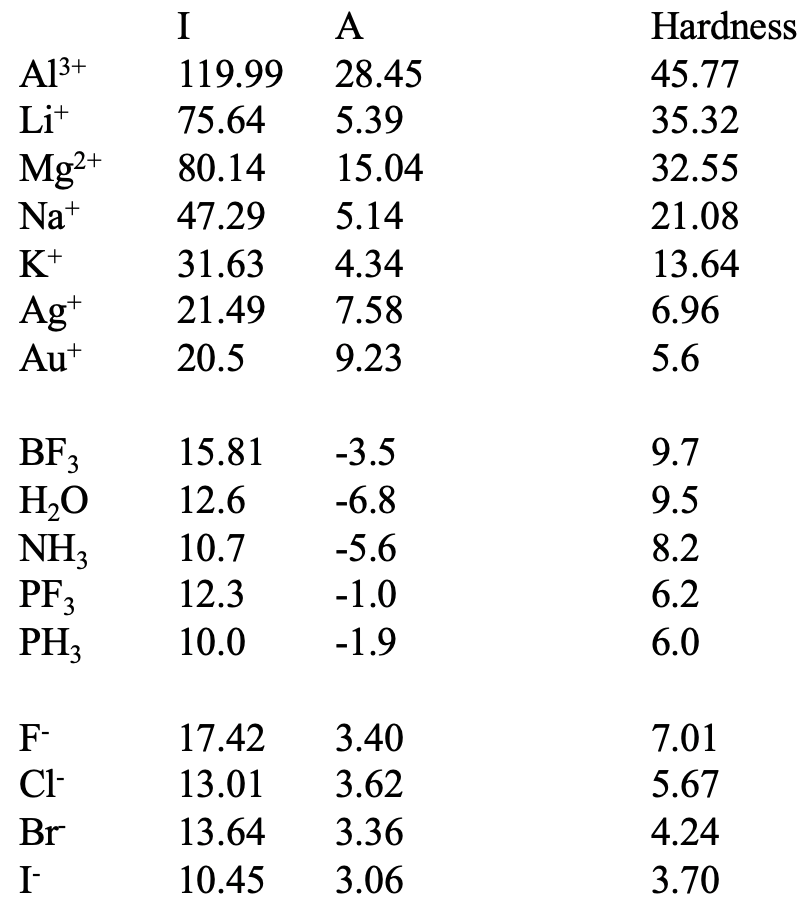
En la tabla anterior (Fig. 4.2.22) se puede ver una serie de ácidos y bases junto con su dureza calculada a partir de energías de ionización y afinidades electrónicas. Comprobemos si los valores calculados están en línea con las expectativas y veamos qué valor adicional aporta el concepto de dureza absoluta. Por ejemplo, podemos ver que Li + es más duro que Na + que es más duro que K +. Esto es lo que esperábamos.
También podemos ver que podemos determinar la dureza relativa que no es posible mediante inspección cualitativa. Por ejemplo, podemos ver que Al 3 + es más duro que Li +. Desde la perspectiva del tamaño atómico, un Al neutro es más grande que un Li neutro, y desde esa perspectiva el Li + debería ser más difícil. Por otro lado la carga positiva es mayor sobre Al en comparación con Li. Desde ese punto de vista el Al debería ser más duro. Por inspección cualitativa no pudimos decir qué parámetro domina la dureza general. El concepto de dureza absoluta muestra que (para este caso) la carga es más importante que el tamaño del átomo neutro. De igual manera no pudimos decidir por inspección que Mg 2 + era más suave que Li + porque los argumentos de carga sugerirían que Mg 2 + es más difícil mientras que los argumentos de tamaño de átomo neutro dirían que Li + debería ser más difícil. Podemos ver que en este caso el tamaño del átomo neutro tiene un mayor impacto, aunque sólo ligeramente. Según nuestras expectativas, el Mg 2 + es más duro que el Na + ya que ambos iones son vecinos en el mismo periodo, y por lo tanto muy similares en radio atómico, pero el Mg tiene la mayor carga positiva. También podemos ver que Ag + y Au + tienen una dureza mucho menor que K + que esperaríamos. También entenderíamos que el Au + tiene un valor menor que Ag + porque estos elementos están en el mismo grupo, y Au + está en el periodo 6, mientras que Ag + está en el periodo 5.
Debajo de Au + se puede ver un grupo de moléculas neutras. Solo la molécula BF 3 es un ácido de Lewis, otras moléculas son bases de Lewis. Podemos ver que BF 3 tiene una dureza relativamente alta, pero es más suave que K +. De las bases, H 2 O es la base más dura, seguida de NH 3, seguida de PF 3 seguida de PH 3. Esto es lo que esperábamos. O es el átomo donante más pequeño, seguido de N, seguido de P. PF 3 es más duro que PH 3 debido a la mayor electronegatividad del flúor frente al hidrógeno.
El último grupo son los aniones halógenuros. Según las expectativas F -es el más duro y yo - es el más suave. Podemos ver que Cl - tiene un valor de dureza menor que PH 3. El comportamiento químico de este último es el de una base blanda, mientras que el primero todavía se considera una base relativamente dura. Podemos ver que también necesitamos tratar los valores de dureza absoluta con cierta precaución, no es un método omnipotente, otros factores pero los valores de energía HOMO y LUMO también pueden influir en la polarizabilidad.
Al comparar los tres grupos vemos que los cationes tienden a tener los valores de dureza más altos, seguidos de las moléculas neutras. Los aniones tienden a tener los valores más bajos. Esto significa que un ácido duro tiende a tener un valor de dureza absoluta más alto que una base dura. Para interpretar los valores significativos, por lo tanto, solo debemos comparar ácidos con ácidos y bases con bases.
El concepto HSAB y las solubilidades
Debido a que el concepto HSAB puede estimar la fuerza de las interacciones entre los ácidos de Lewis y las bases de Lewis, también puede estimar una serie de otras propiedades que se derivan de esta fuerza de interacciones. Por ejemplo, se puede utilizar para estimar solubilidades. Cuando la interacción ácido-base de Lewis entre catión y anión es fuerte esperaríamos baja solubilidad, cuando la interacción es débil entonces esperaríamos alta solubilidad.
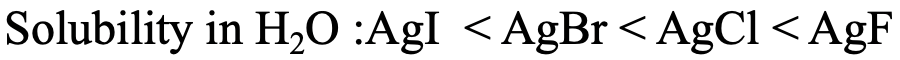
Por ejemplo, se sabe que la solubilidad de los halogenuros de plata en agua aumenta de AgI a AgBr a AgCl a AgF (Fig. 4.2.23). Esto está de acuerdo con el concepto HSAB. Ag + se considera blando, y así haría las interacciones más fuertes con el anión más blando, el yoduro I -. Ag + haría las interacciones más débiles con F -, porque es la más dura.
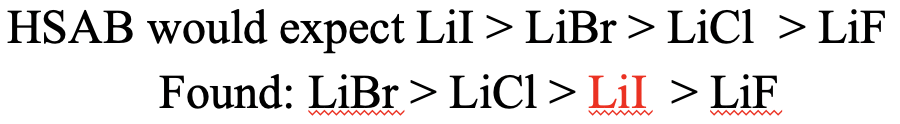
¿Cuáles serían nuestras expectativas para los halogenuros de litio (Fig. 4.2.24)? En este caso, esperaríamos que la solubilidad disminuyera de LiI a LiBr, a LiCl, a LiF. ¿Por qué? Esto se debe a que Li + es un catión duro, y por lo tanto las interacciones más fuertes deberían resultar con F -. En consecuencia, LiF tendría la solubilidad más baja. I - es el anión más suave, por lo que debería hacer las interacciones más débiles con Li + .Consecuentemente, el LiI tendría la mayor solubilidad. ¿Esto es lo que observamos experimentalmente? La mayor solubilidad experimentalmente observada es la de LiBr, seguida de LiCl, seguida de LiI. LiF tiene la solubilidad más baja. Podemos ver que la solubilidad de LiI no es lo que esperábamos. En lugar de tener la solubilidad más alta, tiene la segunda solubilidad más baja. Podemos ver aquí las limitaciones del concepto HSAB. También hay otros factores que determinan la solubilidad, en particular la entalpía de solvatación. I - tiene una entalpía de hidratación muy baja, lo que explica la solubilidad de LiI menor a la esperada. En cierto modo, el concepto HSAB es capaz de explicar la baja entalpía de hidratación de I -porque se basa en la fuerza de interacción entre I - y el agua. El agua es un ácido duro y por lo tanto interactúa sólo débilmente con una base blanda como I -. Esto puede servir como explicación de la baja entalpía de hidratación.
Otro buen ejemplo para ilustrar los efectos de la entalpía de solvatación sobre la solubilidad es la solubilidad de los halogenuros de plata en amoníaco líquido (no amoníaco acuoso). En realidad se invierte, el aGF tiene la solubilidad más pequeña y el AGi tiene la solubilidad más alta. La interacción HSAB entre Ag + y los iones halogenuro son las mismas sin importar el disolvente. Por lo tanto, no pueden servir de explicación. Más bien, podemos argumentar que las entalpías inversas de solvatación en amoníaco líquido en comparación con el agua líquida son responsables del comportamiento inverso. Desde el punto de vista del HSAB, las moléculas de amoníaco ya son significativamente más blandas que las moléculas de agua, por lo que las interacciones con los aniones blandos se vuelven significativamente más fuertes.
El concepto HSAB y la estabilidad
El concepto HSAB también puede ser utilizado para estimar las estabilidades termodinámicas de los compuestos, tales como puntos de descomposición, puntos de fusión etc. Generalmente, cuanto mayores sean las interacciones ácido-base mayor será la estabilidad termodinámica esperada. Hagamos un par de ejercicios para practicar este concepto.
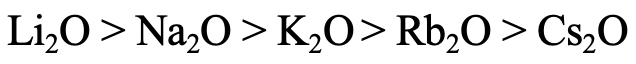
¿Qué orden de estabilidad termodinámica esperaría para los óxidos alcalinos (Fig. 4.2.25)? La respuesta es: La estabilidad disminuye con el incremento del periodo del metal alcalino. ¿Por qué? El anión óxido se considera una base dura debido a su radio relativamente pequeño. Así, las interacciones más fuertes se esperan con el Li + que es el metal alcalino más duro, y las interacciones más débiles se esperarían para el Cs + que es el metal alcalino más blando. Esto está en línea con las observaciones experimentales. Solo Li da Li 2 O cuando se quema en O 2, Na da peróxido de sodio y los metales alcalinos restantes dan superóxidos.
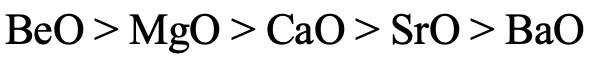
Podemos hacer la misma pregunta para los óxidos alcalinotérreos (Fig. 4.2.26). De igual manera, la estabilidad de BeO es la más alta porque Be tiene la dureza más alta. BaO tiene la estabilidad más baja porque Ba 2 + es el catión alcalinérreo más blando. Ba da peróxido de bario en lugar de óxido de bario cuando se quema en O 2.
El concepto HSAB y la acidez
El concepto HSAB también puede explicar la acidez de Brønsted. ¿Cómo?
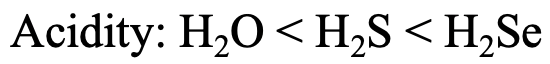
Veamos las series H 2 O, H 2 S y H 2 Se (Fig. 4.2.27). La acidez de Brønsted aumenta de H 2 O a H 2 S a H 2 Se. ¿Por qué? H + es un ácido duro, por lo que las interacciones más fuertes se esperarían con la base más dura, el ion óxido, y las interacciones más débiles se esperarían con la base más blanda, el anión Se 2 -. Por lo tanto, H 2 Se pierde un protón con mayor facilidad, convirtiéndolo en el ácido más fuerte. Para H 2 O la acidez es la más pequeña debido a que las interacciones entre H + y O 2- son las mayores.
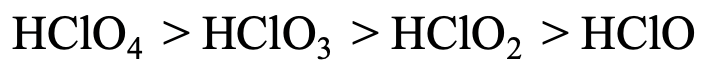
Pasemos a un ejemplo algo más complicado (Fig. 4.2.28). La acidez del ácido perclórico, ácido clórico, ácido cloroso y ácido hipocloroso disminuye de HClO 4 a HClO 3 a HClO 2 a HClO. En este caso todos los protones están ligados al oxígeno, por lo que no podemos argumentar como antes. Sin embargo, podemos argumentar que la carga negativa en los aniones de los ácidos está más deslocalizada en el caso del ácido perclórico porque el mayor número de estructuras de resonancia se pueden extraer para el ácido perclórico. Debido a que la carga negativa está más deslocalizada, el electrón es más polarizable, y por lo tanto el más suave. Para el ácido hipoclórico tenemos el caso contrario. No hay deslocalización electrónica posible y solo se puede dibujar una estructura de resonancia para el anión hipoclorito. Por lo tanto, es el más duro, interactuando el más fuerte con el protón.
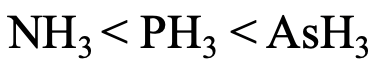
Por último, ¿pensemos en la basicidad relativa de NH 3, PH 3 y ASH 3 (Fig. 4.2.29)? El átomo de N es la base más dura, y las interacciones con los protones son las más fuertes. Por lo tanto, NH 3 es la base más fuerte. Ash 3 es la base más débil porque As es el átomo más suave que hace las interacciones más débiles con los protones.


